乳腺癌容积调强放疗皮肤通量外扩的方法及其有效性评估
李霞,余行,王磊,傅玉川
(四川大学华西医院放疗科,四川 成都 610041)
多学科综合治疗是乳腺癌治疗的基本原则,改良根治术后辅助放疗可有效控制局部复发和远处转移,具有十分重要的临床意义[1]。乳腺癌改良根治术后的辅助放疗的照射靶区范围主要包括胸壁和锁骨上、下淋巴结区[2]。由于胸壁较薄,不同层面弯曲度变化较大,靶区形状不规则,同时还要限制肺和心脏等重要危及器官(organs at risk,OARs)的受照剂量和体积[3],因此设计乳腺癌改良根治术后的放疗计划难度较大。在目前常用的放疗技术中,与三维适形放疗(three-dimensional conformal radiation therapy,3DCRT)和静态调强放疗(intensity-modulated radiation therapy,IMRT)相比,容积调强弧形放疗(volumetric modulated arc therapy,VMAT)不仅可以得到较好的靶区剂量均匀性和较高的适形度,还能提高靶区覆盖度和降低危及器官的剂量,表现出更多的剂量学优点[4]。
乳腺癌改良根治术后放疗的一个重要特点就是临床靶区(clinical target volume,CTV)接近皮肤表面,考虑到呼吸运动和摆位误差的影响,当外扩CTV形成计划靶区(planning target volume,PTV)时,PTV会延伸到皮肤之外。因此,在设计相应的放疗计划时,射野通量应延伸至对应的皮肤之外以包含PTV[5-7]。手动编辑法(manual editing method,ME方法)是皮肤通量外扩的常规方法,但仅适用于3DCRT计划[5-7]和IMRT计划[5-9]。瓦里安公司的Eclipse计划系统还提供了专门的皮肤通量外扩工具即系统工具法(treatment planning system tool method,ST方法)[6,10]。但VMAT计划限制了射野多叶准直器(multi-leaf collimator,MLC)的手动编辑功能,ME方法和ST方法都不可用。虚拟补偿法(virtual bolus method,VB方法)虽然在理论上具有较强的可行性,但还缺乏充分的实际应用验证[6,11];而且在计划过程中需要多次验证虚拟补偿的厚度和密度,反复调整优化,过程相对繁琐[12-13]。虚拟靶区法(virtual target method,VT方法)是将需要进行皮肤通量外扩的区域定义为一个虚拟靶区,添加相关的剂量条件进行逆向优化,由此实现皮肤通量外扩的目的。与VB方法相比,此法相对简单,不需要定义和修改虚拟结构的密度。鲁棒优化法(robust optimization method,RO方法)最初主要是为了解决粒子治疗计划的稳健性问题[14],因为粒子治疗中笔形束剂量梯度较陡峭,照射治疗的精准性对患者位置的不确定性敏感,用外扩边界形成PTV的常规方法无法得到鲁棒性较好的临床计划。在乳腺癌光子放疗计划中运用RO方法来实现皮肤通量外扩也可能得到稳健性较好的治疗计划[15-17],但是目前还没有统一的标准和方法来实现VMAT计划中的皮肤通量外扩。
本研究拟比较基于VT方法和RO方法的乳腺癌容积调强放疗计划剂量和扰动剂量,系统评估VT方法和RO方法在实现VMAT计划皮肤通量外扩方面的有效性,其中扰动剂量的计算通过模拟计划等中心的移动实现,设计0.5 cm,1.0 cm和1.5 cm三种误差情况。
1 资料与方法
1.1 一般资料
选取2020年7月至2021年1月在四川大学华西医院接受了乳腺癌改良根治术后VMAT放疗的20例患者,其中包括10例左乳患者和10例右乳患者。所有患者平均年龄47.5(29~73)岁;临床分期依循肿瘤淋巴结转移(tumor node metastasis,TNM)分期标准,其中2例(10.00%)T1N1M0,5例(25.00%)T2N1M0,7例(25.00%)T2N2M0,4例(20.00%)T2N3M0,1例(5.00%)T4N1M0,1例(5.00%)T4N3M0。
1.2 靶区和OARs的定义
所纳入病例均选自同一放疗医生组,所有的靶区和OARs的定义都经过同一医疗组长的审核确认。CTV1定义为锁骨上靶区,CTV2定义为胸壁靶区。根据治疗摆位的质量情况,由临床靶区CTV1和CTV2在三维方向分别外扩0.3 cm和0.5 cm自动生成初始计划靶区PTV1和PTV2。然后将PTV1和PTV2分别收至皮下0.5 cm和0 cm。由于患者接受的是乳腺癌改良根治手术,胸壁表面也需要足够的剂量照射。因此,胸壁部分的计划靶区PTV2只需收至皮肤表面。同时,为了保证胸壁部分的皮肤表面接受足够的照射剂量,还需在计划设计时添加组织补偿膜。具体的OARs包括心脏、同侧肺、对侧肺、对侧乳腺、脊髓、脊髓计划体积(planning organ at risk volume,PRV)[5]和同侧肱骨头。
1.3 计划设计和皮肤通量外扩的方法
1.3.1 计划设计 靶区PTV1和PTV2的处方剂量为50Gy/25F,计划目标和OARs的限量要求具体如下。计划目标是至少有98%体积的受照剂量≥处方剂量的90%,即45 Gy(D98≥45 Gy),95%体积的受照剂量≥处方剂量,即50 Gy(D95≥50 Gy),最多有2%体积的受照剂量≥处方剂量的110%,即55 Gy(D02<55 Gy)。OARs的限量要求如下:心脏的平均受照剂量<5 Gy(Dm<5 Gy);同侧肺的平均受照剂量<15 Gy(Dm<15 Gy),受到5 Gy照射的体积小于总体积的60%(V05<60%),受到20 Gy照射的体积<总体积的30%(V20<30%);对侧肺的平均受照剂量<5 Gy(Dm<5 Gy),受到5 Gy照射的体积<总体积的20%(V05<20%);对侧乳腺的平均受照剂量<5 Gy(Dm<5 Gy);脊髓和脊髓PRV任意2%体积的受照剂量<20 Gy和25 Gy(D02<20 Gy和D02<25 Gy);同侧肱骨头受到50 Gy照射的体积<总体积的5%(V50<5%)。
以每个病例原有的经过临床审核和治疗验证的临床计划作为基准,使用VT方法和RO方法为每个患者分别设计两个皮肤通量外扩2.0 cm的VMAT计划,即计划P_VT和P_RO。为了保持治疗计划的一致性和可比性,所有计划均由两名物理师采用统一的脚本在计划系统RayStation v4.7(瑞典RaySearch公司)中设计完成,两名物理师分别负责10例左乳计划和10例右乳计划。选用医科达Versa HD电子直线加速器的6MV-X射线进行VMAT部分弧计划设计。依据患者靶区的切线方向个体化设置射野的方向,部分弧的大小范围是190°~230°。所有计划中,均在靶区PTV2部分的皮肤表面模拟添加了密度为1.0 g/cm3、厚度为0.5 cm的组织补偿膜。完成计划优化后,所有计划均以95%的靶区PTV(PTV1和PTV2的并集)达到处方剂量进行归一。
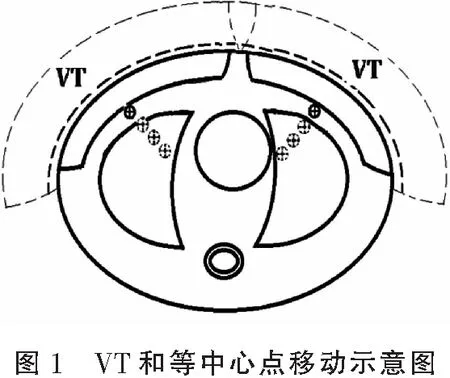
1.3.2 VT方法 首先由PTV2在横断面上外扩2.5 cm生成区域PTV2+25,同时由外轮廓在横断面上外扩0.5 cm生成区域E+0.5,然后将PTV2+25与E+0.5做差集运算得到虚拟靶区VT。见图1。最后需要由初始外轮廓和PTV2+25做并集运算得到新的外轮廓。此步骤中所有患者的虚拟靶区VT均由相关的脚本自动生成。在计划P_VT中,添加虚拟靶区VT的剂量体积条件,最小剂量6 Gy,权重设为10。
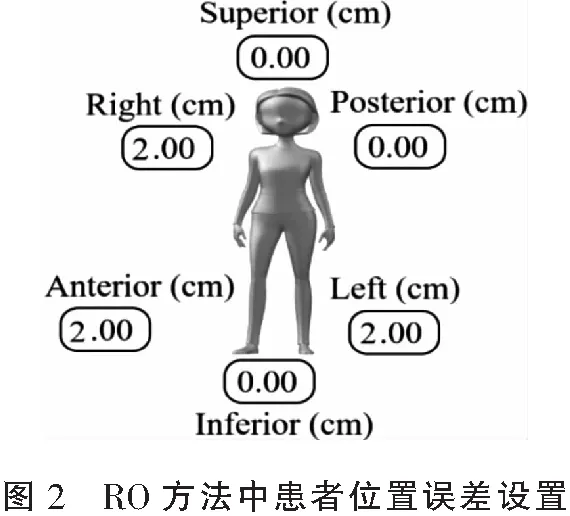
1.3.3 RO方法 在计划P_RO中设置优化参数时,首先将靶区PTV的Min Dose和Min DVH条件设定Robust,即鲁棒性。然后设置患者位置不确定度,即患者位置的最大误差。对于左乳患者,设置Anterior和Left两个方向最大误差均为2.0 cm。对于右乳患者,设置Anterior和Right两个方向最大误差均为2.0 cm。见图2。
1.4 评价指标
对于靶区,评估了临床靶区CTV(CTV1和CTV2的并集)和计划靶区PTV。评估参数除了D02、D95和D98,还包括均匀指数(homogeneity index,HI)和PTV的适形指数(conformal index,CI)。HI=(D02-D98)/D50,式中D02、D50和D98分别为2%、50%和98%的靶区体积所受到的照射剂量。HI值越大(越远离0)说明该计划的剂量分布均匀性越差。CI=(VTref/VT)×(VTref/Vref),式中VTref为参考等剂量线所覆盖的靶区体积,本研究中VTref为95%等剂量线包围的靶区体积,VT为靶区体积,Vref为95%等剂量线所覆盖的总体积。CI取值为0~1,越接近于1靶区适形度越好。
对于OARs,具体的评价参数包括心脏的Dm,同侧肺的Dm,V05和V20,对侧肺的Dm和V05,对侧乳腺的Dm,脊髓和脊髓PRV的D02及同侧肱骨头的V50。
为了进行皮肤通量外扩有效性的比较和评估,还统计分析了基于已定义的虚拟靶区VT的剂量体积参数Dm,V05,V10,V20,V30,V40和V50。
皮肤通量外扩的最终目的是避免由患者位置误差导致的靶区漏照。因而在评估基于定位图像的无扰动计划的同时,评估该计划在误差影响下的扰动剂量是检验皮肤通量外扩有效性的重要内容。该研究评估了等中心点在0.5 cm、1.0 cm和1.5 cm三种误差情况下的扰动剂量(等中心点的移动参见图1),因此每个患者均应评估2个初始计划及其各自对应的3个扰动计划共计8个计划。
1.5 统计学分析
2 结果
2.1 无扰动计划的剂量比较
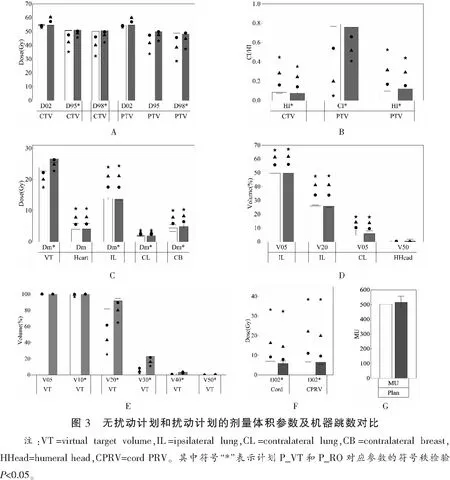
图3(A-G)以条形图的方式给出了20例乳腺患者各无扰动计划的感兴趣区域剂量体积参数对比和机器跳数对比,包括平均值和标准差,其中白底条和灰底条分别表示计划P_VT和P_RO对应的参数值。表1中列出了各无扰动计划的靶区参数对比;OARs的最大剂量差异对比,即脊髓PRV的D02,OARs的最大体积差异对比,即对侧肺的V05;VT的最大差异对比,即V20;以及计划的MU对比。
2.2 扰动计划的剂量比较
图3(A-F)以图形点的形式给出了20例乳腺患者各扰动计划的感兴趣区域剂量体积参数对比。其中图标点圆形、三角形和五角形依次表示等中心点误差为0.5 cm、 1.0 cm和1.5 cm时各计划的扰动剂量中对应参数的平均值。表2列出了各扰动计划的靶区参数对比和部分OARs的较差结果。
(1)当等中心点误差为0.5 cm时,靶区结果均稍有变差。对于OARs,同侧肺的Dm和V20,心脏和对侧乳腺的Dm都超出了处方要求。(2)当等中心点误差为1.0 cm时,靶区结果均继续变差,但P_RO计划在适形度方面优势显著。对于OARs,同侧肺的Dm,V05和V20,心脏和对侧乳腺的Dm都超出了处方要求。(3)当等中心点误差为1.5 cm时,靶区结果均继续变差,但可以明显看出,P_RO计划在适形度方面优势显著。对于OARs。脊髓和脊髓PRV的D02,同侧肺的Dm、V05和V20,心脏和对侧乳腺的Dm,都超出了处方要求。
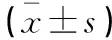
表1 无扰动计划的剂量体积参数及机器跳数对比
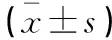
表2 扰动计划的剂量体积参数对比
3 讨论
皮肤通量外扩是乳腺癌放疗计划设计的一项重要要求,但VMAT计划由于自身技术的限制,并不能通过目前较通用的ME方法达到打开皮肤通量的目的[6]。VT方法通过定义虚拟靶区,设定相关目标函数的逆向优化达到外扩皮肤通量的效果。RO方法是在计划优化的过程中,考虑呼吸运动和摆位误差各种情况发生的概率大小,使优化得到的计划在即使有误差的情况下也能够保持较好的一致性,剂量变化较小,即优化结果具有较好的稳健性[14-15]。RaySearch公司的RayStation计划系统提供的RO方法是基于MinMax原理的优化方法,即在最大的误差下仍然保证计划的质量。在计划优化过程中,考虑各种可能/潜在误差导致的患者数据模型的多个最差情况,然后选择最差的目标值进行最小化优化[14-17]。Fredriksson等[18]指出RO方法与VB方法相当,都可以得到稳健性较好的计划,而且不需要额外定义虚拟ROI。Nguyen等[19]指出与RO方法相比,在保证靶区覆盖度和降低热点方面,VB方法更有优势。Byrne等[16]通过剂量测量验证,指出RO方法与其他方法相当,都实现了皮肤通量外扩。
本研究显示,对于VT方法和RO方法,P_VT计划可以得到较好的PTV的均匀性和适形性,P_RO可以得到较好的CTV的均匀性,且其在打开皮肤前界的效果方面具有较明显的优势,对于虚拟靶区中20 Gy的剂量体积占比差异达到了16.87%。虽然P_VT计划在MU方面稍有优势,但其差异性较小,且不具有统计学意义。在扰动剂量的评估方面,当等中心点存在误差时,与VT方法相比,使用RO方法得到的计划在靶区覆盖度,均匀性和适形性方面较有优势,而在对某些OARs的保护方面稍有劣势,如同侧肺,心脏,对侧乳腺和脊髓。但RO方法在靶区覆盖度、均匀性和适形性方面的优势较显著,在某些OARs保护方面的劣势几乎可以忽略。在模拟扰动剂量的过程中,确定等中心点的位移方向非常重要。患者相对等中心点的位移与等中心点相对患者的相对位置值相同,但位移方向相反。在RO方法中,设置患者位置误差时,左乳患者应是left和anterior方向,右乳患者则是right和anterior方向;当设置等中心点的位移模拟计算扰动剂量时,左乳患者应是X和Z均为负值,右乳患者是X为正值,Z均为负值。通过虚拟靶区VT的剂量体积参数量化评估皮肤通量外放的有效性是本研究的一大特点。皮肤通量外放的方法有很多,如ME方法,ST方法和VB方法等,但是却没有关于各方法定量比较和分析的方法和工具。通过定义虚拟靶区,将体表外轮廓和虚拟靶区进行并集运算重新定义计划外轮廓和剂量计算的范围,模拟计算皮肤通量外放区域的剂量,对VT方法和RO方法在皮肤通量外放方面的有效性进行了量化评估。由于虚拟靶区的区域实际是空气,密度较低,因此剂量计算的准确度和精确度不可避免地存在一定的误差。但是剂量计算的算法和其它模拟计算的条件均相同,因此VT的剂量计算结果作为量化评估的参数具有一定的科学性。
本研究的不足之处在于仅通过等中心点的位移进行了扰动剂量的计算,只模拟了刚性误差,后续研究仍需考虑呼吸运动和患者体位改变导致的形变误差,研究形变误差对开放皮肤通量的放疗计划的影响。VMAT计划中VT方法和RO方法在外扩皮肤通量方面有着一定的有效性,但该两种方法也适用于IMRT计划,而且相对于ME方法更加智能化和自动化。
综上,皮肤通量外扩是乳腺癌放疗计划设计的一项重要要求,对于VMAT技术来说,虚拟靶区法和鲁棒优化法都可以较好地实现皮肤通量外扩。与虚拟靶区法相比,使用鲁棒优化法得到的VMAT计划虽然均匀性相对较低,但是皮肤通量的打开效果较好,而且在等中心点存在误差时,仍能保证相对较好的靶区覆盖度、均匀性与适形性。

