南极磷虾油改善虾青素生物利用度的研究
刘小芳,刘建志,唐一新,2,孙伟红,张辉珍,冷凯良,4*
(1中国水产科学研究院黄海水产研究所 农业农村部极地渔业开发重点实验室 山东青岛 266071 2青岛大学医学部公共卫生学院 山东青岛 266021 3青岛市食品药品检验研究院 山东青岛 266071 4 青岛海洋科学与技术试点国家实验室 海洋药物与生物制品功能实验室 山东青岛 266200)
南极磷虾(Euphausia superba),广泛分布于南极海域,生物量达到6.5~10 亿t[1],资源蕴藏量巨大,具有打造我国第2 个远洋渔业的巨大潜力。近年来,近海资源面临枯竭,形势严峻,积极开发远洋生物资源成为我国海洋渔业发展的重要战略抉择。南极磷虾是南大洋中最大的单种生物资源,加快对其的开发利用具有重要意义。我国南极磷虾加工产业起步较晚,关键技术核心竞争力较弱,高附加值产品种类单一,产业发展驱动力不足[2]。加快系列高值产品开发,是推动南极磷虾产业发展的关键。
南极磷虾油是南极磷虾经提取、浓缩、过滤等工序制成的油脂制品,富含EPA/DHA 磷脂、虾青素等活性成分[3],与传统鱼油(EPA/DHA 甘油三酯)相比,其在调节脂质代谢/糖代谢[4-6],抑制炎症反应[6],改善神经细胞功能[7-8]等方面具有更优的生理功效。国际上,以南极磷虾油为基础,结合共轭亚油酸、辅酶Q10、维生素D、益生菌Lactobacillus reuteri 等功能食品原料[9-11],定位不同人群需求的衍生功能产品开发成为南极磷虾商业化发展的主要方向。南极磷虾油及其系列衍生产品市场产值达到数亿美元,直接驱动国际磷虾产业的快速发展。寻找适宜的功能食品原料,创新南极磷虾油衍生产品开发,提高产品国际竞争力,成为我国南极磷虾加工产业发展的重要方向。
虾青素(Astaxanthin),作为非维生素A 原脂溶性类胡萝卜素,广泛分布于虾、蟹、微藻等海洋食品原料中,是目前发现的自然界中最强的抗氧化剂[12]。天然虾青素以游离态或酯化态存在[13-15],具有改善体内氧化应激水平,预防和治疗心脑血管疾病与神经退行性疾病等多种生理活性[15-16],近年来在食品、功能食品、生物医药制品领域引起极大关注。虾青素在体内无法合成,只能通过膳食摄取,然而,受自身疏水特性的影响,其在生物体内的消化吸收利用率较低[15,17]。目前有研究指出,添加脂类物质是提高类胡萝卜素类物质生物利用度的有效办法[18-20],这为南极磷虾油结合天然虾青素提取物定向开发功能性产品提供了思路。综上,本研究拟在建立生物样品中虾青素定量检测方法的基础上,通过体内消化吸收实验评价南极磷虾油对天然虾青素生物利用度的影响,旨在证实南极磷虾油-虾青素功能组方产品开发的可行性,为新型南极磷虾油衍生产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
SPF 级雄性Wistar 大鼠 【生产许可证号:SCXK(鲁)20140007】,体重180~200 g,青岛大任富城畜牧有限公司;雨生红球藻(Haematococcus pluvialis)虾青素提取物【虾青素含量(16.0±0.57)%】,云南爱尔发生物技术股份有限公司;南极磷虾油【磷脂含量(49.8±0.52)g/100g,虾青素含量(188.3±4.71)mg/kg,脂肪酸组成中EPA(21.7±0.33)%、DHA(12.5±0.19)%】,青岛南极维康生物科技有限公司;甘油三酯型鱼油【脂肪酸组成中EPA(21.9±0.56)%、DHA(12.6±0.22)%】,江苏奥奇海洋生物工程有限公司。
全反式虾青素标准品(纯度≥95.8 %),德国Dr.Ehrenstorfer 公司;甲醇、甲基叔丁基醚等色谱纯试剂,德国Merck 公司;猪胆盐,北京索莱宝科技有限公司;戊巴比妥钠,山东西亚化学服务有限公司;丙酮、三氯甲烷、甲醇、磷酸、氢氧化钠等分析纯试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
LC-16 型液相色谱仪(配置Essentia SPD-16型紫外检测器),日本岛津公司;YMC-Carotenoid色谱柱(250 mm×4.6 mm,5 μm),日本YMC 公司;T10 型高速分散机,德国IKA 公司;Neofuge 15R型高速冷冻离心机,上海力申科学仪器有限公司;CTFD-10P 型真空冷冻干燥机,青岛永合创信电子科技有限公司;MD200 型氮吹仪,杭州奥盛仪器有限公司;MIX-28+型旋涡混匀器,杭州米欧仪器有限公司。
1.3 实验方法
1.3.1 灌胃乳剂的配制 参照文献[21]的方法,根据实验分组制备灌胃乳剂。分别称取适量雨生红球藻虾青素提取物、南极磷虾油、鱼油,加入0.5%猪胆盐溶液中,超声处理5 min 后,采用高速分散匀浆机于10 000 r/min 均质5 min,形成均一分散的乳浊液,即灌胃乳剂。
1.3.2 动物分组与饲养 SPF 级雄性Wistar 大鼠,适应性喂养1 周后,随机分为4 组:空白对照组、虾青素组、南极磷虾油+虾青素组、鱼油+虾青素组,每组50 只。按照成人每日膳食摄入量(南极磷虾油2 g/d 或鱼油2 g/d、虾青素12 mg/d)等量换算成大鼠剂量,灌胃给予相应脂肪乳剂,空白对照组给予等量猪胆盐溶液作对照。实验前12 h 禁食、不禁水,于灌胃后0,0.5,1,2,4,8,10,12,16,24 h,经3%戊巴比妥钠麻醉,腹主动脉取血后致死,分离血清,剥离肠道(胃幽门部至盲肠顶端),采用生理盐水冲洗收集肠道内容物,然后将小肠部分纵向剖开,刮取小肠绒毛。血清、小肠绒毛、肠道内容物等生物样品经液氮速冻后置于-80 ℃冰箱,备用。
1.3.3 虾青素含量测定
1.3.3.1 样品前处理 参照文献[22]至[24]方法提取生物样品中虾青素,实验过程尽量避光操作。
血清样品前处理:取适量血清,加入5 倍体积三氯甲烷-甲醇溶液(2∶1,体积比) 涡旋浸提1 min,静置5 min,于4 ℃8 000 r/min 离心5 min,收集下层溶液,重复提取3 次,合并提取液,经0.45 μm 滤膜过滤后氮气吹干,采用甲醇-甲基叔丁基醚溶液(1∶1,体积比)复溶,待测。
小肠绒毛样品前处理:小肠绒毛经真空冷冻干燥后,研磨粉碎,加入三氯甲烷-甲醇溶液(2∶1,体积比)涡旋浸提1 min,静置5 min,于4 ℃8 000 r/min 离心5 min,收集上清液,重复提取3 次,合并提取液,经0.45 μm 滤膜过滤后,氮气吹干,采用甲醇-甲基叔丁基醚溶液(1∶1,体积比)复溶,待测。
肠道内容物样品前处理:肠道内容物经真空冷冻干燥后,研磨粉碎,加入三氯甲烷-甲醇溶液(2∶1,体积比)涡旋浸提1 min,静置5 min 后,于4℃8 000 r/min 离心5 min,收集上清液,重复提取3 次,合并提取液,定容25 mL。移取浸提液2 mL于10 mL 容量瓶中,加入0.5 mL 0.1 mol/L 氢氧化钠-甲醇溶液,充氮密封,于4 ℃皂化12 h 后采用2%磷酸-甲醇溶液中和剩余碱液,混匀,定容10 mL,经0.45 μm 滤膜过滤后,待测。
1.3.3.2 色谱条件[24]色谱柱:YMC-Carotenoid 色谱柱(250 mm×4.6 mm,5 μm);流动相A:甲醇;流动相B:甲基叔丁基醚;流动相C:1%磷酸溶液;梯度洗脱程序见表1。流速:1.0 mL/min;进样量:20 μL;检测波长:474 nm;外标法定量。

表1 液相色谱梯度洗脱程序Table 1 The gradient elution program of HPLC
1.4 生物利用度的计算
根据血清虾青素含量变化曲线,采用梯形面积法计算曲线下面积(Area under the curve,AUC0-t),通过AUC0-t的大小来衡量不同实验组虾青素的生物利用度高低[25-26]。AUC0-t计算公式:

式中,A,B,C,D,E,F,G,H,I,J——分别表示0,0.5,1,2,4,8,10,12,16,24 h 时间节点下血清虾青素浓度水平。
1.5 数据处理
实验数据为“平均值±标准偏差”,采用Excel 2016、SPSS Statistic 20 等软件进行数据处理和统计分析。不同实验组间采用one-way ANOVA(Tukey)进行两两比较,以P<0.05 为具有统计学意义上的显著差异。
2 结果与分析
2.1 生物样品中虾青素定量检测方法的方法学考察
2.1.1 检出限及线性范围 按照信噪比为3,测得方法检出限为0.05 μg/mL。在质量浓度0.10~5.0 μg/mL 范围,虾青素浓度(X)与仪器响应峰面积(Y)呈现良好的线性关系,Y=240735X-7526.3(R2=0.9993),可通过外标法实现准确定量。
2.1.2 回收率及精密度 不同生物样品中虾青素的分离图谱见图1。在确定的检测条件下,虾青素标准品的出峰时间为10.122 min,大鼠血清、小肠绒毛、肠道内容物等样品中虾青素与其它杂质实现良好分离,基本无干扰,加标回收率为85.24%~110.49%,相对标准偏差(RSD)为2.63%~9.50%(表2、表3)。同一样品重复测定6 次,RSD 为1.06%。本方法的加标回收效果良好,准确度高,可用于生物样品中虾青素含量的测定。
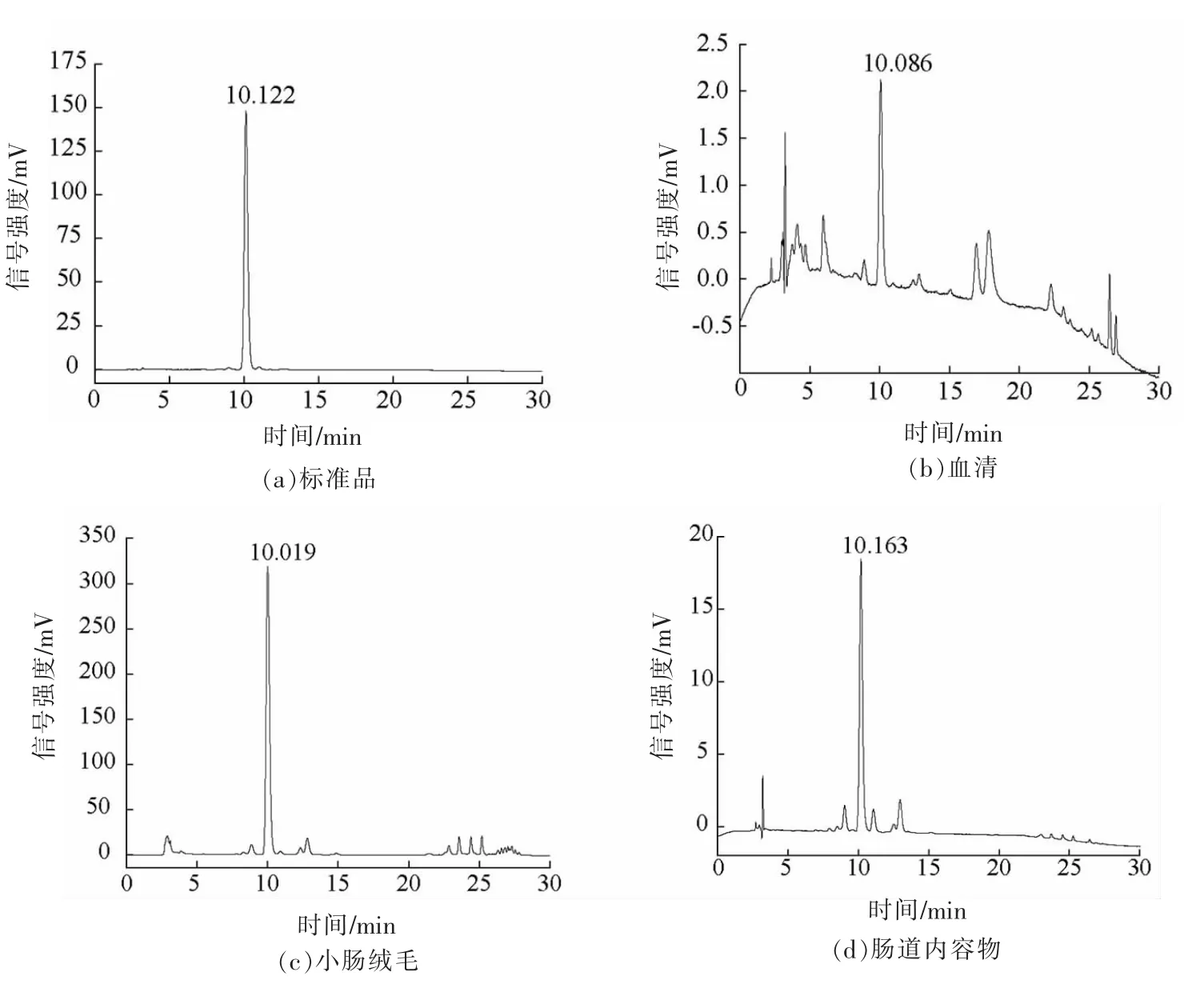
图1 标准品和生物样品中虾青素高效液相分离图谱Fig.1 The HPLC chromatograms of astaxanthin in standard substance and biological samples

表2 大鼠血清中虾青素加标回收率Table 2 The recoveries of astaxanthin in the serum of rats
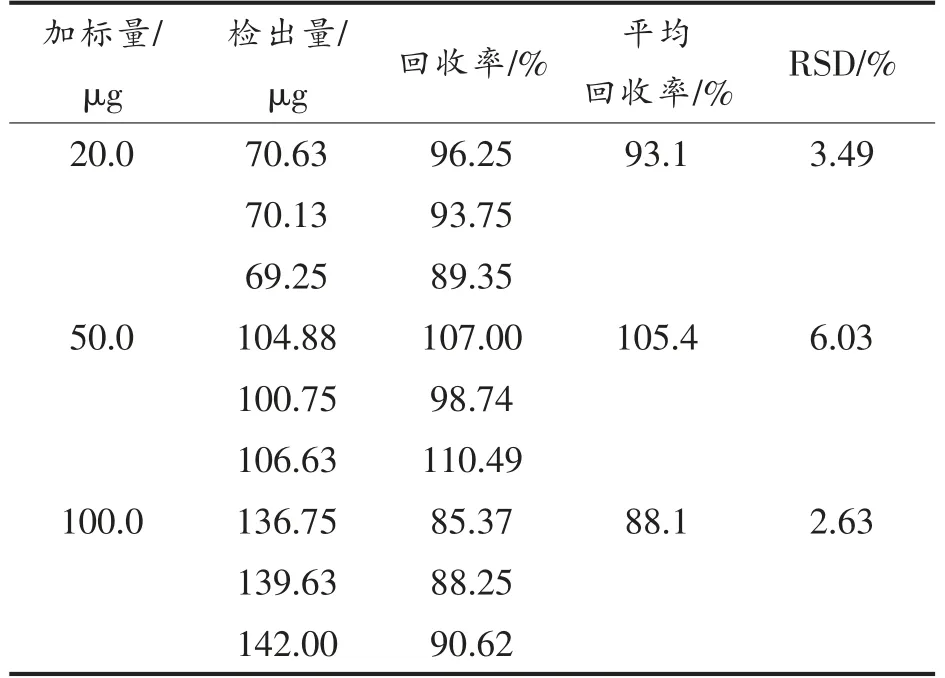
表3 大鼠肠道内容物中虾青素加标回收率Table 3 The recoveries of astaxanthin in the intestinal contents of rats
2.2 生物样品中虾青素含量的变化
2.2.1 不同实验组大鼠肠道内容物中虾青素含量的变化 大鼠肠道内容物中虾青素含量变化见图2。各实验组大鼠肠道内容物中虾青素含量呈先上升后下降的变化,于灌胃给予受试物后2~4 h达到峰值,而后逐渐降低,12 h 时在其肠道内容物中检出的虾青素极少,至24 h 受试物在消化道内基本排空。在0.5,1,2,4,8,10 h 等时间节点,不同实验组大鼠肠道内容物中虾青素含量存在显著差异(P<0.05)。虾青素组大鼠肠道内容物虾青素含量于2 h 时达到峰值(18.1±2.59)μg,南极磷虾油+虾青素组大鼠肠道内容物虾青素含量于4 h时达到峰值(64.9±9.54)μg,鱼油+虾青素组大鼠肠道内容物虾青素含量于2 h 时达到峰值(57.5±4.98)μg。

图2 大鼠肠道内容物中虾青素含量变化Fig.2 Changes of the astaxanthin levels in the intestine contents of rats from different experimental groups
2.2.2 不同实验组大鼠小肠绒毛中虾青素含量的变化 大鼠小肠绒毛中虾青素含量变化见图3。灌胃给予大鼠受试物后,小肠绒毛中虾青素含量逐渐升高,于4 h 达到峰值,而后逐渐下降,至16h 后基本无检出。在1,2,4,8,10 h 等时间节点,不同实验组大鼠小肠绒毛中虾青素含量存在显著差异(P<0.05)。虾青素组大鼠小肠绒毛虾青素含量峰值为(101.8±25.52)ng;鱼油+虾青素组大鼠小肠绒毛虾青素含量峰值为(226.7±41.39)ng,是虾青素组的2.23 倍(P<0.05);南极磷虾油+虾青素组大鼠小肠绒毛虾青素含量峰值为(700.2±128.68)ng,是虾青素组的6.88 倍(P<0.05),是鱼油+虾青素组的3.09 倍(P<0.05)。

图3 大鼠小肠绒毛中虾青素含量变化Fig.3 Changes of the astaxanthin levels in the intestinal villus of rats from different experimental groups
2.2.3 不同实验组大鼠血清中虾青素含量的变化大鼠血清中虾青素含量变化见图4。各实验组大鼠血清中虾青素含量在灌胃给予受试物0.5 h后开始缓慢上升,于8 h 达到峰值,随后开始逐步下降,于12~16 h 恢复至初始水平。在0.5,1,2,4,8,10,12 h 等时间节点,不同实验组大鼠血清虾青素含量存在显著差异(P<0.05)。虾青素组大鼠血清虾青素含量峰值为(1.89±0.26)μg/L;鱼油+虾青素组大鼠血清虾青素含量峰值为(3.94±0.27)μg/L,是虾青素组的2.08 倍(P<0.05);南极磷虾油+虾青素组大鼠血清虾青素含量峰值为(15.8±2.09)μg/L,是虾青素组的8.37 倍(P<0.05),是鱼油+虾青素组的4.02 倍(P<0.05)。
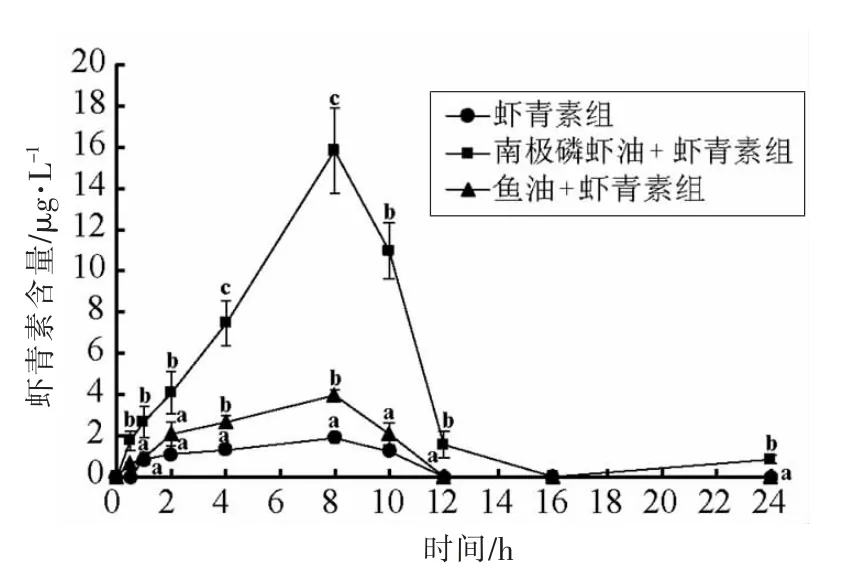
图4 大鼠血清中虾青素含量变化Fig.4 Changes of the astaxanthin levels in the serum of rats from different experimental groups
2.2.4 生物利用度评价 大鼠血清虾青素含量变化曲线AUC0-t值见表4。不同实验组大鼠虾青素生物利用度存在显著差异(P<0.05)。虾青素组大鼠AUC0-t值为(14.4±0.21)μg·h/L;鱼油+虾青素组大鼠AUC0-t值为(23.4±0.46)μg·h/L,是虾青素组的1.63 倍(P<0.05);南极磷虾油+虾青素组大鼠AUC0-t值为(108.4±2.34)μg·h/L,是虾青素组的7.55 倍(P<0.05),是鱼油+虾青素组的4.63 倍(P<0.05)。

表4 不同实验组大鼠血清虾青素含量变化曲线AUC0-t 值Table 4 AUC0-t values of serum astaxanthin contents in rats from different experimental groups
3 讨论
虾青素在体内无法合成,只能通过膳食摄取,根据目前相关研究报道[14-15,18,23,27-30],推测天然虾青素消化吸收过程如下:食品基质中的虾青素在口腔的咀嚼、胃的蠕动以及消化酶系的作用下被逐步释放,释放出来的虾青素(游离态或酯化态)在胃中与脂类物质混合并被包裹在脂滴中,进入小肠后,在胰脂肪酶、异构酶等消化酶的作用下,虾青素从脂滴中释放,以酯化态存在的虾青素同时被消化为游离态[23,28-29],而后与体系中的脂肪酸、单酰基甘油酯、磷脂、胆盐等一起乳化形成混合胶束;随后,包裹游离态虾青素的混合胶束通过简单扩散、被动扩散或胆固醇转运等方式被小肠上皮细胞吸收[30]。在小肠细胞内,虾青素被包裹在乳糜微粒中进入淋巴系统,而后进入血液循环,并最终到达肝脏、心脏、脾等靶器官发挥作用[31]。雨生红球藻是目前公认的天然虾青素的首选食品原料,其所富含的虾青素主要为酯化态虾青素,少量以游离态形式存在[14,23]。本研究中,灌胃给予雨生红球藻虾青素提取物后,大鼠肠道内容物中虾青素含量于2~4 h 达到峰值,小肠绒毛中于4 h 达到峰值,血清中于8 h 达到峰值,消化吸收的动态过程与周庆新等[23]、Coral-Hinostroza 等[28]的研究结果基本一致。
天然类胡萝卜素类物质普遍存在消化吸收利用率较低的问题[15,17],而摄入过程中添加脂类物质是有效的改善办法[18-20,32]。本研究中,灌胃大鼠雨生红球藻虾青素提取物的同时,给予南极磷虾油或鱼油等海洋来源膳食脂质,大鼠血清虾青素水平及AUC0-t值明显提高,表明南极磷虾油或鱼油能显著改善天然虾青素在大鼠体内的生物利用度。在体内消化环境,物理、化学、生物等因素共同作用下,食品基质成分对类胡萝卜素类物质的分子构象、溶解性、稳定性等的影响,是引起类胡萝卜素类物质营养特性发生改变的主要原因[32]。本研究中南极磷虾油+虾青素组和鱼油+虾青素组大鼠肠道内容物中虾青素的检出量均明显高于虾青素组,推测南极磷虾油和鱼油改善虾青素生物利用度的作用与二者能够提高虾青素的溶解度及其在胃、肠道中的稳定性密切相关。另外,有研究指出,不同类型膳食脂质对类胡萝卜素类物质生物利用度的影响效果不同[19,33-34]。本研究中采用的鱼油为甘油三酯型鱼油,甘油三酯在体内胰脂肪酶作用下被消化为单酰基甘油酯,可提高类胡萝卜素类物质的微胶束化率[34],促进小肠上皮细胞对类胡萝卜素类物质的有效吸收。本研究中大鼠小肠绒毛中虾青素含量变化的测定结果也证明了这一结论。值得关注的是,与甘油三酯型鱼油相比,南极磷虾油改善虾青素生物利用度的效果更佳。南极磷虾油中除含甘油三酯外,磷脂的含量达到40%以上,而磷脂是在机体消化过程中包裹其它膳食成分乳化形成混合胶束的重要结构物质,在构建胶束运载体系以提高脂溶性膳食功能因子、非水溶性药物等的生物利用度方面得到成熟应用[35-37]。南极磷虾油具有的高磷脂含量的营养特性,决定了其在改善虾青素生物利用度方面表现出优于鱼油的效果,这一营养特性也将为以南极磷虾油为基础的其它衍生产品的开发提供极大空间。
4 结论
南极磷虾油或鱼油等海洋来源脂质能够显著改善雨生红球藻源虾青素在大鼠体内的生物利用度,其中南极磷虾油的作用效果更佳。南极磷虾油改善天然虾青素生物利用度的机制主要包括:一方面,南极磷虾油能够提高虾青素的溶解度及其在胃、肠道中的稳定性;另一方面,南极磷虾油中包含甘油三酯和高含量磷脂,经生物体消化酶消化后,可提高虾青素的微胶束化率,促进小肠上皮细胞对其有效吸收。以上两方面机制值得后续研究和证实。本研究结果表明南极磷虾油-虾青素功能组方产品开发具有可行性,将有效指导南极磷虾油相关衍生产品的开发,对于保障我国南极磷虾产业发展具有重要意义。

