人体肠道菌群代谢氨基酸产生短链脂肪酸及对细胞通透性的影响
张小芳,王 欣,汪惠勤,柯李晶,高观祯*,朱立颖*
(1浙江师范大学化学与生命科学学院 浙江金华 321004 2浙江省农业科学院农产品质量安全危害因子与风险防控国家重点实验室 杭州 310021 3浙江省农业科学院植物保护与微生物研究所 杭州 310021 4 浙江工商大学食品与生物工程学院 杭州 310018)
人类胃、肠道内存在大量的细菌,主要由拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)等组成,其总数达到1012~1013CFU/g 内容物[1-2]。大量研究表明与消化、精神、免疫、内分泌系统相关的多种疾病和肠道菌群失调有关[3-5],因此,调控肠道菌群对预防慢性病发生具有重大意义。
环境因素特别是饮食模式是调节肠道菌群的关键因素。在正常饮食模式下,每天大约有20 g膳食纤维和2~10 g 蛋白质能够逃逸小肠吸收进入结肠,成为结肠中细菌发酵的底物[6]。而细菌发酵食糜后的最主要代谢产物为短链脂肪酸(Short chain fat acid,SCFA),包括乙酸、丙酸、丁酸、戊酸、异戊酸和异丁酸[7]。其中乙酸、丙酸、丁酸是肠道细菌发酵碳水化合物的代谢产物[8]。异丁酸、戊酸和异戊酸是细菌发酵蛋白质的代谢产物。由于正常饮食状态下进入结肠的碳水化合物含量远远高于蛋白质,因此粪便中的异丁酸、戊酸和异戊酸含量相对较低。人类饮食模式的变化会显著改变粪便中代谢碳水化合物和代谢蛋白质产生的SCFA 的比例。比如高蛋白饮食显著增加了粪便中异丁酸和异戊酸的含量[9]。目前对人体肠道中碳水化合物的代谢途径研究较多,然而,对蛋白质代谢的研究比较少。Zarling 等[10]在1987年通过氨基酸的体外发酵证明了异丁酸和异戊酸分别由肠道细菌发酵缬氨酸(Valine,Val)和亮氨酸(Leucine,Leu)后形成,奠定了支链氨基酸是产生2 种SCFA(异丁酸、异戊酸)的理论基础。然而,对戊酸产生的底物研究相关报道较少。
目前发现SCFA 作为一种新型的信号分子,在维护人体健康、调节人体代谢过程中起到重要的作用[11]。乙酸进入人体循环系统后作为能量来源参与机体代谢,影响人体食欲。丙酸吸收后影响胆固醇的合成与代谢。丁酸作为肠道上皮细胞线粒体呼吸的主要能量来源,在组蛋白去乙酰化过程中起到重要作用,广泛影响肠道上皮细胞和免疫细胞的繁殖和代谢[12]。前期研究表明,丙酸与丁酸能够增加肠上皮细胞紧密连接蛋白ZO-1 和组分闭合蛋白(Occludin)的表达,增强细胞之间的紧密连接,以及激活AMPK 介导紧密连接实现重新组装,降低肠道通透性[13]。在炎症性肠病(Inflammatory bowel disease,IBD)、肥胖、2 型糖尿病和自身免疫性疾病患者中,肠道细菌降解碳水化合物产生丁酸的含量明显偏低,产丁酸的细菌总数也异常降低,同时伴随着肠道通透性的增加[14-17]。然而,目前SCFA 对肠道上皮细胞通透性的研究主要集中在碳水化合物发酵后产生的乙酸、丙酸和丁酸,对蛋白质发酵产生的戊酸、异丁酸和异戊酸的研究还是一片空白。
本文采用体外发酵方法研究比较人体肠道微生物对20 种氨基酸代谢的影响,通过细胞模型,研究氨基酸产生的SCFA 对细胞通透性的影响。
1 材料与方法
1.1 试验试剂与仪器
试验中使用的20 种氨基酸,包括Val、Leu、异亮氨酸(Isoleucine,Ile)、脯氨酸(Proline,Pro)、丙氨酸(Alanine,Ala)、甲硫氨酸(Methionine,Met)、甘氨酸(Glycine,Gly)、苏氨酸(Threonine,Thr)、组氨酸(Histidine,His)、天冬氨酸(Aspartate,Asp)、酪氨酸(Tyrosine,Tyr)、谷氨酸(Glutamic acid,Glu)、赖氨酸(Lysine,Lys)、谷氨酰胺(Glutamine,Gln)、天冬酰胺(Asparagine,Asn)、色氨酸(Tryptophan,Trp)、苯丙氨酸(Phenylalanine,Phe)、精氨酸(Arginine,Arg)、半胱氨酸(Cysteine,Cys)、丝氨酸(Serine,Ser)均为色谱纯级,美国Sigma 公司;4 种SCFA:丁酸、戊酸、异戊酸、异丁酸均为色谱纯级,美国Sigma 公司;磷酸盐缓冲液,生工生物股份有限公司;人结肠腺癌细胞(Caco-2),中科院上海生命科学研究院细胞库;0.25%胰酶-EDTA 消化液、青霉素-链霉素混合液,美国Gibco 公司;DMEM培养基、PBS 缓冲液、HBSS 缓冲液,美国HyClone公司;细胞培养瓶、96 孔板、Transwell 培养板,美国Corning 公司;胎牛血清(FBS),以色列Biological Industries 公司。
高压蒸汽灭菌锅,上海博迅医疗生物仪器有限公司;分析天平,瑞士Mettler Toledo 公司;厌氧工作站,英国依莱泰科;GC2010 plus 气相色谱仪,日本岛津公司;DB-FFAP 型气相色谱柱(0.32 mm×30 m×0.5 μm),美国Agilent 公司;MX-307 高速离心机,日本TOMY 公司;超纯水仪、细胞电阻仪,美国Millipore 公司。
1.2 试验方法
1.2.1 粪便样品采集与预处理 27 例健康志愿者来自浙江省农业科学院,男16 人,女11 人,年龄在20~55 岁。所有志愿者有近3 个月的正常饮食,在这3 个月内没有服用抗生素或其它药物,也没有接受过益生菌治疗。研究人员向受试者进行全面解释,并给予受试者书面知情同意。
收集志愿者的粪便样本均在6 h 内处理结束。取3 g 粪便样本装入取样管中,加入30 mL 厌氧磷酸缓冲液(PBS)配制成体积分数10%的粪便悬液。用涡旋震荡器(Vortex)充分振荡使其混匀后,再用粪便处理器过滤除去粪便中未消化的大颗粒食物残渣。
1.2.2 培养基的配制 20 种溶于水的培养基配制 方 法:100 mg Val、Leu、Ile、Pro、Ala、Met、Gly、Thr、His、Asp、Tyr、Glu、Lys、Gln、Asn、Trp、Phe、Arg、Cys、Ser 分别溶解于10 mL 超纯水中,配制成10 g/L 的氨基酸培养基,500 mg 小牛血清蛋白BSA、NaCl 分别溶于10 mL 超纯水中,配制成50 g/L 的对照组溶液;2 种微溶于水的氨基酸(Tyr、Asp)培养基配制方法:5 mg Asp 溶于1 mL 超纯水中,配制成5 mg/mL Asp 培养基;1.25 mg Tyr 溶于5 mL PBS 溶液中,配制0.25 mg/mL Tyr 培养基。
1.2.3 体外发酵 参照Zarling 等[10]报道的体外发酵方法,使用前期报道过的批式发酵系统[18]。在厌氧工作站中,将灭菌的10 mL 西林瓶身上贴好22种培养基标签。20 种溶于水的培养基发酵方法:将100 μL 溶于水的20 种培养基分装到对应培养基标签的西林瓶中,接种3 mL 10%的粪便悬液,压盖。2 种微溶于水的培养基发酵方法:将200 μL Asp 培养基分装到对应培养基标签的西林瓶中,接种3 mL 10%的粪便悬液,压盖;称量0.5 g粪便,加入5 mL 0.25 mg/mL Tyr 培养基,混匀并过滤,配制成10%Tyr/PBS 粪便悬浊液,取3 mL 分装到对应培养基标签的西林瓶中,压盖。所有西林瓶放置在37 ℃恒温培养箱中培养24 h,在24 h 取样。
1.3 SCFA 分析
气相色谱检测24 h 样品中SCFA 的浓度。试验中,500 μL 发酵液样品加入100 μL 巴豆酸,酸化24 h,离心后取上清,经过0.22 μm 水系过滤膜,上机。过滤液通过DB-FFAP 型气相色谱柱(0.32 mm×30 m×0.5 μm),使用氢气火焰离子化检测器,以巴豆酸(反式-2-丁烯酸)作为内标物,检测乙酸、丙酸、丁酸、异丁酸、异戊酸、戊酸。
1.4 细胞培养
将Caco-2 细胞接种于培养瓶,培养液为DMEM 高糖(4.5 g/L)培养基(含10%胎牛血清、1%非必需氨基酸、1%L-谷氨酰胺、青霉素100 μg/mL、链霉素100 μg/mL),置于5%CO2、37 ℃培养箱,每隔3~4 d 传代1 次,取对数生长期细胞作后续试验。将状态良好的细胞消化,吹打均匀,调节密度2×106个/mL,每孔加入2×105个细胞,同时在顶侧(Apical,AP)与基底侧(Basolateral,BL)加入不同SCFA(丁酸、异丁酸、异戊酸、戊酸)共同孵育72 h,顶侧与基底侧的SCFA 终浓度为2.5 mmol/L。在孵育过程中的24,48,72 h,测定不同SCFA(异丁酸、异戊酸、戊酸、丁酸)对Caco-2 细胞的跨膜电阻值(TEER)的影响。
1.5 统计分析
试验数据通过SPSS 软件(IBM SPSS Statistics 19.0 软件)先做方差齐性检验,判断数据是否符合正态分布。对不符合正态分布的数据(即方差不齐性)采用Mann-Whitney U 检验;对符合正态分布的数据(即方差齐性)选择 ANOVA-LSD 检验。计算得出不同氨基酸培养基与对照组的SCFA浓度的显著性差异。T 值采用双总T 检验中的独立样本检验计算,P<0.05 表示差异有统计学差异。
2 结果与分析
2.1 人体粪便SCFA 的组成
采用气相色谱测定27 名试验参与者粪便中SCFA 浓度结果见表1。
表1 湿粪便中SCFA 含量差异(±s,n=27)Table 1 Difference of SCFA content in wet feces (±s,n=27)
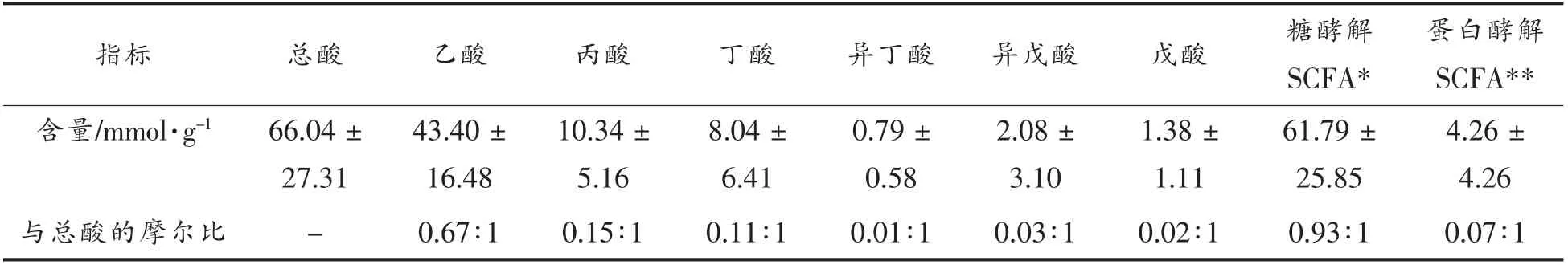
表1 湿粪便中SCFA 含量差异(±s,n=27)Table 1 Difference of SCFA content in wet feces (±s,n=27)
注:*.乙酸、丙酸、丁酸之和;**.异丁酸、异戊酸、戊酸之和。
蛋白酵解SCFA**含量/mmol·g-1 66.04 ±27.31指标 总酸 乙酸 丙酸 丁酸 异丁酸 异戊酸 戊酸 糖酵解SCFA*4.26 ±4.26与总酸的摩尔比-0.67∶1 0.15∶1 0.11∶1 0.01∶1 0.03∶1 0.02∶1 0.93∶1 0.07∶1 43.40 ±16.48 10.34 ±5.16 8.04 ±6.41 0.79 ±0.58 2.08 ±3.10 1.38 ±1.11 61.79 ±25.85
2.2 人体肠道菌群发酵20 种氨基酸后SCFA 产量的比较
试验采用气相色谱测定24 h 样品上清液中SCFA 浓度。通过比较不同氨基酸培养基与对照组之间SCFA 的含量(图1),研究发现在含有20 种氨基酸的培养基中,乙酸、丙酸、丁酸的产量(图1a~1c)与对照组没有显著差异,提示膳食中的氨基酸可能不参与结肠内乙酸、丙酸和丁酸的代谢合成。然而,3 种SCFA(异丁酸、异戊酸、戊酸)与对照组有显著差异(图1d~1f)。其中Val 培养基中异丁酸含量明显高于对照组(图1d),且有极显著性差异(t=15.4089,P=1×10-6<0.01)。Leu 和Ile 培养基中,异戊酸含量明显高于对照组(图1e)(Leu:t=15.3183,P=1×10-6<0.01;Ile:t=16.9307,P=1×10-6<0.01;BSA:t=4.0311,P=2.651×10-4<0.01)。Pro培养基中戊酸含量明显高于对照组中的戊酸,且有极显著差异(t=12.0208,P=3×10-6<0.01)(图1f)。该结果表明,粪便中的乙酸、丙酸、丁酸不是由氨基酸降解形成;粪便中的异戊酸是由Leu、Ile 降解形成;异丁酸是由Val 代谢形成;戊酸是由Pro 代谢产生。

图1 发酵液中SCFA 含量差异Fig.1 The different of short-chain fatty acids in fermentation broth
2.3 SCFA 对Caco-2 细胞肠屏障的影响
肠道菌群代谢产生的短链脂肪酸对肠道细胞具有各种作用,其中一个重要的作用为增强肠道屏障[19]。本研究采用测定Caco-2 细胞跨膜电阻值(TEER) 来考察SCFA 对肠屏障的影响,TEER 越大表示通透性越差,肠屏障功能越好。结果显示,与对照组相比,氨基酸代谢产生的SCFA 中,戊酸能显著提高Caco-2 细胞跨膜电阻值(图3a~3b),促进Caco-2 细胞肠屏障的形成,与碳水化合物产生的丁酸类似,然而在相同浓度下,戊酸增强肠道屏障的能力较弱,需发酵48 h 后才有效果。已有许多研究表明丁酸可以促进肠屏障的形成[13],而戊酸对肠屏障的影响未见报道。氨基酸产生的另外2 种SCFA(异丁酸、异戊酸)会降低Caco-2 细胞跨膜电阻值(图3c~3d),抑制Caco-2 细胞肠屏障的形成。Blakeney 等[20]研究报道,异戊酸可引起结肠平滑肌松弛,从而抑制肠道屏障的形成,与本研究结果一致。
3 讨论与结论
粪便中SCFA 的含量和比例是人体健康的一个重要指标,可以直接反映肠道菌群的活性和平衡。例如,在正常饮食状态下2 型糖尿病患者粪便中乙酸和丁酸的含量显著低于对照组的健康人群[21]。同时粪便SCFA 含量和比例还受饮食结构的影响。Giuditta 等[22]发现与低热量的地中海饮食模式相比,纯素食饮食模式下粪便中乙酸和丁酸的含量下降,而异丁酸、异戊酸含量显著增加。有报道指出健康人群粪便中碳水化合物产生的乙酸、丙酸和丁酸和蛋白质代谢产生的戊酸、异戊酸和异丁酸的摩尔比值为95∶5 到90∶10[23]。而本试验组健康人群粪便中此物质的摩尔比为93∶7,提示试验参与者的膳食组成正常。而且乙酸、丙酸、丁酸之间的摩尔比值为67∶15∶11,基本符合65∶20∶15 的比例,进一步提示试验组人员肠道菌群代谢处于正常状态。
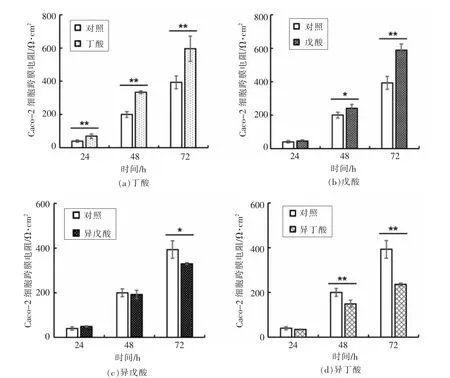
图2 SCFA 对Caco-2 细胞肠屏障的影响Fig.2 Effects of short-chain fatty acids on intestinal barrier of Caco-2 cells
人体肠道微生物降解氨基酸后主要代谢产物包括氨、生物胺、H2S 和3 种SCFA(异丁酸、异戊酸、戊酸),其中生物胺的研究已有较多报道[24-26],然而对这3 种SCFA(异丁酸、异戊酸、戊酸)的研究相抵比较少。Shen 等[27]在2010年通过体外发酵模型对比研究了不同烹调方式下牛肉、鸡肉和三文鱼对人体肠道微生态和SCFA 的影响,发现新鲜三文鱼肉显著影响到丁酸和异丁酸的产生。Zarling 等[10]也是通过体外发酵试验证实了异丁酸和异戊酸分别由Val 和Leu 降解形成。在本研究中,研究证实了氨基酸、蛋白质食物组分在人体肠道中对乙酸、丙酸和丁酸的形成影响很小,然而直接影响戊酸、异戊酸和异丁酸的形成。除了Leu 之外,肠道菌群发酵Ile 也可以形成异戊酸;Val 代谢产生异丁酸,而Pro 代谢产生戊酸。
3 种SCFA(异丁酸、异戊酸、戊酸)对人体健康的影响已有部分报道。例如,流行病学的证据表明戊酸和丁酸一样对肠道健康有益[28-29]。还有研究发现与克罗恩病患者相比,健康人的粪便中含有更多产戊酸的细菌[29]。对老年人的研究发现,健康百岁老人的粪便中戊酸、丙酸与丁酸的浓度明显升高[30]。Blakeney 等[20]研究报道,异戊酸可引起结肠平滑肌松弛,从而抑制肠道屏障的形成。Yuille等[31]报道戊酸能够像丁酸一样,在体外细胞模型中作为组蛋白去乙酰化酶的抑制剂影响细胞的繁殖周期。因此,本研究中也利用体外细胞模型,比较了氨基酸代谢产物异丁酸、戊酸和异戊酸对细胞通透性的影响。研究发现只有戊酸能够在体外增加Caco-2 细胞肠屏障,而异戊酸和异丁酸降低Caco-2 细胞肠屏障,并且在2.5 mmol/L 浓度下戊酸增强肠道屏障的能力稍弱于丁酸,丁酸增强肠道屏障已经有众多研究,其增强肠道屏障的机制主要通过激活AMPK 介导紧密连接重组装实现[32],氨基酸代谢产物戊酸增强肠道屏障为首次发现,相关研究有待进一步探索,如其强肠道屏障的具体机理等,因其化学结构与丁酸具有相似性,其机制可能也是通过激活AMPK 介导紧密连接重组装而实现。戊酸对人体健康的影响逐渐受到越来越多的关注。最近有报道戊酸通过T 淋巴细胞和B淋巴细胞的代谢和表观遗传重编程发挥其免疫调节作用[33],这些表明戊酸在人体健康中可能起正向作用。同时,本研究发现异丁酸、异戊酸能够增加肠道通透性,在人体健康中可能起到反向作用。国外研究报道中已经发现粪便中异戊酸含量高与人体抑郁症的发病有关[34],结合本研究结果,提示异戊酸可能影响到肠粘膜的通透性,进而通过脑肠轴影响到与精神系统有关疾病的发生。本研究中这些对人体健康起不同作用的戊酸、异戊酸、异丁酸,在肠道菌中由特定的氨基酸发酵降解而成,因此高蛋白饮食经肠道菌发酵后对人体健康的不同影响可能与其含不同的这些特定氨基酸有关。
总之,本研究利用体外发酵模型,探究了氨基酸作为底物对肠道微生物代谢产物SCFA 产生的影响,填补了多年来在3 种SCFA(异丁酸、异戊酸、戊酸)底物研究上的空缺。同时采用测定细胞跨膜电阻值的方法,比较了对人体上皮细胞通透性的影响。目前的研究虽然都采用体外模型,但是研究结果为今后进一步探究肠道菌群氨基酸代谢对机体健康状态的影响奠定了基础。

