植源肽对啮齿动物神经退行性疾病的影响
蔡 洁,崔校基,唐柳欢,陈忠旭,梁 盈
(中南林业科技大学 稻谷及副产物深加工国家工程实验室 长沙 410004)
神经退行性疾病是世界主要公共卫生问题之一。包括阿尔兹海默病(AD)、帕金森病(PD)、亨廷顿病(HD)等[1-2],这些疾病的临床症状都伴随有认知、行为障碍,对生活质量产生重大影响,甚至导致高死亡发生率。据估计,到2020年,全球约有4 000 万人会遭受AD、PD、多发性硬化症等疾病的影响[3],其中90%的患者年龄大于65 岁,AD 患者人数居首。据统计,截至2015年,全球仅AD 患者的治疗成本估计为9 675.6 亿美元,到2030年将达到2.54 万亿美元[4]。这些疾病的共同特点是进行性神经元丢失和神经元功能受损,其与氧化应激、慢性炎症和线粒体功能障碍等密切相关,这些疾病关键的后台操纵者之一是细胞外神经毒性微环境[5-6]。
作为药物使用的生物活性肽对保障人类健康有着突出的贡献,如众所周知的抗氧化[7]、降血压[8]和抗菌[9]等性能。外源活性肽主要来自动物和植物,如肌肽,是一种天然的抗氧化剂,主要饮食来源为肉类,如牛肉、鸡肉等。肌肽可以作为一种膳食补充剂,有助于预防衰老[10-12]和阿尔茨海默病[13-14]、脑缺血[15]、帕金森病[16]等神经相关疾病。血管活性肠肽也被认为在许多神经疾病中具有神经保护作用[17],最初是从动物肠道中分离得到[18]。近年来,对植物来源的活性肽研究逐渐增多。目前有许多研究证明植源肽具有ACE 抑制等活性,这些肽大多来源于大豆、玉米、小麦等[19-20],小麦麸质和麦醇溶蛋白等酶解产物显示具有阿片活性[21]。这些研究中,植源肽表现出优良的抗氧化、抗炎以及改善小鼠认知能力的作用[22-24]。相比动物源活性肽,植源肽的研究相对缺乏[19,25]。植物是研究生物活性化合物的理想系统[26],且活性肽可以用来研究错误折叠的蛋白质/肽的特性,是研究神经退行性疾病的重要工具。综上,植源性活性肽在神经退行性疾病的研究中具有巨大的潜力。
1 植源肽
1.1 植源肽的来源
植源肽的来源按照笔者所在的专业分为粮食作物源和其它植物源活性肽。这些粮食作物有水稻、大豆、玉米、小麦、土豆等[27],其它植源肽则主要来源于核桃[23]、拟南芥[28]、雪松[29]等。由于许多粮食作物加工的副产品具有易获得,低成本,减少资源浪费等优点,如豆粕[30]、菜籽粕[31]等,因此它们是极受欢迎的植物活性肽来源。植物活性肽也可以是植物内源性肽,或通过发酵、酶解方式获得[27]。
1.2 植源肽的生物活性
大多数生物活性肽是当非活性状态的长链蛋白质被适当酶解时,其分子片段与活性被释放出来[32]。抗氧化肽是生物体在生命活动中起重要调控作用的化学物质,它通过减少氧自由基,阻断脂质体的链式反应来发挥其抗氧化作用,如小麦胚芽肽[33]、核桃肽[34]等。Amigo-Benavent 等[35]的研究证明消化大豆所释放的肽具有抗氧化作用。除大豆外,一些可可制品所显示的抗氧化活性也被归因于可可中存在的活性肽[36]。抗高血压活性肽是最常见的植源肽之一[37],高血压的主要参与者ACE 会导致血管收缩。大量研究表明植源肽具有ACE 抑制作用,这些肽主要来自于蔬菜和大豆衍生物[38]。小麦和麦麸等粮食、粮食加工副产物中提取的活性肽具有阿片作用[21]。众所周知,大豆肽[39]和谷胱甘肽具有免疫调节作用,谷胱甘肽存在于许多植物源食品中,虽然该分子被肠道吸收不多,但对肠道的氧化损伤有保护作用[40]。从鹰嘴豆、芝麻、大豆和向日葵的蛋白质水解物中鉴定出来的活性肽[41]具有免疫调节作用,并且能刺激外周血中的淋巴细胞[40]。植源肽对淋巴细胞增殖也有抑制作用,能够减少过敏和过敏反应,其中婴儿的“口腔耐受性”现象就是例证[40]。此外,在动物模型中,其它一些植物活性肽已被建议用于预防阿尔茨海默病[42]。其它重要的生物活性还有抗癌活性等,如从大豆[43]和马铃薯[44]中分离出来的活性肽具有抗癌活性,这一活性在其它植物中也有报道[43]。
2 植源肽在神经退行性疾病中的作用
神经退行性疾病往往伴随记忆丧失,认知障碍等。患者大脑中蛋白质或肽的异常聚集,这些聚集体在神经元或神经元上的沉积,破坏信号传递,最终杀死神经元[45]。如图1所述,除了遗传因素外,氧化应激、免疫失衡等引起机体内环境紊乱也是神经退行重要发病机制。近年来,生物活性肽在神经退行性疾病的研究上取得了可观的进展。研究者以啮齿动物为模型,从多方面、多层次研究了各类植源肽对神经退行性疾病的作用,表明植源肽通过抗氧化应激、抗炎、抗糖基化等作用改善了啮齿动物内分泌、代谢、记忆、认知,从而保护大脑免受损伤。
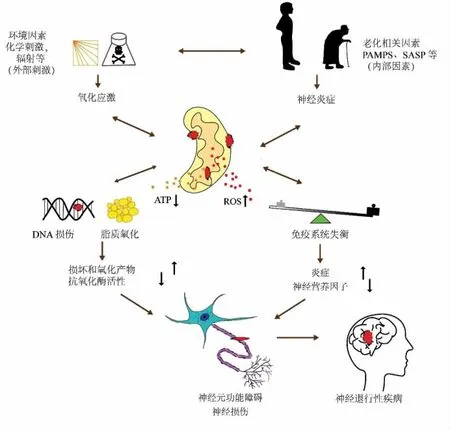
图1 氧化应激、线粒体功能障碍、免疫系统失衡与神经炎症的关系Fig.1 Relationship between oxidative stress,mitochondrial dysfunction,immune system imbalance and neuroinflammation
2.1 抗氧化应激
在神经退行性疾病和衰老中,氧化应激被认为是重要的调节因素[46-47]。氧化应激由生物系统中氧化剂和抗氧化剂之间的失衡导致,这种不平衡是由于活性氧(ROS)过量或抗氧化系统功能不当导致[48]。神经退行性疾病的具体特征是细胞凋亡/坏死和神经细胞功能障碍,导致对神经系统的恶性影响。作为身体广泛活跃的部分,脑更容易受到氧化应激的影响,大脑对氧的需求更高,因此消耗的氧气比身体其它部位更多。大脑还富含氧化还原活性金属(铜和铁),它们积极参与ROS 的产生,由于脑细胞膜富含多不饱和脂肪酸(PUFA),它们更容易发生脂质过氧化[49-50]。当抗氧化物谷胱甘肽(GSH)以最佳浓度存在时,其在脑细胞ROS的解毒过程中起着主要作用,因此ROS 水平升高同时脑GSH 水平下降,导致AD、PD、HD 等神经退行性疾病发生[51-53]。针对ROS 产生了各种纯天然抗氧化剂,如谷胱甘肽、多酚等(茶提取物),抗氧化物由抗氧化酶,如超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等酶活增强而发挥作用[54-56]。
早在1985年,Gerschman[57]和Denham[58]就提出超氧化物和其它自由基对细胞的大分子成分造成伤害。自由基对机体组织造成持续伤害,导致结果包括:体内酶活性降低,核酸代谢误差,溶酶体色素堆积,致使细胞衰老。核桃蛋白水解物DWMPH 表现出自由基清除活性和氧自由基吸收能力[23]。梁盈等[59]发现从大米中提取的活性肽对DPPH 和OH 自由基清除分别可达46.76%和68.23%。He 等[60]发现大豆的加工产物中分子质量在1~3 ku 的肽在体外具有较强的DPPH 自由基清除能力。金属螯合作用是抑制自由基生成的重要组成部分,而一些多肽起螯合剂的作用,特别是含有半胱氨酸、组氨酸、天冬氨酸和谷氨酸的多肽[41]。
机体氧化失衡后,ROS 以自由基或非自由基分子(如H2O2)两种形式氧化脂质形成还原的氧中间体,进一步导致DNA[61]、蛋白质[62]和脂质[63]积累损伤。许多来源于植物或植物加工副产物的活性肽被证明在体内具有较强的抗氧化活性。He 等[60]通过喂食大豆加工产物中提取出的活性肽给D-半乳糖(D-gal)衰老小鼠,发现灌胃活性肽的小鼠的食物摄入量、体重和器官指标均恢复正常,不但提高了小鼠血清中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-px)的活性,还提高了总抗氧化物能力(T-AOC),并减少了丙二醛(MDA)的生成,表现出良好的抗氧化活性。小麦活性肽灌胃D-gal 致衰老的小鼠后,发现饲喂小麦肽的小鼠血清和心脏、脑、肝脏中的SOD 等抗氧化物酶显著提高,并且降低了MDA 含量[64]。此外在研究黑豆肽[65]和姬松茸多肽[66]对D-gal 致衰老小鼠体内抗氧化的作用中,同样发现黑豆肽可显著提高小鼠肝脏SOD、GSH-Px 活性和血清GSH-Px 活性,降低血清和肝脏MDA 含量。
2.2 维持免疫系统稳态
在关于神经退行性疾病的研究中,遗传、组织病理学的证据指出免疫途径失调,包括细胞因子信号的变化、免疫细胞增殖和迁移、吞噬作用的改变以及反应性神经胶质变性是神经病变的常见特征。长期以来,这些免疫变化被认为是基础疾病过程的继发性或反应性变化,而新出现的证据暗示免疫系统是疾病发作和进展的主要参与者[67]。免疫系统的变化,无论是先天的还是适应性的,都会随着年龄的增长而发生明显的变化,并促进免疫功能的发展[68]。植源免疫调节肽有助于机体的防御反应,然而不直接与病原体反应。植源肽在免疫调节中主要通过胃肠道参与生物体的免疫反应[69]。具有抗菌活性的植源肽已被认为能减少外界环境对机体造成的损伤,类似常规抗生素治疗细菌感染[70]。几个已知的植源肽可以刺激或抑制免疫反应[71],太子参提取的活性肽被证明能够提高脾脏淋巴细胞增殖能力,说明其可以增强机体免疫系统[72]。大豆肽除了能够抑制肠道收缩并缓解焦虑以外,它也影响葡萄糖和脂质代谢,并已在小鼠中显示出抗糖尿病的作用[73],大豆衍生的43 种残留肽lunasin 具有几种有益的免疫调节特性[74-75],如血液和肝脏[76]中抑制哺乳动物细胞核的组蛋白乙酰化[76]。山药蛋白肽也能改善免疫力低下小鼠的免疫力,增强淋巴细胞增殖能力,提高免疫球蛋白和抗炎细胞因子的表达[77]。此外,研究表明从日本大米中提取的短肽KGHYAERVG 的活性提供了抵抗多发性硬化症的发生,其能改善多发性硬化症小鼠模型的脑炎症状,通过提高T 细胞的增殖能力,提高抗炎细胞因子的表达[67]。这些研究表明植源肽通过抗菌、抗炎、平衡T、B 淋巴细胞维持免疫系统稳态,抵抗相关神经退行性疾病的发生。
2.3 保护大脑神经系统
神经退行性疾病的共同特点是进行性神经元丢失和神经元功能受损。不管是抗氧化,抗炎,对于活性物质的研究都是为了保护大脑神经系统免受损伤。Shimizu 等[7]从大豆提取物中发现的二肽甘氨酸-精氨酸(GR)能够显著提高脑源性神经营养因子(BDNF)的表达,并且通过持续6 个月饲喂小鼠,发现其能抑制SAMP8 小鼠与年龄有关的认知能力下降。Ren 等[34]研究发现灌胃核桃肽(MWHP)通过减少氧化应激,抑制细胞凋亡,调节神经递质功能,维持海马CA3 锥体神经元和提高脑组织中p-CaMKⅡ水平而改善记忆,并在小鼠的水迷宫实验中得到了证实。此外Wang 等[78]的研究发现灌胃核桃肽(PPKNT)能够减少APP/PS1 小鼠的Aβ 斑块积累,提高认知能力,并能够提高APP/PS1 小鼠血清中甲肾上腺素(NE)和异戊酸酯水平,降低血清胆碱酯酶(AChE)和戊二酸水平。核桃肽DWMPH 对大脑神经系统的保护研究相对于其它植源肽的研究较多,核桃蛋白水解物饲喂小鼠能减轻D-gal 和AlCl3诱导的小鼠大脑中的神经损伤[23]。此外,研究表明纤维蛋白原具有改变血管功能和淀粉样蛋白聚集的双重作用,其衍生肽γ333-395能减少AβPP/S1 小鼠脑淀粉样蛋白的沉积,并改善小鼠认知。这些是已知氨基酸排列顺序的肽,许多类似的活性多肽并未弄清其具体的氨基酸排列顺序。如冯晴霞等[66]用姬松茸多肽提取物灌胃小鼠,发现小鼠在水迷宫和避暗实验中都表现出良好的记忆能力,并且灌胃姬松茸多肽提取物能够保护小鼠神经元免受损伤。综上,虽然部分研究中的植源肽仍不知道其氨基酸序列,但其能提高神经营养因子的表达、减轻脑中Aβ 沉积。植源肽表现出的神经保护作用在研究神经退行性疾病中具有重大意义。
2.4 抗糖基化
晚期糖基化终产物(AGEs),除了众所周知的可引起糖尿病并发症的发展以外,还可引起许多疾病的病理生理变化,如阿尔茨海默病、帕金森病和酒精性脑损伤的病理变化的关键[79-82]。如图2所示,AGEs 受体RAGE(晚期糖基化终产物受体)调节许多至关重要的细胞过程,如炎症、凋亡、ROS信号传导、增殖、自噬以及衰老。在宿主细胞死亡过程中,AGEs 与其受体RAGE 结合后,RAGE 通过ROS、ERK1/2 和NF-κB 炎症途径的强烈激活而高表达[83-85]。研究者给2 型糖尿病小鼠灌胃茶多肽[24],发现茶多肽通过调节JNK/NF-κB 和AGEs/RAGE 途径,降低了2 型糖尿病小鼠的血清胰岛素水平,维持机体糖代谢平衡,降低了小鼠的体内炎症,从而保护大脑神经系统免受损伤。
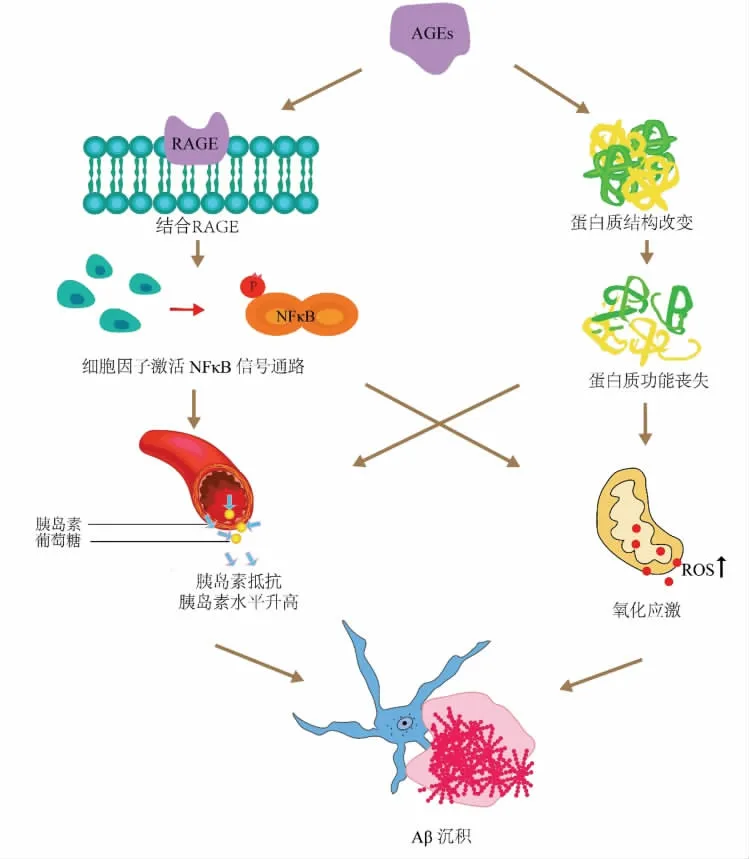
图2 AGEs 与Aβ 沉积的关系Fig.2 Relationship between AGEs and Aβ accumulation
2.5 调控肠道菌群
胃肠道包含大量的共生细菌,这些细菌很容易由于饮食、环境和疾病而发生变化[85]。有研究表明,高度多样化和稳定的微生物群促进了人类的整体健康[67]。如图3所示,在神经退行性疾病的研究中,许多数据表明肠道菌群能调控神经系统[86-87],当胃肠道发生全身性炎症或外周免疫系统可被感知到形成外周炎症信号时,传导到大脑加重慢性神经变性。新的数据表明,食用某些植源性的功能性食品或成分,可以通过调节肠道微生物群落和多样性来发挥认知改善作用。Wang 等[78]采用16S rRNA 对饲喂核桃肽(PPKNT)的APP/PS1 小鼠的粪便分析,增加厚壁菌门(Firmicutes)的相对丰度,减少16S rRNA 分析显示的蛋白细菌和疣微菌门(Verrucomicrobia)来改善肠道失调,能够改善APP/PS1 小鼠的认知能力。大豆7s 球蛋白延伸区片段的体外发酵试验表明,其能选择性的抑制促炎革兰氏阴性菌,增加乳酸菌科数目的相对丰度来改善肠道菌群环境[88]。植物乳杆菌发酵后的大豆产物也被证明能抑制小鼠β 淀粉样蛋白增加,减少神经元凋亡,增强小鼠认知能力,此外发现其还能降低小鼠粪便脂多糖水平,增加肠道中乳酸菌/乳酸杆菌数量。这种神经保护作用可能与大豆发酵产物能改善肠道菌群环境有关[89],并且可能由于大豆发酵产物中的生物活性肽发挥着关键的作用导致。肠道神经系统素有“第二脑”之称,这是因为肠道微生物具有自主活动,而与中枢神经系统也有密切相互作用。植源肽通过提供膳食营养,来平衡肠道菌群环境,改善肠道内分泌,调节肠神经系统、免疫反应而保护大脑,减少神经退行性疾病,如失去记忆和学习能力丧失等症状的发生。
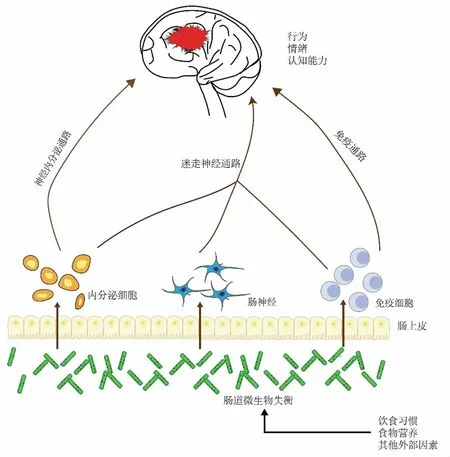
图3 肠道菌群失调与大脑的关系Fig.3 Relationship between imbalance of intestinal flora and brain
3 小结
在探索活性肽生物活性的过程中,研究发现植源肽通过发挥抗氧化应激,抗糖基化,提高机体免疫能力,调控肠道菌群等作用,而对啮齿神经退行性疾病产生积极的影响,这对于植源肽应用在预防神经退行性疾病上具有积极作用。过去的研究中,植源ACE 抑制肽得到了很好的发展,直到现在植源肽对啮齿动物神经退行性疾病的作用已经陆续被研究。目前研究证据不够充分,还需临床证据和大量资本投资,虽然在体外试验或使用啮齿类动物模型获得的数据被认为不足以实现这一目的,但基于目前的动物实验的研究进展,鉴于植源肽在抵抗啮齿动物神经退行性疾病发生表现出的优良作用。植物作为活性肽来源的一大巨头,在神经退行性疾病的研究中有不可磨灭的贡献。
4 机遇与挑战
近年来,许多研究都探讨了关于肽的优势及其潜在问题和应用策略。目前研究中用来治疗神经退行性疾病的药物远远不够,批准的药物数量因在临床试验中检测出铅化合物而受到限制[90],而天然产品在预防这些疾病中的应用是一个相对较新的领域。研究表明,多种植物化学物质,如杨梅素、桑树、核桃和绿茶等通过至少3 种治疗特性:改善胃肠功能,增强免疫和保护神经效果。在膳食中添加植物化学物质被认为是一种很有前景的干预退行性疾病发生的方法,可以通过改变个人的饮食习惯,提高植物化学物质在人类健康的可用性,提高整体身体质量,减少神经退行性病变[91]。此外,在经济上,植物作为天然活性物质的主要来源物,其来源广,价格低,充分利用可减少资源浪费[92],然而合成的肽类成本较高,在世界上较不发达地区,天然生物活性肽相对于合成化学品优势尤其明显。营养上,食品中植物衍生生物活性肽具有多种营养益处[93]。安全上,与传统小分子相比,肽具有安全性和耐受性等功效。这将可能会吸引不同专业的研究人员,包括食品技术专家、生物技术专家、医生、神经学家等,这些活性物质在食品、功能性食品的制作上具有良好的发展前景。
对植源肽进行活性评估时,研究往往是先评估植物肽粗提物的活性,而这些粗提物的活性可能是由于其中的某条或几条未知序列的肽在发挥作用[94],研究者要找出发挥活性的肽链序列,将混合物中的肽单独实验,以评估具体结构肽的生物活性,并表明这些混合肽可能/不可能产生协同作用[95]。在这一层次上,可以利用生物信息学的方法,搜索已知的生物活性序列,在最初筛选混合物中的目的肽上起到重要的意义。在多肽的应用中,肽的体内、外稳定性与生物利用度是人们的主要关注问题[96]。在体外,可以通过许多方式提高肽的稳定性[97],如改变骨干结构,结合D-氨基酸或α-氨基酸等[98];在体内,肽容易被酶解,且具有高溶血活性的肽被认为不适合治疗使用,因此测试肽对红细胞的溶血活性是研究新型肽毒性的第一个程序[99-100]。研究者需要在不改变生物活性的情况下,改造肽的结构,可通过定点突变肽的一个或多个位置的氨基酸残基,筛选出更安全的可以用于预防神经退行性疾病的生物活性肽。

