美花风毛菊的抗肝癌活性研究
叶中天,李乐,付书正,刘金平,2,李平亚,2,刘云鹤,2※
(1.吉林大学药学院,吉林 长春 130012;2.吉林大学天然药物研究中心,吉林 长春 130021)
肝癌是全球第4大致死性恶性肿瘤,居全球癌症病死率的第3位,恶性程度高,复发率高,易转移,严重危害着人们的生命健康[1-4]。虽然肝癌的化学药物治疗已经有了很大的进展,但仍存在耐药性强及毒副作用大等问题[5]。美花风毛菊[Saussurea pulchella(Fisch.)Fisch]为菊科风毛菊属多年生草本植物[6],广泛分布于中国、韩国和俄罗斯。近年研究表明,从美花风毛菊中分离得到的化合物具有显著的抗肿瘤活性[7]。作为一种天然植物,美花风毛菊具有多途径、多环节和多靶点的优势[8,9]。民间常用于治疗肝炎、关节炎和高血压等疾病[10,11],但未见有关美花风毛菊抗肝癌活性的研究报道。本文以人肝癌HepG2细胞株和H22肝癌荷瘤小鼠为研究对象,评价美花风毛菊乙醇提取物的乙酸乙酯萃取部位(ESP)的体外和体内抗肝癌活性,为美花风毛菊的进一步开发与利用提供理论依据与参考。
1 材料与方法
1.1 材料
1.1.1 细胞株 人肝癌HepG2细胞株和H22肝癌细胞均购自中国科学院(上海)典型培养保存委员会细胞库。
1.1.2 动物 SPF级昆明小鼠,雌性和雄性,体重18~22 g,购自辽宁长生生物技术股份有限公司,许可证号:SCXK(辽)2015-0001。所有实验操作均按照吉林大学《实验动物管理和使用指南》进行。
1.1.3 材料与试剂 美花风毛菊的干燥全草(风干)在2018年9月中旬采摘于吉林省磐石市烟筒山镇石棚村,经吉林大学药学院李平亚教授鉴定为[Saussurea pulchella(Fisch.)Fisch],样品标本保存于吉林大学天然药物研究中心;环磷酰胺(CTX)购自Sigma公司;胎牛血清(FBS)、DMEM高糖培养基购自GIBCO公司;青霉素和链霉素购自Solarbio公司;DMSO购自鼎国昌盛生物技术有限公司;CCK-8试剂盒购自日本同仁化学研究所;白细胞介素-2(IL-2)、肿瘤坏死因子-(TNF-)、血管内皮生长因子(VEGF)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、血尿素氮(BUN)和肌酐(CRE)检测试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 ESP的制备 取干燥美花风毛菊全草1.0 kg,粉碎,加10倍量70%乙醇,加热回流提取3次,每次3 h,过滤,合并滤液,减压浓缩至无醇味,再用3倍体积的乙酸乙酯萃取3次,合并萃取液,减压回收,蒸干,得到美花风毛菊乙醇提物的乙酸乙酯萃取部位。
1.2.2 HepG2细胞的培养 使用DMEM高糖培养基,添加10%FBS、100 mg/mL链霉素和100 U/mL青霉素,在37℃、5%CO2条件下培养24 h,取对数生长期的细胞进行实验[12,13]。
1.2.3 对HepG2细胞增殖的影响测定 采用CCK-8法检测ESP对HepG2细胞增殖的影响。将HepG2细胞以5 103个/孔的密度接种于96孔板中,放置培养箱内培养24 h。以二甲基亚砜(DMSO)为溶剂,配制浓度为0g/uL、20g/uL、40g/uL、60g/uL、80g/uL、100g/uL的ESP处理细胞,将96孔板放入37℃、5%CO2的培养箱中培养24 h后,加入含10%CCK-8继续培养4h,用微板阅读器在450 nm处测定吸光度值(OD值),并计算细胞抑制率。其计算公式为:细胞抑制率(%)=[1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]100%。再以细胞抑制率为纵坐标,各给药剂量为横坐标,绘制细胞增殖抑制曲线,并计算半数抑制浓度(IC50)。
1.2.4 皮下移植瘤模型的建立 在无菌条件下,用生理盐水将H22肝癌细胞的浓度调整为5 106个/mL,并注射入小鼠腹腔。1周后,提取腹水肿瘤细胞,用生理盐水稀释成浓度为1 107个/mL的细胞悬液。稀释后的腹水肿瘤细胞悬液按每只0.2 mL接种到小鼠的右前肢腋窝以建立荷瘤小鼠模型,未接种肿瘤细胞的小鼠用作正常对照组。
1.2.5 实验分组及处理 接种后,将小鼠随机分为6组,每组10只,雌雄各半:正常对照组(生理盐水);模型组(生理盐水);CTX组(20 mg/kg);ESP低剂量组(100 mg/kg);ESP中剂量组(200 mg/kg);ESP高剂量组(400 mg/kg)。将CTX和ESP分别溶解于生理盐水中,配制相应浓度的水溶液。每组小鼠每天灌胃1次,连续给药14 d,给药剂量均为20 mL/kg。
1.2.6 荷瘤小鼠体重、肿瘤重量、抑瘤率及脏器指数的测定 每天给药前,测量小鼠体重。给药14 d后,颈椎脱臼处死小鼠,并在无菌条件下对肿瘤、肝脏和肾脏进行快速分离和称重。
肿瘤抑制率(tumor inhibition rate,TIR)的计算公式:TIR(%)=(模型组平均瘤重 给药组平均瘤重)/模型组平均瘤重100%;
脏器指数计算公式:脏器指数(mg/g)=平均器官重量/平均体重。
1.2.7 小鼠血清TNF-、IL-2和VEGF含量的测定末次给药24h后,从眼眶收集血液,在4℃、3 500 r/min的条件下进行离心获得血清,并于﹣20℃储存。测定方法参照TNF-、IL-2和VEGF酶联免疫分析(ELISA)试剂盒使用说明,采用双抗体夹心法测定小鼠血清样本中TNF-、IL-2和VEGF含量。
1.2.8 小鼠血清AST、ALT、CRE及BUN的测定测定方法参照AST、ALT、CRE及BUN试剂盒说明书。
1.2.9 组织病理学检查 用10%中性福尔马林缓冲液对每只小鼠的肿瘤、肝脏和肾脏进行快速固定,经HE染色后,用石蜡进行包埋,并切成厚度为5m的切片。在400倍显微镜下观察肿瘤、肝脏和肾脏切片,并拍照记录。
1.3 统计分析
采用SPSS 20.0进行统计学处理,组间差异采用单因素方差分析(one-way-ANOVA),组间两两比较采用t检验。以P<0.05为差异具有统计学意义。所有实验数据表示为平均值±标准偏差。
2 结果
2.1 ESP对HepG2细胞增殖抑制的影响
ESP干预24 h、48 h和72 h的细胞抑制率变化见图1。ESP分别处理24 h、48 h和72 h后,HepG2细胞的IC50分别为75g/mL、64g/mL和62g/mL(均P<0.001);从用药浓度看,同一时间的ESP对HepG2的增殖抑制作用呈剂量依赖性,其中以100g/mL抑制率为最高;从用药时间看,同一浓度的ESP对HepG2的增殖抑制作用亦呈时间依赖性,其中以72 h抑制率为最高。
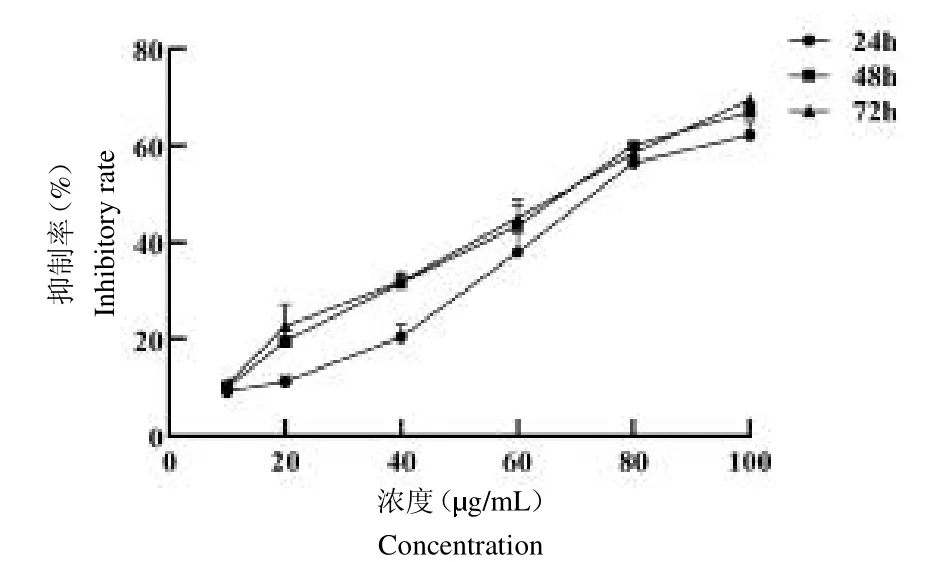
图1 ESP分别干预24 h、48 h、72 h后对HepG2细胞增殖的抑制作用Fig.1 The inhibitory effect of ESP on the proliferation of HepG2 after 24 h and 48 h,72 h intervention
2.2 对荷瘤小鼠各项指标的影响
各组荷瘤小鼠的体重、肿瘤重量以及肝、肾指数测定和计算结果见表1。
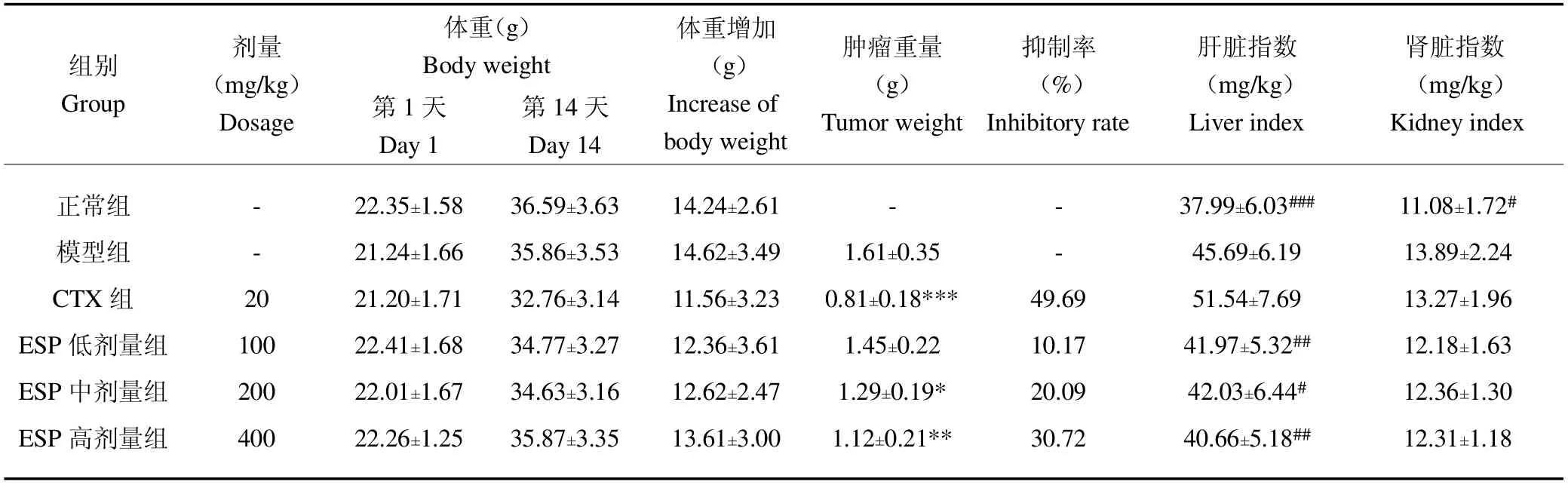
表1 各组小鼠的体重、肿瘤重量和肝、肾指数Table 1 The body weight,tumor weight,liver index and kidney index of each group
对体重的影响:与正常组比较,各组小鼠体重及体重增加均无明显差异;与模型组比较,各组小鼠体重及体重增加也无明显差异;与CTX组比较,ESP各组的体重增加较多,但无统计学意义(P>0.05)。
对小鼠肿瘤重量的影响:从表中数据可见,模型组小鼠的重量最大。ESP各剂量组的肿瘤重量均低于模型组。其中,高、中剂量的ESP可显著降低荷瘤小鼠的肿瘤重量(P<0.01,P<0.05),低剂量ESP干预的荷瘤小鼠的肿瘤重量虽小于模型组,但无统计学意义(P>0.05)。通过肿瘤重量计算得到的肿瘤抑制率结果显示,ESP低、中、高剂量组的抑制率呈现从低到高的趋势,说明ESP的治疗具有一定的剂量依赖性。
对肝、肾指数的影响:与正常组比较,CTX组小鼠的肝指数显著上升(P<0.001),说明接受CTX治疗小鼠的肝受到较大影响;与模型组比较,ESP各组小鼠的肝、肾指数均有所降低,但无统计学意义(P>0.05),说明ESP对小鼠的肝、肾指数影响较小;与CTX组比较,ESP高、中、低剂量组小鼠的肝指数显著降低(P<0.01,P<0.05,P<0.01),说明ESP的肝毒性明显弱于CTX。
2.3 ESP对小鼠细胞因子水平的影响
近年来的诸多研究表明,细胞因子具有广泛的抗肿瘤活性。细胞因子TNF-、IL-2和VEGF与肿瘤的发生、发展及转移均具有密切的关系,不仅能够直接刺激肿瘤部位的免疫效应细胞和基质细胞,而且能够增强肿瘤细胞的识别能力[14,15]。其中,TNF-在一定浓度范围内具有组织修复功能,但TNF-浓度异常升高可引起组织损伤[16]。多类肿瘤细胞会产生TNF-,TNF-又进一步刺激肿瘤生长[17]。由表2可知,模型组的TNF-水平明显高于ESP各剂量组(P<0.001,P<0.001,P<0.01),表明模型组的TNF-浓度异常升高;经过不同剂量的ESP干预后,TNF-水平显著回调,且随着剂量增加越接近于正常组水平,表明ESP可能通过回调异常升高的TNF-水平,减轻组织损伤,进而改善机体在荷瘤状态下的免疫细胞活性,抑制肿瘤生长;与模型组相比,ESP高、中剂量组的IL-2水平显著升高(P<0.001,P<0.05),表明ESP可能通过刺激T淋巴细胞的增殖和活化来发挥抗癌作用[18];与模型组相比,CTX组与ESP高、中剂量组VEGF水平均显著降低(P<0.001,P<0.001,P<0.01),表明CTX和ESP能显著抑制血清中VEGF的表达水平,并且可能通过有效减少肿瘤血管的生成来抑制肿瘤生长[19]。
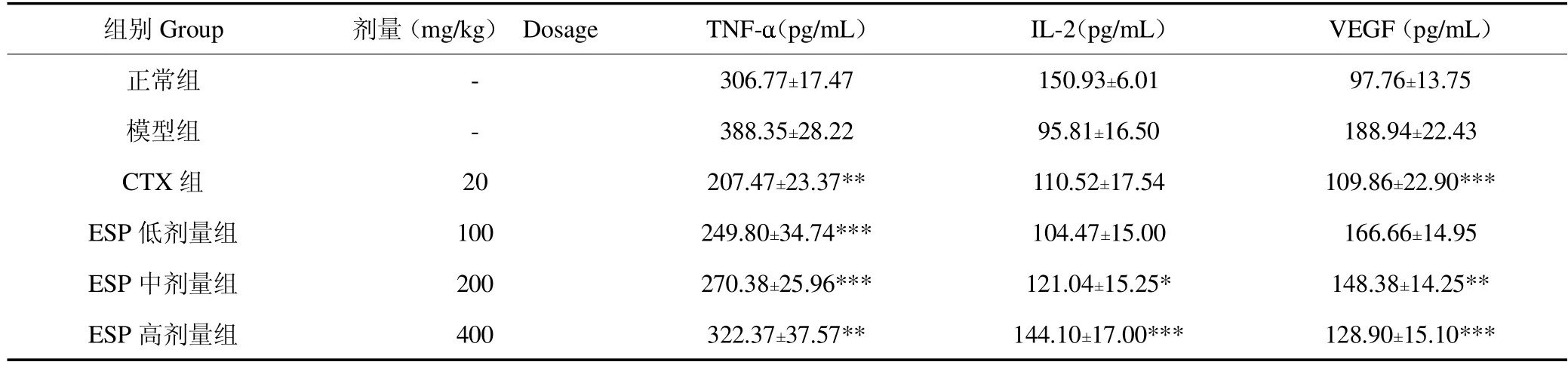
表2 各给药组对小鼠细胞因子水平的影响Table 2 The effect of each administration group on cytokine levels in mice
2.4 ESP对小鼠肝肾功能的影响
由表3可知,与正常组相比,模型组的AST、ALT、CRE和BUN的水平均显著升高(P<0.001,P<0.001,P<0.01,P<0.001);经CTX(P<0.001)或ESP(P<0.001)治疗后,升高的水平可以显著回调,其中ESP高剂量组的调节效果最好。上述结果表明,ESP表现出对肝脏的保护效果,而CTX虽然能够显著抑制肿瘤生长,但是对肝脏损害较大[20]。
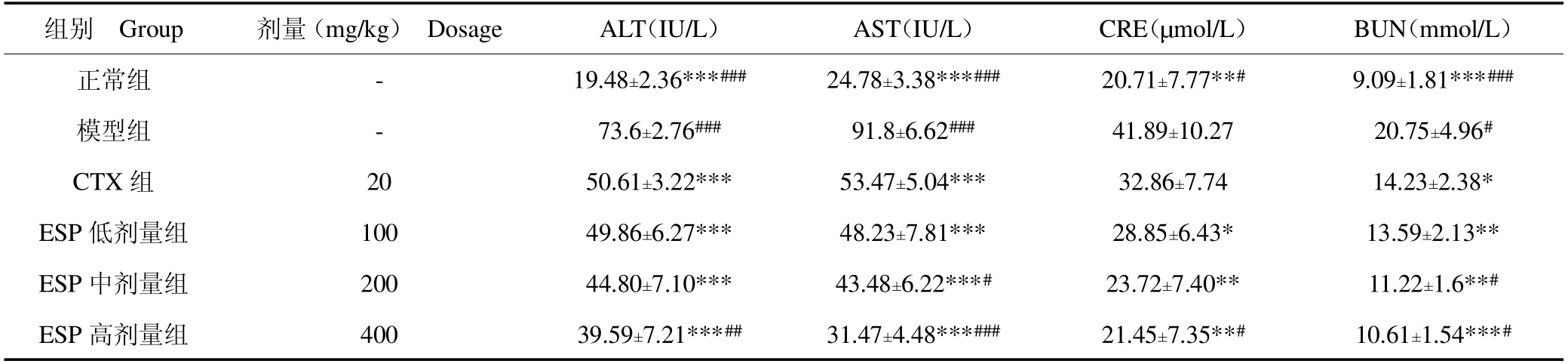
表3 各给药组对小鼠肝、肾功能的影响Table 3 The effect of each administration group on hepatic and renal function in mice
2.5 组织病理学检查
通过HE染色,观察肿瘤、肝脏和肾脏组织的病理变化(图2)。肿瘤组织的切片结果显示,模型组的肿瘤细胞呈不同形式的侵袭性生长,并且能够检测到有丝分裂活动和不同染色的肿瘤细胞[21],而CTX组与ESP组中的大部分肿瘤细胞呈现坏死状态。肝脏和肾脏组织的切片结果显示,模型组的肝肾细胞空泡多,水肿,而CTX组与ESP组的肝肾细胞未见空泡和水肿,且细胞排列整齐、状态良好[22]。上述结果说明ESP具有一定的抗肿瘤活性并且对小鼠的肝肾组织无明显的毒副作用。
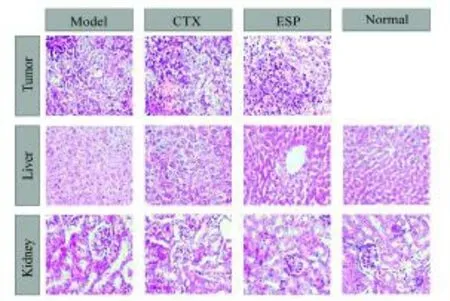
图2 肿瘤、肝脏和肾脏组织的病理切片Fig.2 The histopathological studies of tumor,liver and kidney
3 讨论
本研究利用人肝癌HepG2细胞株和H22肝癌荷瘤小鼠评估了美花风毛菊乙醇提取物的乙酸乙酯萃取部位的体外和体内抗肝癌效果。首先选用人肝癌HepG2细胞,以环磷酰胺为阳性对照药,采用CCK-8法首次评价了ESP对肿瘤细胞增殖的抑制作用。研究结果表明,ESP具有显著的体外抗肿瘤活性,且呈时间、剂量依赖关系。然后利用H22肝癌荷瘤小鼠模型,首次评价了ESP对肿瘤以及肝、肾组织的影响。研究结果表明,一方面,ESP具有显著的体内抗肿瘤活性并且可呈剂量依赖性地抑制肿瘤生长,同时可以增加TNF-和IL-2含量以及减少VEGF含量,提示ESP可能通过提高免疫能力、抑制肿瘤血管生成而发挥抗肝癌的作用;另一方面,ESP可显著回调荷瘤小鼠的ALT、AST、BUN以及CRE含量,提示ESP可明显缓解荷瘤小鼠的肝组织和肾功能损伤。
综上所述,美花风毛菊对肝癌具有抑制作用,并且可能是通过调节细胞因子的水平来发挥抗癌活性。与此同时,美花风毛菊乙醇提取物的乙酸乙酯萃取部位还表现出对肝脏和肾脏的保护效果。但是目前缺乏对美花风毛菊内发挥抗癌活性的物质进行准确鉴定以及抗癌机制的深入探讨,因此,还需要进行更多相关的研究,为美花风毛菊的开发利用提供参考。

