成肌细胞与前体脂肪细胞在共培养体系中互作关系的研究进展
谢 涛,陆惠娴,阮梦茹,AMBREEN Lqbal,姜 平,赵志辉
(广东海洋大学 滨海农业学院,广东 湛江 524088)
肉用动物肌肉中脂肪的含量、分布和组成是对肉类风味和营养品质影响最大的因素之一。大理石花纹是衡量动物肉质性状的重要指标,其形成不仅与肌内脂肪细胞大小有关,还与肌间脂肪细胞的数量有关[1]。在过去几十年的时间里,科研人员已经在动物营养、遗传性状和机体生长代谢等研究领域对肉质性状的形成进行了解析,以期更好地了解肌间脂肪的形成机制,从而在生产实践中培育出更加优质的肉用动物品种。为了更好地阐明肌间脂肪沉积的调控机制,深入研究成肌细胞和前体脂肪细胞间互作关系是十分必要的。早期的研究表明,脊椎动物的肌肉细胞与脂肪细胞共同起源于中胚层细胞,并且通过自分泌和旁分泌途径在调节动物的生长发育中有紧密的联系[2]。这一发现促使了脂肪细胞与肌肉细胞间的互作研究的兴起,但受到当时培养技术的限制,并不能很好地模拟细胞在体内的生存环境,导致很多研究无法深入进行。随着科研技术的发展,细胞培养技术从二维(2D)进入到三维(3D),并衍生出了Transwell共培养技术,为细胞间的互作研究提供了很好的模式,很多科研工作者对肌间脂肪形成中的细胞间相互作用进行了深入的研究,但对这些研究的总结依旧较少。现对成肌细胞和前体脂肪细胞的来源、功能、以及运用Transwell技术对这两类细胞之间互作关系的探究进行阐述,希望总结前人经验与成果,为后面的研究工作提供理论参考。
1 成肌细胞与前体脂肪细胞
1.1 成肌细胞成肌细胞又名肌前体细胞,是指胞浆中含有肌丝的肌组织前体细胞,主要存在于肌肉组织中,是一种专能干细胞。在胚胎发育过程中,心肌、平滑肌和骨骼肌都是由间充质细胞分化成的成肌细胞分化而来的。目前普遍认为,成熟个体的心肌和平滑肌组织不含成肌细胞,但在机体中分布最广的骨骼肌中却存在成肌细胞,并以肌卫星细胞状态休眠。一旦骨骼肌受损,卫星细胞中成肌相关基因就会被激活,卫星细胞会大量增殖,并相互融合形成新的肌纤维。所以卫星细胞又被认为是休眠的成肌细胞[3]。
早在1860年,骨骼肌的再生就得到了较为详细的描述。一个世纪后,骨骼肌的再生过程的细胞机制才被明确。1960-1961年发表的一系列开创性论文,证明了多发性成肌细胞融合产生了发育过程和肌肉损伤后再生肌肉中的多核肌纤维,并围绕着肌纤维中成肌细胞的来源开展了大量研究[4-5]。在确认细胞融合是肌管形成的机制的同时,卫星细胞被发现并被认为是成肌细胞的候选者[6]。
大多数脊椎动物的卫星细胞都位于肌肉纤维表面上,一直以来被当成一种可能的生肌前体研究,直到肌纤维被单独分离培养,才证实卫星细胞产生的后代为成肌细胞[7]。
在肌纤维形成过程中,增殖后的成肌细胞停止细胞分裂并相互融合形成有序的多核肌纤维[8]。这是一个复杂的过程,很难在正常的脊椎动物胚胎中进行研究。成人肌源性干细胞的融合能促进损伤后的肌纤维的生长和修复。在细胞水平上,这种融合经历了成肌细胞和肌管膜的对齐排列和肌动蛋白细胞骨架的重排以及细胞与细胞间膜融合的复杂过程[9]。幸运的是,随着培养技术的发展,肌纤维生成在组织培养中被逐步还原。最近,在包括果蝇、斑马鱼和小鼠在内的多种动物模型中研究发现了多种在体内进行成肌细胞融合所需的分子成分[10]。另外,在昆虫中已经发现了一类迁移的肌肉前体细胞,称为“肌肉先驱”,它们随后召募其他细胞参与到肌生成过程中[11]。
1.2 前体脂肪细胞前体脂肪细胞是一种未分化的成纤维细胞,可以特异性分化为脂肪细胞。反刍动物的脂肪发生始于妊娠中期,并持续动物的一生[12]。脂肪组织起源于中胚层,由多能间充质干细胞衍生而来。间充质干细胞(mesenchymal stem cells,MSC)大量存在于早期发育阶段,其中胎儿和新生儿阶段最多,其存在数量与动物年龄呈负相关。产后脂肪生成由机体摄入的能量利用率和脂肪生产调节机制决定。
1.2.1前体脂肪细胞诱导分化 在体内,MSC分化起始于接收到相关分子的信号。但是,在体外培养试验中,缺乏这类信号。所以,需要添加分化诱导因子来诱导MSC成脂分化。常用的3种诱导因子分别是地塞米松(dexamethasone,DEX)、吲哚美辛(indometaci,INDO)和胰岛素(insulin,INS)。DEX作为一种合成的糖皮质激素激动剂,在MSC分化过程中起有效刺激剂的作用[13]。INDO是一种非甾体类抗炎药,可通过激活过氧化物酶体增殖物激活受体γ(peroxisomal proliferators activate the receptor gamma,PPARγ)诱导成脂分化[14]。INS促进脂肪生成的机制较为复杂。胰岛素与胰岛素样生长因子1(insulin-like growth factor,IGF-1)结合引发脂肪生成,然后通过环磷酸腺苷(cyclic adenosine monophosphate,cAMP)和磷脂酰肌醇3激酶(phosphatidylinositol3 kinase,PI3K)使环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)磷酸化[15]。早期的CREB被激活来正向调节增强子结合蛋白同源蛋白/增强子结合蛋白α(CCAAT/enhancer binding protein α,C/EBPα)和PPARγ的表达[16]。INS可以作用于磷脂酰肌醇3激酶/蛋白激酶B(PI3K/Akt)通路,介导Akt磷酸化作用使GATA结合蛋白2(GATA binding protein 2,GATA2)被排除在细胞核外,影响前体脂肪细胞分化[17]。由于这些因素有利于MSC的脂肪分化,所以MSC开始向脂肪分化。随后各种转录因子被激活,进一步导致MSC向脂肪细胞分化。
利用诱导因子处理MSC后,CREB的磷酸化会相应增加,引起C/EBPβ的转录激活[17]。C/EBPβ的激活,是分化信号被级联放大的起点[18]。同时,与脂肪形成相关的基因被激活表达。PPARγ的激活是脂肪形成的关键因素,也是脂肪形成所必要的条件[19]。相关因子的表达将诱导MSC分化为前体脂肪细胞。
前体脂肪细胞的形态呈梭形(图1)。在培养过程中,外观类似于成纤维细胞或平滑肌细胞。前体脂肪细胞因子1(delta like non-canonical Notch ligand 1,DLK1)是一类跨膜蛋白,在细胞中高度表达,同时还表达了GATA2。在脂肪细胞逐渐成熟的过程中这些标记的表达会被逐步消除[20]。早期的脂肪细胞为扁平形,随着相关基因的激活,细胞会表达出脂肪细胞定向分化因子(adipocyte determination and differentiation factor 1,ADD1)、C/EBPβ、Kruppel样因子5(kruppel like factor 5,KLF5)、PPARγ、DLK1、脂蛋白脂肪酶(lipoprotein lipase,LPL)、瘦素(leptin,LEP)、脂联素(adiponectin,ADIPOQ)等作为脂肪细胞关键因子,另外影响脂代谢的重要相关基因CD44、ACADSB、ABCA1、HSL等的表达水平也会逐步变化[20-23]。
脂肪细胞呈圆形,胞内有大的脂蛋白包被的脂滴,随着脂滴的增大,核被逐渐转移到细胞外围(图1)。成熟的脂肪细胞会表达出胰岛素敏感性因子和脂肪因子,如PPARγ、C/EBPα、ADIPOQ、脂肪细胞蛋白2(adipocyte protein,AP2)、嘌呤能受体P2Y11(purinergic receptor P2Y11,P2RY11)等[24]。
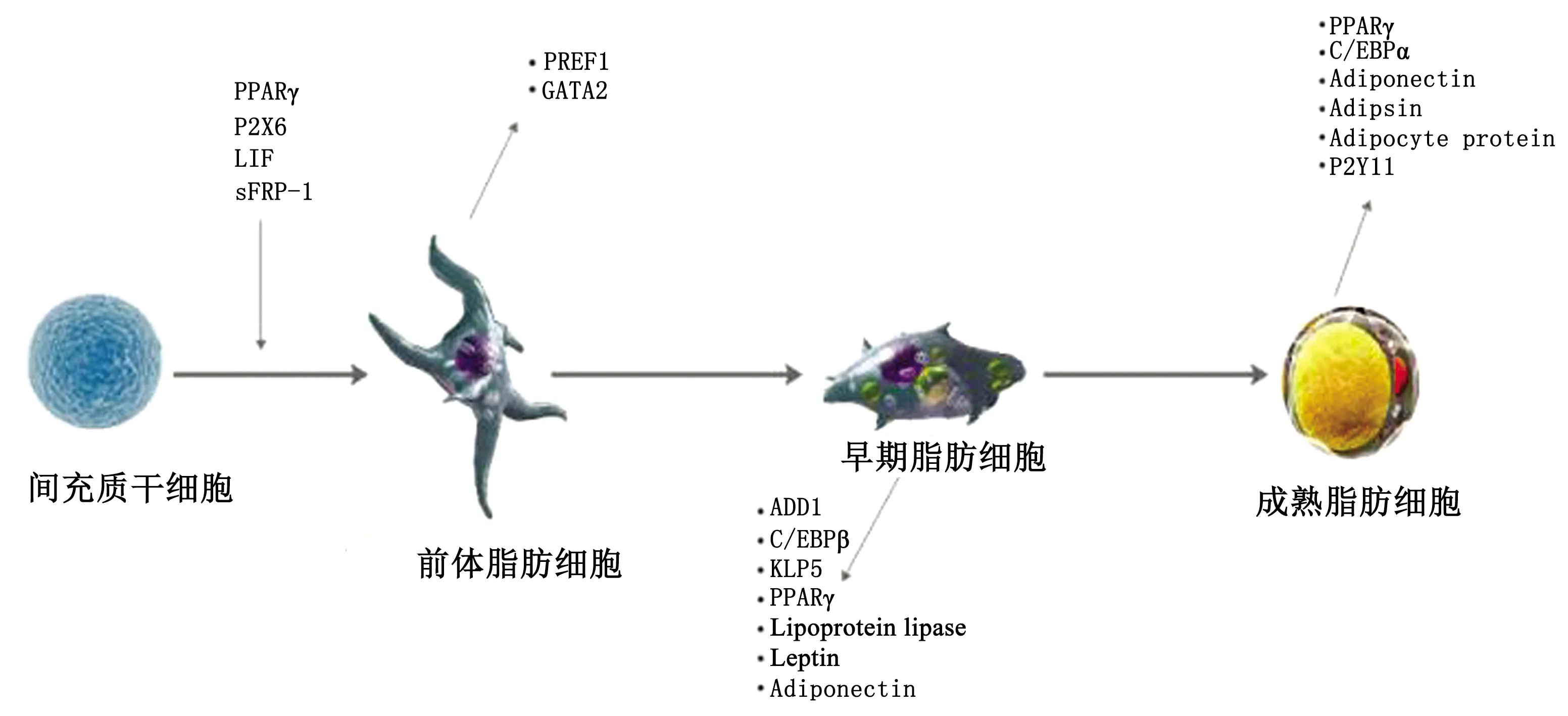
PPARγ使MSC趋向成脂分化;前体脂肪细胞表达前脂肪细胞因子1(DLK1)和GATA2。在早期脂肪细胞定向分化因子(ADD1)中,表达了C/EBPβ、Kruppel样因子5(KLF5)、PPARγ、脂蛋白脂肪酶(LPL)、瘦素和脂联素;早期的脂肪细胞发育成表达PPARγ、C/EBPα、ADIPOQ、脂肪酶(triacylglycerol lipase,Lipase)、脂肪细胞蛋白2和嘌呤能受体P2Y11(P2RY11)的脂肪细胞[25]
1.2.2脂肪细胞的类型与内分泌作用 脊椎动物中,白色脂肪细胞是机体内的能量存储细胞,在需要时会通过糖异生途径为机体提供能量。由于其内充盈着一个大脂滴,所以也被称为单房脂肪细胞。白色脂肪细胞主要形成于动物体出生后。肌间脂肪由白色脂肪细胞组成[1]。虽然动物体各个部位的白色脂肪组织形态外观相似,但不同部位的脂肪在基因表达上存在区域性差异[26],并且肌间脂肪发育与肌肉纤维形成密不可分,有研究表明肌肉纤维的生成贯穿着动物生长发育的整个过程,为机体的生长发育和能量代谢提供有力的支撑[12]。
除了储存能量的白色脂肪细胞外,哺乳动物体内还存在另一种将化学能转化为热能的脂肪细胞,被称为热原性脂肪细胞。这类脂肪细胞具有丰富的线粒体和多房脂肪滴,呈棕色,所以又名棕色脂肪细胞。棕色脂肪在小型哺乳动物肩间区分布最为丰富,这类脂肪在胚胎发育过程中开始形成。根据其功能可以推测出此类细胞是动物为抵御寒冷而进化而来,所以一度被称为冬眠器官,它们在冬眠动物和新生儿中具有维持体温的功能。有研究发现,成年的哺乳动物依然能保留一些功能性棕色脂肪细胞,这些棕色脂肪细胞能在机体遭受寒冷时发生应激反应[27]。
近一个世纪以来,脂肪细胞因作为机体主要储存能量的细胞而受到重视。随着1994年瘦素的发现,及此后许多其他分泌因子的发现,脂肪组织不再被单纯的认为是能量的储存库,而是同时作为一种内分泌组织被广泛研究[28]。瘦素的发现是能量代谢领域的一个关键点。瘦素由脂肪细胞产生和分泌,主要调节饱腹感。瘦素还作用于外周组织,调控营养平衡和炎症[29]。重要的是这一发现为脂肪细胞的内分泌作用提供了证据。同时,研究还发现了其他的脂肪因子(脂肪细胞源性细胞因子),例如脂联素。脂联素几乎都是由脂肪细胞产生,对糖代谢和脂代谢具有强大的多效性作用,并可保护心脏功能[30]。
随着被发现的脂肪因子种类越来越多,人们深刻认识到了脂肪因子对能量平衡、心血管功能、免疫调节和营养平衡的作用。但是,关于脂联素和瘦素等脂肪因子在不同靶向组织中发挥作用的具体机制还有待进一步探索。动物模型中的同源受体或目标通路的靶向缺失也需要我们进行深入的了解相关脂肪因子的功能及作用机制。
2 细胞间互作关系研究的重要工具——Transwell共培养模型
Transwell共培养的出现为细胞间的互作研究提供了很好的模型。早期研究者们在体外用二维(2D)的单细胞模型进行试验,尽管此类研究对科研工作有很大的帮助,但在对各种类型细胞的研究过程中发现仍然存在很多的不足。如肌肉细胞和脂肪细胞在体内交流/刺激/竞争生长和能量储存的研究中,2D培养无法模拟体内各生物活性物质的网络调节机制,很多试验结果与机体内的试验结果不符[31]。为了克服这些不足,在过去的20多年里,人们开发了大量的三维(3D)细胞培养模型。而Transwell共培养系统就是在这一过程中产生并被广泛运用于动物细胞模型的构建。
Transwell共培养是一种典型的3D共培养模型,将Transwell小室放入培养板中,小室内称为上室,培养板内称为下室,上下层培养液通常以聚碳酸酯膜相隔,上室内添加上层培养液,下室内添加下层培养液。将细胞接种在上室内,由于膜的通透性,下层培养液中的成分可以影响到上室内的细胞,通过调整孔径大小和应用不同方式处理聚碳酸酯膜,就可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。而在试验过程中,为了更接近体内的情况,通常情况下会在细胞培养层添加胶原以使细胞处于3D培养环境中,从而更好的研究下层培养液中的成分对上层细胞生长、运动等的影响。因此,Transwell共培养模型被广泛运用于肿瘤药物筛选和细胞互作等研究中。
根据培养细胞接触状态,Transwell共培养模型又被细分为接触培养与不接触培养2种类型(图2,3)。细胞接触共培养模型更接近体内情况,更有利于2种在体内毗邻细胞的互作研究。例如,GAILLARD等[32]的试验发现了细胞接触时内皮细胞与星形胶质细胞共培养增加了内皮细胞上紧密连接蛋白的表达,并上调细胞膜上P-糖蛋白(P-glcoprotein,P-gp)的表达。而不接触的共培养模型是将2种不同细胞接种于上室膜和下室底部,常用于研究2种细胞分泌物之间的相互作用。成肌细胞与前体脂肪细胞互作的研究也常采用此类共培养模式。Transwell共培养根据培养细胞种类的多少可分为Transwell共培养和Transwell三培养模型,在Transwell接触共培养两类细胞的基础上在下室底部再增加一类细胞,一般都是先接种下室2种细胞培养一段时间后在上室接入效应细胞。这种共培养模式最接近于体内情况,用于体外模型的构建最为合适。NAKAGAWA等[33]利用这种模式重建了血脑屏障(the blood-brain barrier,B-BB)模型。

图2 Transwell分离共培养模型 图3 Transwell接触共培养模型
如今体外Transwell共培养模型已经更加多样化和复杂化,它们在研究细胞生长、组织形态形成、干细胞分化、药物和毒性测试等方面已经被大量使用。大量的试验表明,为满足特定的细胞类型或应用的需要,不同细胞的Transwell共培养模型具有不同的特性和需要。迄今为止,许多肿瘤发生、干细胞分化和器官样体形成的复杂三维模型都使用了以ECM为基础的天然水凝胶,如胶原蛋白等。结合不同的分析技术,如近些年兴起的微阵列芯片、微流体分析等技术,可以高效的检验出培养基中的细胞因子成分,避免了因分析时间过长而导致的某些分泌的细胞因子降解,从而提高了试验的准确性。此前关于成肌细胞和前体脂肪细胞互作的研究一直都在进行,但受技术限制依旧存在很多未知,上述这些技术的兴起为深入研究这两种细胞互作提供了技术支持。
3 Transwell共培养在成肌细胞与前体细胞互作研究的应用
最早关于成肌细胞与前体脂肪细胞互作的研究可以追溯到1985年,JARETT等[34]在研究中提出了肌肉纤维和脂肪细胞之间可能存在直接调节的相互作用,他们观察到胰岛素处理后大鼠骨骼肌分泌了一种旁分泌因子,可以刺激脂肪细胞中的丙酮酸脱氢酶和糖原合成酶活性,一段时间后,脂肪细胞能够降解肌肉源性调节因子。随后,DODSON等[35]首次利用Transwell技术建立了3T3-L1前体脂肪细胞与羊肌肉卫星细胞体外共培养体系用于研究前体细胞与肌肉细胞之间的互作,并提出卫星细胞可能释放改变前体脂肪细胞生存能力和促使前体脂肪细胞分化为成熟的脂肪细胞的因子;卫星细胞和前体脂肪细胞之间存在差异,可能影响这些细胞参与肌肉发育和生长。有试验证明,肌肉细胞和3T3-L1 前体脂肪细胞在共培养模式下可以促进前体脂肪细胞的生长和增殖,同时抑制其分化[35]。但受到当时的技术限制,很多参与细胞互作的细胞因子并没有得到更加详细的论述。
随着Transwell共培养的广泛运用和相应检测技术的不断进步,越来越多的科研工作者开始探究局部产生的各类细胞因子对不同细胞的互作效应。据报道,许多不同的组织都能产生胰岛素样生长因子(insulin-like growth factor,IGFs),并且通过旁分泌和自分泌途径实现局部调控作用[35]。在脂肪细胞分化过程中,外源性IGFs抑制前体脂肪细胞有丝分裂,并促进前体细胞成脂分化[36]。有试验发现,牛肌肉卫星细胞在碱性成纤维细胞生长因子(basic fibroblast growth factor,BFGF)的调控下增殖,在IGF-1作用下发生分化;而转化生长因子-3(transforming growth factor-3,TGF-3)可以抑制牛肌肉卫星细胞的增殖和分化[37]。表皮生长因子(epidermal growth factor,EGF)、BFGF和血小板衍生生长因子(platelet-derived growth factor,PDGF)等多种细胞因子在前体脂肪细胞中促进前体细胞的有丝分裂,而生长激素(growth hormone,GH)、胰岛素、IGF-1、糖皮质激素和甲状腺激素等物质能促使前体脂肪细胞分化为成熟脂肪细胞[38]。部分生长因子也在脂肪组织中表达,可能通过局部的自分泌和旁分泌作用参与脂肪形成过程。此外,间充质脂肪细胞前体或3T3-L1细胞的脂肪生成被卫星细胞或L6肌肉细胞的存在所抑制[39]。尽管肌肉和脂肪细胞互作研究进展迅速,但肌肉细胞分泌何种因子影响脂肪细胞募集的研究尚不明确,仍需要进一步研究和探索。
在这一系列的研究过程中,已经有40多种不同类型的脂肪因子陆续被鉴定出能通过内分泌、旁分泌、自分泌直接或间接的参与到脂肪细胞的形成过程中。OJIMA等[40]研究结果表明,3T3-L1前体脂肪细胞在分化时会分泌脂肪因子。在脂肪细胞分化过程中生成的白细胞介素6(Interleukin 6,IL-6)和肿瘤坏死因子α(tumor necrosis factor α,TNF-α),能够在脂肪形成和脂肪降解中起到重要作用。因此,它们与维持正常骨骼肌和脂肪组织的质量比相关。PELLEGRINELLI等[41]研究结果表明,肌肉细胞与脂肪细胞共培养可诱导肌肉细胞IL-6 mRNA表达,并可增加相应培养基中IL-6的积累。然而,目前还不清楚是何种类型的脂肪因子在肌肉细胞中诱导IL-6的表达和细胞内信号转导,还需要进一步的研究来阐明这些问题。
4 总结和展望
成肌细胞与前体脂肪细胞的互作研究,是对肌间脂肪细胞的分化及调控机制更深入的探究,这对肉畜育种工作中的肉质改良是至关重要的。此外,卫星细胞与骨骼肌毗邻,是肌间的成肌细胞,可以直接通过旁分泌影响到肌间脂肪的形成。因此,以同一哺乳动物的卫星细胞和前体脂肪细胞为试验材料,构建的Transwell共培养系统是理想的脂代谢研究模型。而选择与人类在解剖学、生理学和遗传学水平上相似的物种,如猪的卫星细胞和前体脂肪细胞构建的共培养系统可以作为人的脂肪代谢的理想研究模型,这对寻找人类肥胖的成因和寻找肥胖引起的疾病防控方案有着重要的意义。肌间脂肪的形成是一个复杂的生理过程,是由多种细胞、细胞因子和主效基因共同参与调控,Transwell共培养系统对于与脂肪沉积、脂肪分化等相关脂肪代谢调控机制的研究也起到重要的作用,为深入挖掘肌间脂肪形成相关的功能基因和基因间互作机制提供有效的技术支撑。此外,尽管Transwell共培养技术越发成熟多样,但在成肌细胞和前体细胞的互作研究上还需要更深入的研究,这也为细胞间互作关系的机制研究提供了新的思路。近年来随着微流体技术的兴起,共培养条件下细胞互作产生的细胞因子的检测更加方便快捷。另外为模拟体内的细胞生长条件,在培养条件方面的研究也取得了一定的突破,这为成肌细胞与前体脂肪细胞互作研究提供了更有利的技术手段。

