细菌Ⅵ型分泌系统结构和功能的研究进展
钟璐嘉,蒋文灿,2*,李 鑫,曾晓慧,蒋 鑫,霞 雨
(1.四川农业大学 动物医学院,四川 成都 611130;2.动物疫病与人类健康四川省重点实验室,四川 成都 611130)
Ⅵ型分泌系统(type Ⅵ secretion system,T6SS)是一种多组分蛋白输出装置,通过将效应蛋白分泌到外环境或直接注入邻近细菌或真核细胞中发挥其功能,对于细菌的生存竞争具有重要意义[1-3]。T6SS主要存在于革兰阴性菌中,近几年关于其报道常见于大肠埃希菌属(Escherichia)、沙门杆菌属(Salmonella)、假单胞菌属(Pseudomonas)、伯氏菌属(Burkholderia)和弧菌属(Vibrio)等。其中一些细菌可编码不止一个T6SS基因簇,如副溶血性弧菌(Vibrioparahaemolyticus)[4]和肺炎克雷伯菌(Klebsiellapneumoniae)[5]染色体上携带有2个T6SS,铜绿假单胞菌(Pseudomonasaeruginosa)具有3个T6SS基因簇[6]。同种细菌编码的不同T6SS,其功能有所差异。例如,泰国伯克霍尔德菌(Burkholderiathailandensis)T6SS-4参与金属离子的摄取[7],T6SS-5介导与宿主细胞的相互作用[8]。大量研究表明,细菌T6SS具有多种生物学功能,通过介导对细菌或真核细胞的作用,能够影响致病菌对宿主的致病能力,提高细菌对环境的适应性[9]。现对细菌Ⅵ型分泌系统的组成结构和相关功能的最新研究进展进行综述。
1 T6SS的结构
T6SS至少由13个核心元件Tss(type Ⅵ secretion system)组装而成,是一种类似于噬菌体尾部的多蛋白可收缩装置,如图1所示[10-12]。核心结构主要包含两部分,即一个跨膜复合物和一个穿刺结构。在某些细菌中还存在附属结构,参与T6SS的组装。
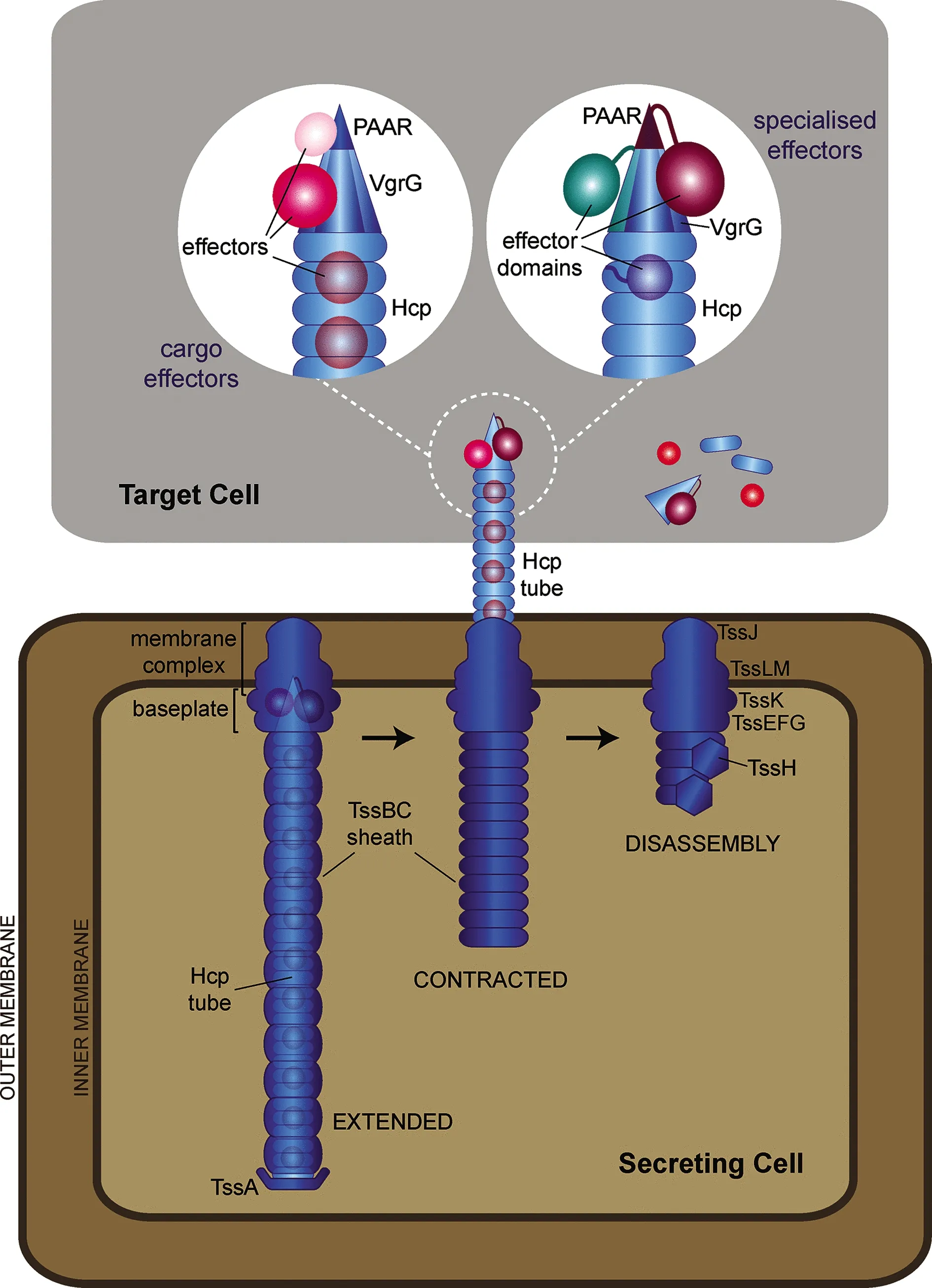
图1 细菌Ⅵ分泌系统的收缩结构[12]
1.1 核心结构
1.1.1跨膜复合物 TssJ,TssL和TssM组成的膜核心复合物TssJLM被解析为一个直径约有220埃,长度约为320埃的火箭形五聚体,横跨外膜和内膜,用于将整个装置锚定在细菌细胞膜上。由TssJ和部分TssM组成的顶端附着在细菌外膜,内膜附近柔性区域由TssL和TssM的一部分组成。TssM是该综合体的主要部分,10个TssM亚基构成双层通道,每层有5个TssM柱[13]。膜核心复合物的TssJLM具有五倍旋转对称性[14],并且每个不对称单元由2个TssM亚基和3个TssJ亚基组成。这样的结构增强了一个不对称单元中2个相邻TssJ-TssM对之间的稳定性。并且形成的TssJs界面对T6SS 膜复合物的稳定性、鞘层的形成以及T6SS介导的抗菌活性至关重要[13]。除此之外,TssJLM是基板停靠的位置,可提供通道,允许刺突和尾管通过,并在尾管移位时保持攻击细胞的完整性[15]。
1.1.2穿刺结构 T6SS的穿刺结构主要包括收缩鞘、内管、刺突和基板等4个部分。异源二聚体TssB和TssC(VipA和VipB)聚合组成收缩鞘结构,包围由多个溶血素共调蛋白(Hcp/TssD)六聚体堆叠形成的内管[16-17]。在Hcp管顶部是缬-甘氨酸重复蛋白G(VgrG/TssI)三聚体组成的刺突,顶端覆有脯氨酸-丙氨酸-丙氨酸-精氨酸(PAAR)重复蛋白单体[18-19]。TssBC鞘的快速收缩为排出的Hcp-VgrG-PAAR结构提供足够的能量和伸展,促使Hcp-VgrG-PAAR结构穿过基板和膜复合体,离开分泌细胞,刺入受体细胞。收缩后,收缩的鞘被ATP酶TssH(ClpV)特异性地解聚,而效应因子则在靶细胞内以某种方式释放[20-21]。形成的管鞘结构组装在TssEFGK子单元组成的基板上[22]。基板由TssEFGK 楔块围绕中心VgrG-PAAR单元形成[23]。TssK通过与TssFG和TssLM的跨膜结构域相互作用,作为连接基板和膜复合物的连接器[24]。TssA在不同的T6SS系统中有不同的位置,目前已有研究报道,其参与管鞘结构的引发和聚合或作为基板组分起作用[25-26]。T6SS核心组分中,Hcp、VgrG和PAAR蛋白能与效应蛋白非共价结合充当载体,有的还可以包含具有效应功能的结构域[27-29]。最近已经描述了存在于肠杆菌科成员中的具有许多不同C末端效应结构域的专门Hcp效应子家族[30]。这些“特殊”效应蛋白与Hcp、VgrG或PAAR蛋白的效应结构域共价融合,组成结构的一部分,随着Hcp、VgrG或PAAR蛋白的转位被一同递送到靶细胞中。
1.2 附属结构除了上述核心组件外,T6SS中还存在附属结构。在肠聚集性大肠杆菌(EAEC)中,TagL肽聚糖结合蛋白N末端跨膜区,能与膜复合物TssL跨膜螺旋结合,帮助膜复合物锚定在内膜上[31]。TssA相关家族蛋白TagA,在鞘组装后期,能结合鞘远端与TssA相互作用,以停止和稳定伸展的TssBC鞘;缺失TagA将引起异常的鞘聚合,导致鞘变形弯曲并最终破裂,T6SS活性降低[32]。因此,这些附属结构,有助于T6SS装配效率的提高、结构的稳定及功能的发生。
2 T6SS的功能
T6SS能够运输多种不同类型的效应蛋白,决定了T6SS功能的多样性。T6SS分泌的效应蛋白可以通过作用于细胞壁[33]、细胞膜[34]和核酸[6]等相关靶位,影响靶细菌或靶细胞的功能,与许多细菌的致病性相关。研究表明,T6SS也利于细菌获取营养素和DNA,提高细菌在宿主体内的生存能力。T6SS结构组分的缺失,能影响T6SS的组装从而影响其相关功能[32,35]。
2.1 参与细菌竞争T6SS参与细菌竞争过程中强效毒素的传递,在大多数情况下导致竞争细菌细胞损伤,有利于细菌获取生态位[36]。肠产毒素大肠杆菌(enterotoxigenicEscherichiacoli,ETEC)分泌的T6SS依赖性毒素VT1和VT5能水解细胞壁肽聚糖,利于种间竞争[33]。铜绿假单胞菌释放的Tse7核酸酶引起靶细菌DNA降解和生长停滞,有益于自身存活[6]。体外试验表明,都柏林沙门菌(Salmonelladublin)T6SS缺失株与大肠杆菌菌株共培养时,突变株较野生型菌株竞争能力减弱[37]。伯克霍尔德菌(Burkholderiacenocepacia)T6SS-1能够限制大肠杆菌和恶臭假单胞菌的生长[38]。比较肠外致病性大肠杆菌(extraintestinal pathogenicEscherichiacoli,ExPEC)VgrG缺失株和亲本株中共培养的T6SS阴性大肠杆菌菌株含量变化,结果显示缺失株对细菌的竞争能力显著低于亲本株[39]。在肺炎克雷伯菌中,icmF(TssM)或Hcp基因缺失均降低了菌株种间和种内的体外抗菌能力[40]。
体内研究表明,在诸如肠道的多微生物环境中,T6SS通过参与细菌竞争抑制局部微生物群,促进表达T6SS的细菌在肠道中定植。霍乱弧菌(Vibriocholerae)中T6SS介导的对宿主共生微生物群的抗菌活性,能抑制或清除竞争者以获得目标生态位,利于自身在幼鼠肠道中定植,同时加重了相关疾病症状[9]。鼠伤寒沙门菌(Salmonellatyphimurium)毒力岛-6(SPI-6)编码T6SS,分泌的抗菌酰胺酶Tae4(切割肽聚糖)与hcp特异性结合作用于靶细菌,这种T6SS依赖性共生细菌的杀伤是鼠伤寒沙门菌在宿主肠内建立感染所必需的[41]。而宋内志贺菌(Shigellasonnei)T6SS缺失株则无法突破正常微生物群形成的保护屏障,不利于其在小鼠肠道中定植[42]。T6SS不只存在于致病菌中,也有研究表明,非产毒素脆弱拟杆菌(non-toxigenicBacteroidesfragilis,NTBF)竞争排除肠产毒性脆弱拟杆菌(enterotoxigenicBacteroidesfragilis,ETBF),限制毒素分泌并保护宿主抵抗肠炎性疾病,这种细菌间的竞争或许可用于新型益生菌的开发[43]。上述相关报道证实了T6SS能克服微生物群介导的定植抗力,也有报道称T6SS介导的细菌间竞争还可以导致不相同细菌种群的空间分离[44]。
细菌通过T6SS介导的竞争细菌的杀伤,自身及其同源姐妹细菌却能不受影响,是由于存在相应免疫蛋白阻止效应蛋白进入后的毒性作用[45-46]。这些效应-免疫对具有菌株特异性和多样性,不同效应-免疫对间还存在相互作用[47],加强了细菌间的竞争。
2.2 介导细菌与真核细胞的相互作用T6SS分泌的效应蛋白作用于靶目标,可引起一系列的宿主反应。伯克霍尔德菌效应蛋白TecA,引起RhoA GTP酶中特定的天冬酰胺残基去酰胺化,破坏肌动蛋白,激活炎性小体,宿主细胞发生焦亡[48]。JIANG等[49]报道,铜绿假单胞菌T6SS分泌的Tle4家族磷脂酶TplE可导致细胞内质网损伤,从而诱导自噬并最终造成宿主细胞死亡。
细菌对宿主细胞的黏附和入侵是其在宿主体内定植的2个关键过程。T6SS的表达对细菌黏附、入侵宿主细胞具有重要意义,能影响病原体感染宿主能力或病症的严重程度。猪源肠外致病性大肠杆菌的VgrGs缺失株对人脑微血管内皮细胞(HBMEC)的年附、入侵能力和细胞毒性显著下降;缺失株感染小鼠,较亲本株而言,在小鼠血液、大脑、肝脏和脾脏中的载菌量减少,小鼠存活率显著升高[39]。与报道的Hcp缺失株试验结果一致[50]。在禽致病性大肠杆菌(avian pathogenicEscherichiacoli,APEC)中也有相似研究,缺失 VgrG 的菌株对细胞黏附、入侵作用减弱,在组织器官中增殖能力显著降低,对雏鸭致病力减弱[51]。ClpB 是ClpV的同源蛋白,为T6SS提供能量,缺失 ClpB 的禽致病性大肠杆菌在巨噬细胞内存活能力及对动物的致病能力降低[52]。鸡伤寒沙门菌(Salmonellagallinarum)T6SS突变株与野生株相比,对来自母鸡的单核细胞衍生的原代巨噬细胞的细胞毒性显着降低[37]。T6SS阳性鸡源空肠弯曲杆菌(Campylobacterjejuni)具有对细胞更强的黏附、入侵能力,利于在组织器官中定植,还可诱导更强烈的免疫应答[53]。肺炎克雷伯菌中的Ⅵ型分泌系统参与对人Caco-2结肠上皮细胞的黏附和入侵,其T6SS受损的突变体肠道定植减少[40]。
2.3 促进基因水平转移许多革兰阴性菌T6SS介导的非自身细胞裂解,导致DNA从靶细胞中释放出来,从而促进基因水平转移[54-55]。研究表明,霍乱弧菌可以通过基因水平转移获得新的T6SS效应基因并利用它们杀死相邻细胞[56]。肺炎克雷伯菌与霍乱弧菌一样,可以通过自然转化获得新的T6SS效应蛋白和免疫蛋白,并能将其递送到靶细胞中[5]。类似地,在鲍曼不动杆菌(Acinetobacterbaumannii)中也证实了T6SS介导水平基因的获得。遗传物质能从猎物大肠杆菌转移到鲍曼不动杆菌中,并且转移的频率足以允许实时观察。除此之外,鲍曼不动杆菌还能通过此途径获得适应性的抗生素抗性基因,这可能也是其容易产生抗生素耐药性的原因之一[57]。但关于T6SS介导的外源耐药基因获取作用还有待进一步研究。
2.4 具有抗氧化胁迫作用研究表明,细菌T6SS受环境信号调节[58],在氧化应激的条件下,释放效应物到外环境中,利于细菌吸收营养素,维持胞内羟基自由基水平,起到抗氧化胁迫作用。据报道,在假结核耶尔森菌(Yersiniapseudotuberculosis)中,OxyR蛋白响应氧化胁迫,激活T6SS基因的表达,将锌离子结合蛋白转移到胞外,实现金属离子的获得,进而消除体内自由基,达到抗氧化胁迫的目的[59]。在严重氧化胁迫压力下,泰国伯克霍尔德菌T6SS分泌TseZ 锌清除蛋白,也能结合环境中Zn2+,并与血红素转运蛋白HmuR相互作用,利于摄取Zn2+,增强氧化应激抗性[60]。相似地,它还可通过释放T6SS依赖性Mn2+结合效应物TseM,促进Mn2+的捕获以减轻氧化应激[61]。此外,来自肠出血性大肠杆菌(enterohemorrhagicEscherichiacoli,EHEC)的T6SS效应物KatN过氧化氢酶,可以降低宿主细胞的活性氧(ROS)水平,促进吞噬细胞中EHEC的存活[62]。这些拥有T6SS和相关效应蛋白的细菌,更易抵抗不良环境,相较其他菌更具优势。
3 展望
T6SS通过传递各种效应蛋白以实现其功能的多样性,为细菌在宿主体内生存提供益处。现有报道T6SS介导肠道内共生细菌的杀伤,未来很有可能会出现更多实例证明多微生物群的组成、变化和功能与T6SS有关。并且T6SS介导的细菌竞争作用,或许可用于研发特异性靶向药物抑制细菌T6SS,降低携带T6SS病原体的环境适应性以达到抗菌目的,为开发新型抗菌药提供了潜在可能性。近几年来,有关细菌T6SS功能的研究,主要集中在其能够影响细菌对宿主的致病力方面。因此,深入研究细菌的T6SS,对于了解细菌的致病机理,开发相关弱毒苗或亚单位疫苗,有积极作用。除此之外,研究T6SS的效应蛋白及其与靶细胞的相互作用,还有利于了解更多关于宿主的基本生理学。总之,细菌的T6SS是近几年研究热点,无论是从疾病预防方面,还是加深对宿主认识方面都具有重大意义。

