马疱疹病毒1型gp2基因缺失株的构建及生长特性分析
胡 月,贾钦瑞,吴桂灵,车传忠,刘建华,加尔肯,冉多良
(新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052)
马疱疹病毒1型(equine herpesvirus-1,EHV-1)曾被列为马鼻肺炎的病原体之一,2012年5月世界卫生组织将其所致疾病称为马疱疹病毒-1型感染(infection with equine herpesvirus-1),2020年7月我国农业农村部将该病列为二类动物传染病[1]。该病毒可引起马属动物呼吸系统疾病、孕马流产、新生马驹死亡和神经系统疾病,给马产业造成严重的威胁[2]。历年来,我国的流行病学调查显示,全国各地区均有EHV-1的流行[3]。2015-2019年,新疆地区该病的平均阳性率为30.47%,成为当前需要重点防控的病毒性传染病之一[4-5]。
EHV-1具有很强的传染性,潜伏期长且无特效药治疗,免疫接种是预防该病最有效的手段。目前,我国尚无防控该病的商品化疫苗,主要依赖进口,价格昂贵,故急需一种适用于我国流行毒株的、自主研发的疫苗。FRYMUS等[6]研究表明,EHV-1减毒活疫苗能诱导机体产生体液免疫和细胞免疫应答,其免疫保护效果高于灭活疫苗。EHV-1的gp2蛋白含有817个氨基酸,是病毒复制过程中非必需糖蛋白,与病毒的毒力直接相关。与HSV-1和α亚科其他的病毒相比,gp2是EHV-1编码的特有的糖蛋白,富含丝氨酸和苏氨酸,具有很高的免疫原性[7]。因此,本试验拟以我国流行毒株EHV-1 XJ2015株为亲本毒株,采用同源重组方法筛选出gp2基因缺失毒株,为后续EHV-1毒力基因缺失疫苗的研制奠定基础。
1 材料与方法
1.1 毒株与细胞EHV-1 XJ2015株、RK-13细胞系、载体pEGFP-C1和pUC19均由新疆农业大学动物医学学院传染病实验室保存。
1.2 主要试剂2×PrimerSTAR Max购自于北京全式金生物技术有限公司;DNA Marker购自于TaKaRa宝生物(大连)工程有限公司;Gel Extraction Kit 和Cycle Pure Kit购自于OMEGA广州飞扬生物工程有限公司,LipofectamineTM3000购自于赛默飞世尔科技公司。
1.3 引物设计合成参照EHV-1 XJ2015株的全基因测序结果及pEGFP-C1的序列信息,设计gp2基因左右同源臂和EGFP表达盒的特异性引物及鉴定性引物,引物序列见表1。

表1 引物序列
1.4 转移载体的构建转移载体pUC-gp2-LR与pUC-gp2-LR-EGFP构建过程如图1所示,采用酚-氯仿法提取EHV-1 XJ2015基因组,利用gp2L-F和gp2L-R、gp2R-F和gp2R-R引物PCR扩增gp2基因左右同源臂,参照Gel Extraction Kit说明书回收PCR产物,使用Q.Cut HindⅢ/BamHⅠ、kpnⅠ/EcoRⅠ分别酶切gp2L和gp2R,与pUC19载体连接,转化至感受态细胞DH5α,将鉴定为阳性的重组质粒pUC-gp2-LR送至生工生物工程(上海)股份有限公司进行序列测定。将pUC-gp2-LR和EGFP表达盒片段采用Q.Cut BamHⅠ/kpnⅠ进行酶切,经连接转化后将鉴定为阳性的重组质粒pUC-gp2-LR-EGFP送至生工生物工程(上海)股份有限公司进行序列测定。通过NCBI Blast比对,确保序列正确并按照Endo-free Plasmid Miniprep Kit说明书提取无内毒素质粒,-80℃保存备用。
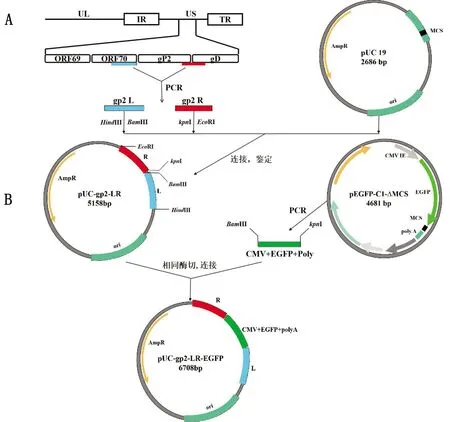
A.转移载体pUC-gp2-LR构建策略;B.转移载体pUC-gp2-LR-EGFP构建策略
1.5 EHV-1 XJ2015-gp2-/EGFP+的筛选及纯化采用酚-氯仿法提取EHV-1基因组,当RK-13细胞汇合度达到90%时,采用转染试剂LipofectamineTM3000对转移载体pUC-gp2-LR-EGFP与EHV-1基因组进行共转染,转染后48~72 h,在荧光倒置显微镜下观察细胞病变效应(cytopathic effect,CPE),当出现CPE时,用低熔点营养琼脂铺板进行重组病毒的蚀斑筛选,挑取最大的荧光蚀斑加入DMEM培养基重悬,反复冻融3次后,4℃下10 000 r/min离心10 min,按10倍系列稀释接种RK-13细胞中孵育1 h后铺板培养,重复上述操作直至蓝光条件下观察到的所有病毒蚀斑均呈现绿色荧光。命名纯化干净的重组病毒为EHV-1 XJ2015-gp2-/EGFP+。使用△gp2-F和△gp2-R引物进行PCR鉴定。
1.6 EHV-1 XJ2015-gp2-的筛选及纯化提取EHV-1 XJ2015-gp2-/EGFP+株基因组,将其与转移质粒pUC-gp2-LR共转染至RK-13细胞,利用上述方法挑取不发出绿色荧光的蚀斑进行筛选纯化,直至所有病毒蚀斑均不发出绿色荧光,命名该病毒为EHV-1 XJ2015-gp2-。使用△gp2-F、△gp2-R、△EGFP-F和△EGFP-R引物进行PCR鉴定。
1.7 重组病毒的生长特性分析RK-13细胞汇合度达到90%时,进行细胞计数;按照常规方法计算病毒感染复数(muhiplieity of infection,MOI);按MOI=0.1将XJ2015株与XJ2015-gp2-接种至细胞中,并设立正常细胞对照;分别在感染后4,6,12,24,36,48,60,72 h逐一收获病毒液;反复冻融3次后离心过滤测定病毒液TCID50并绘制病毒的一步生长曲线。按MOI=0.1将XJ2015株与XJ2015-gp2-接种至细胞中;37℃、5%CO2培养箱中孵育1.5 h 后使用低熔点营养琼脂铺板培养;3 d后采用中性红染色并测量蚀斑面积。
2 结果
2.1 左右同源臂的扩增及测序结果利用gp2L和gp2R特异性引物进行EHV-1 XJ2015株gp2基因左右同源臂的扩增,结果显示分别扩增出1 237 bp和1 235 bp 大小的片段(图2),经测序及序列分析结果显示该片段与相应的基因片段同源性达100%,成功获得同源臂序列。
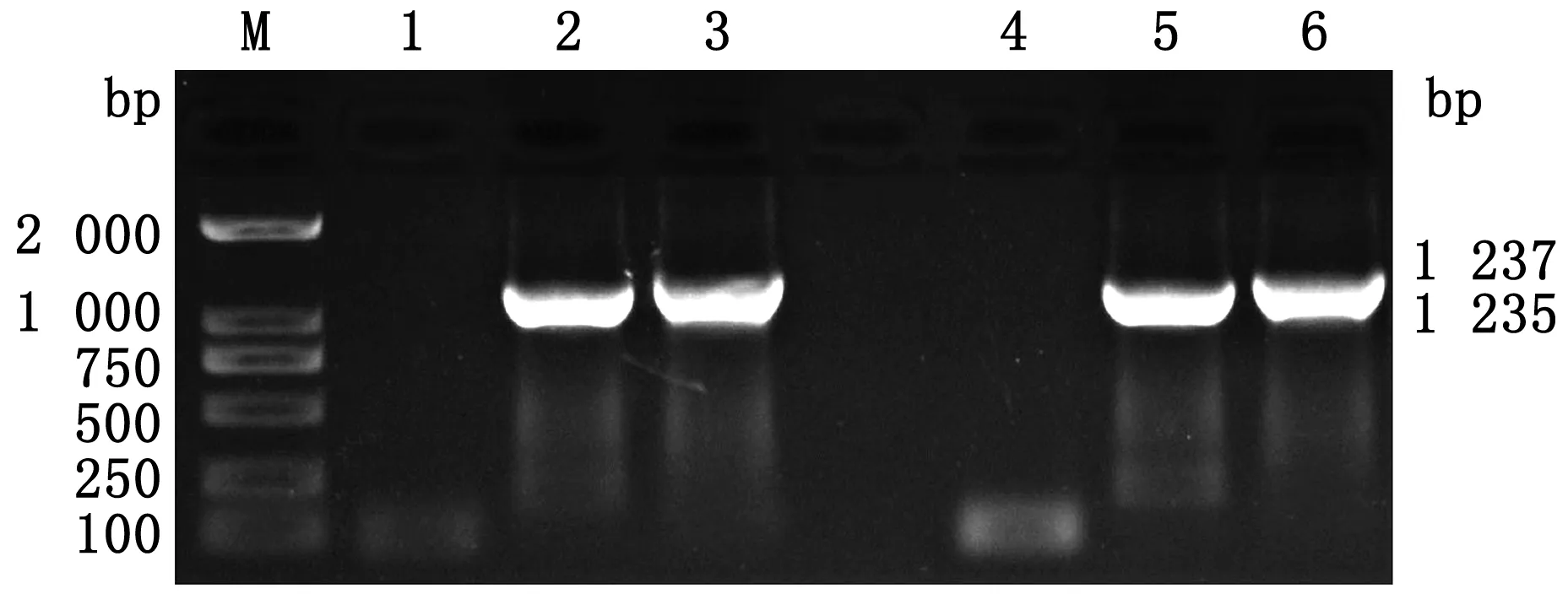
M.DL2000 DNA Marker;1.gp2L阴性对照;2.gp2L阳性对照;3.gp2L扩增产物;4.gp2R阴性对照;5.gp2R阳性对照;6.gp2R扩增产物
2.2 转移质粒pUC-gp2-LR 和pUC-gp2-LR-EGFP 酶切鉴定结果pUC-gp2-LR分别经HindⅢ/BamHⅠ、kpnⅠ/EcoRⅠ酶切和EcoRⅠ酶切,结果显示1泳道出现3条带,包括约为1 237 bp(gp2L)的片段;2泳道出现2条带,包括约为1 235 bp(gp2R)的片段;3泳道出现1条带,约为5 340 bp(图3A),均与预期片段大小相符,表明成功构建pUC-gp2-LR。pUC-gp2-LR-EGFP分别经HindⅢ/BamHⅠ、BamHⅠ/kpnⅠ、kpnⅠ/EcoR Ⅰ酶切,1泳道出现3条带,包括约为1 237 bp(gp2L)的片段;2泳道出现2条带,包括大小为1 550 bp(EGFP)的片段;3泳道出现2条带,包括约为1 235 bp(gp2R)的片段(图3B),均与预期片段大小相符,表明成功构建pUC-gp2-LR-EGFP。
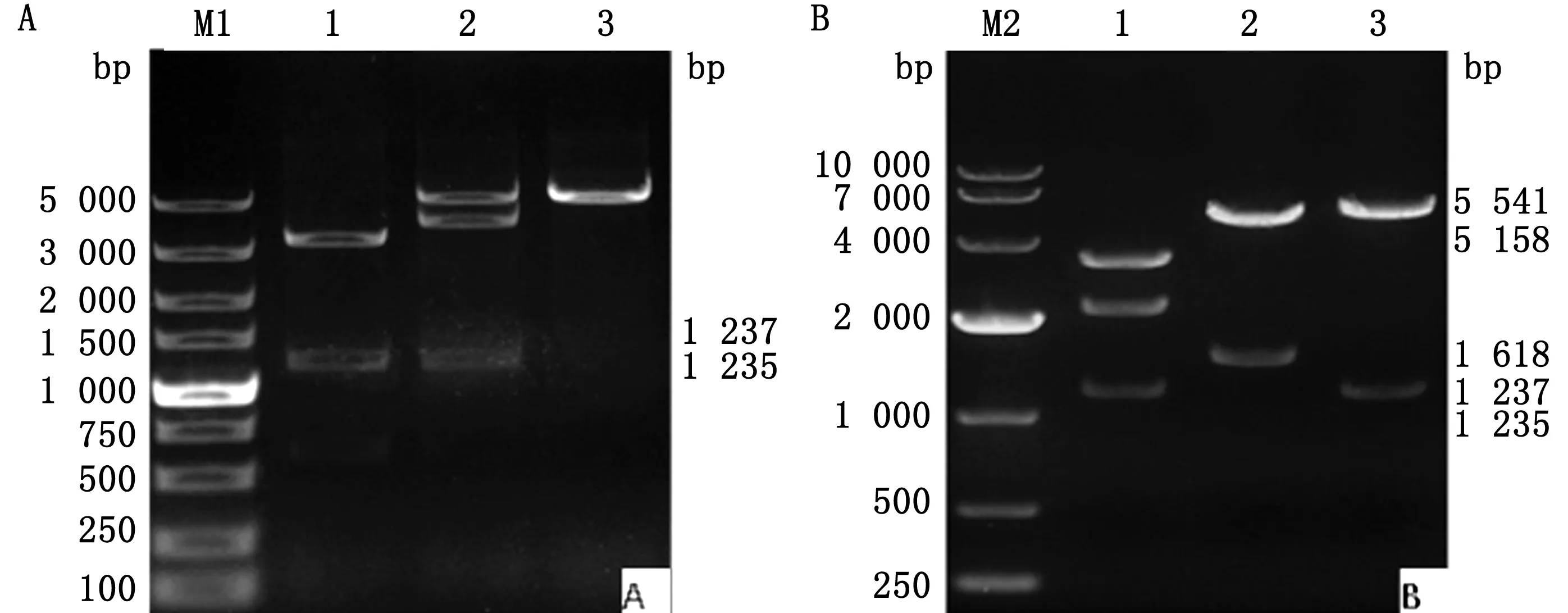
M1.DL5000 DNA Marker;A1.HindⅢ/BamHI酶切产物;A2.KpnⅠ/EcoRⅠ酶切产物;A3.EcoRⅠ酶切产物;M2.DL10000 DNA Marker;B1.HindⅢ/BamH I酶切产物;B2.BamHⅠ/KpnⅠ酶切产物;B3.KpnⅠ/EcoRⅠ酶切产物
2.3 EHV-1 XJ2015-gp2-/EGFP+的拯救及鉴定pUC-gp2-LR-EGFP与EHV-1 DNA基因组共转染至RK-13细胞。转染48 h后收获病毒液,连续经过7轮蚀斑纯化,所有的病毒蚀斑均呈现绿色荧光(图4),采用△gp2-F/△gp2-R,EGFP-F/EGFP-R引物对重组病毒EHV-1 XJ2015-gp2-/EGFP+进行PCR鉴定。结果显示,重组病毒可以特异性扩增出大小为1 550 bp的EGFP基因片段,但不能扩增出大小为544 bp的△gp2片段(图5),表明重组病毒已纯化完全。
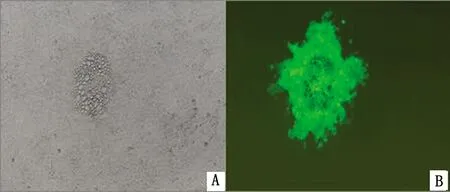
A.常光下XJ2015-gp2-/EGFP+形成的蚀斑;B.蓝光下XJ2015-gp2-/EGFP+形成的蚀斑
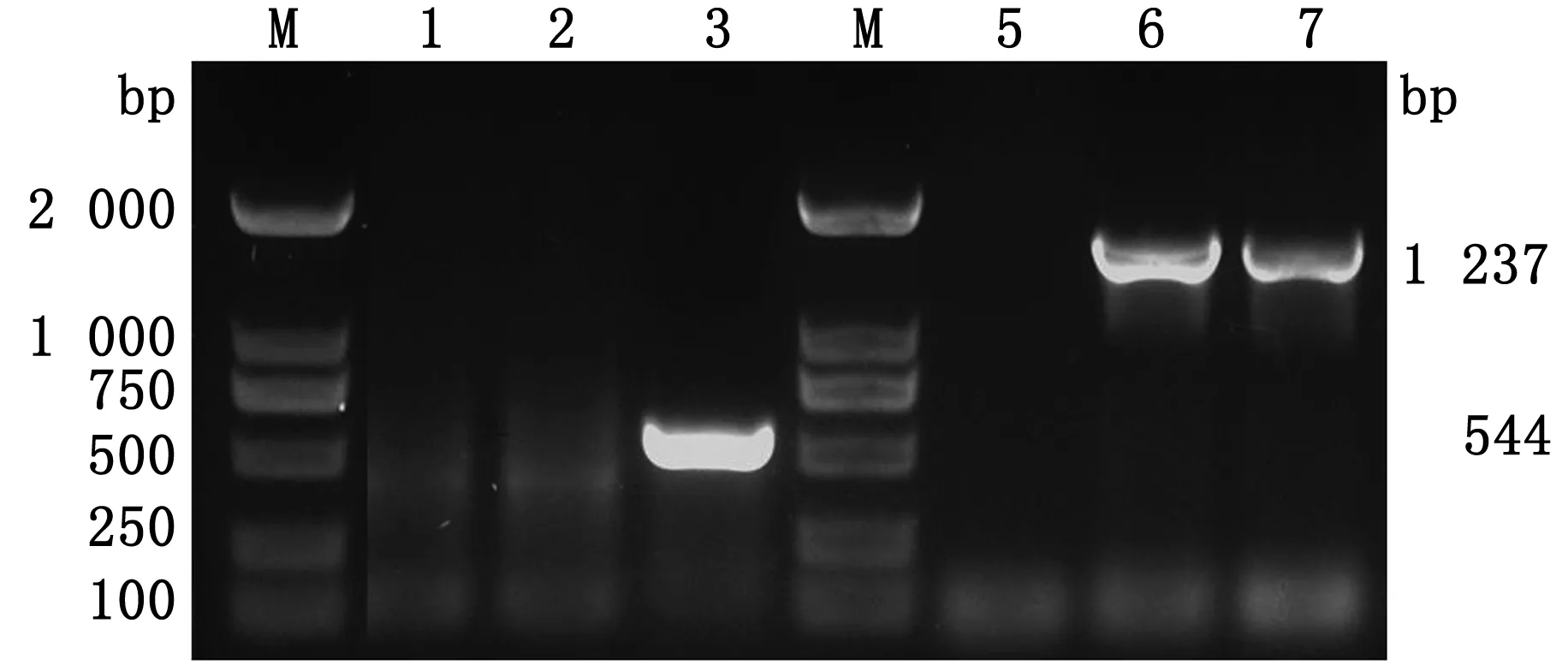
M.DL2000 DNA Marker;1.△gp2阴性对照;2.△gp2 PCR扩增产物;3.△gp2阳性对照;4.EGFP阴性对照;5.EGFP PCR扩增产物;6.EGFP阳性对照
2.4 EHV-1 XJ2015-gp2-的拯救及鉴定pUC-gp2-LR与EHV-1 XJ2015-gp2-/EGFP+株病毒DNA共转染至RK-13细胞进行反向重组,经过3轮纯化后,所有的病毒蚀斑均不呈现绿色荧光(图6),采用EGFP-F/EGFP-R,△gp2-F/△gp2-R引物进行PCR鉴定,结果显示重组病毒不能特异性扩增EGFP和△gp2片段(图7)。结果表明,成功拯救并纯化获得了去除EGFP基因的EHV-1gp2基因缺失株。

A.常光下XJ2015-gp2-形成的蚀斑;B.蓝光下XJ2015-gp2-形成的蚀斑
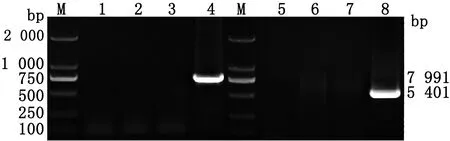
M.DL2000 DNA Marker;1.△EGFP阴性对照;2,3.△EGFP PCR扩增产物;4.△EGFP阳性对照;5.△gp2阴性对照;6,7.△gp2 PCR扩增产物;8.△gp2阳性对照
2.5 病毒复制动力学曲线的绘制将亲本株与gp2缺失株分别以MOI=0.1感染RK-13细胞,不同时间段收获病毒后绘制一步生长曲线(图8),亲本株与gp2基因缺失株的增殖速度及病毒效价存在差异,亲本毒在36 h达到最高效价,为10-8.75TCID50/0.1 mL,后者在48 h达到最高效价,为10-6.3TCID50/0.1 mL;gp2基因缺失株测定结果显示,该毒株增殖能力降低了约2个病毒滴度,表明gp2基因影响病毒增殖能力。
2.6 EHV-1 XJ2015-gp2-毒株与EHV-1 XJ2015株空斑大小的比较将EHV-1 XJ2015-gp2-重组毒株和亲本毒以MOI=0.1接种单层RK-13细胞,经吸附,固定培养和中性红染色等操作后在荧光倒置显微镜拍照,随机各测量50个EHV-1 XJ2015-gp2-毒株和亲本毒的独立空斑面积,平均值分别为0.378 mm2和1.698 mm2,经One-way ANOVA方法分析空斑面积大小显示,两者差异极显著(P<0.01)(图9)。
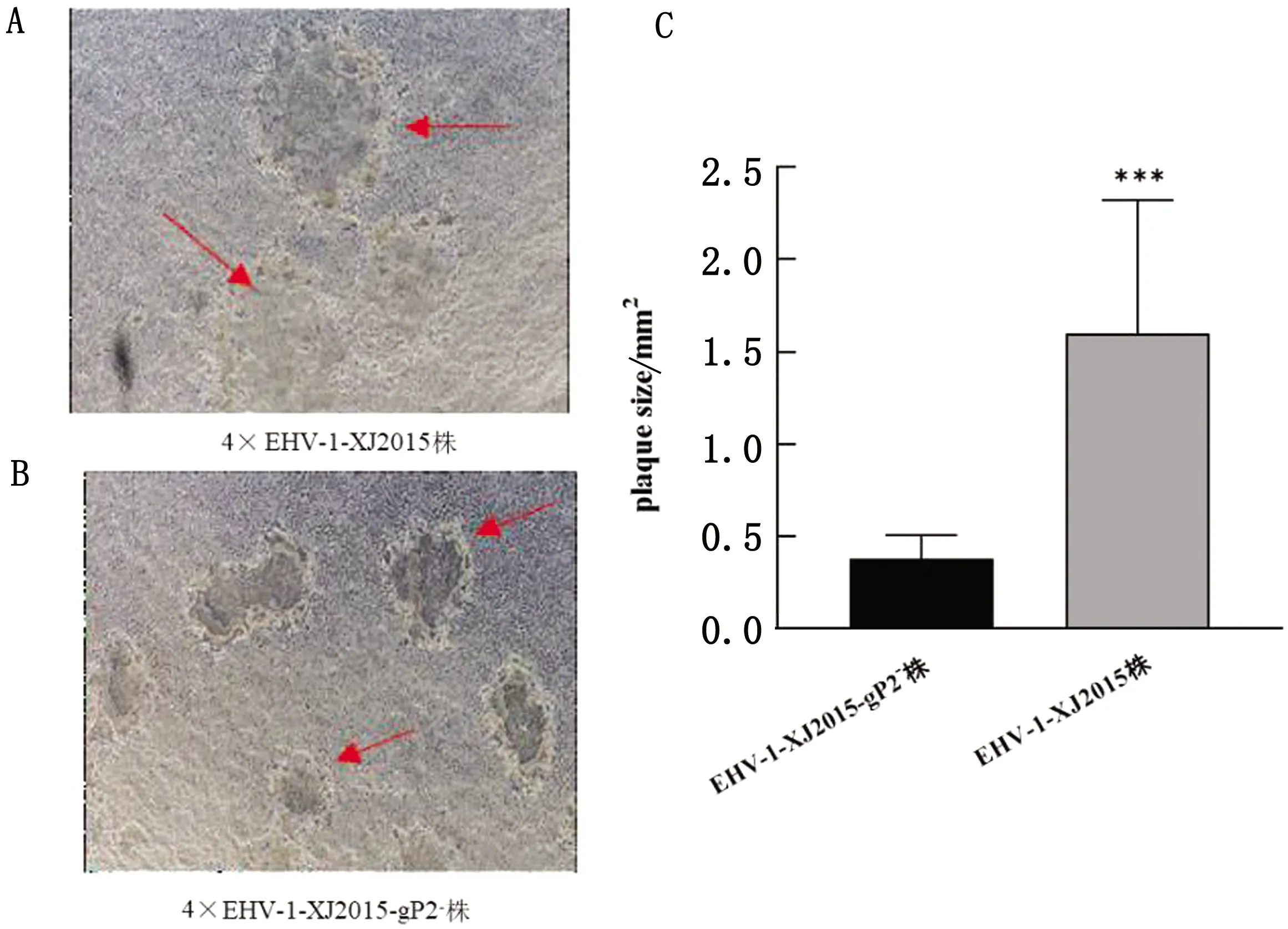
图9 EHV-1 gp2基因缺失毒株和亲本毒株的蚀斑形态(A、B)及面积比较(C)
3 讨论
目前,本课题组已进行了灭活疫苗、核酸疫苗、亚单位疫苗的初步研制,但上述这些疫苗需与免疫佐剂配合使用,免疫原性较低,需要多次免疫,并建立完善的免疫程序才能达到较好的免疫效果[8]。相比之下,减毒活疫苗的免疫程序较简单且节约经济成本,毒力减弱或无毒的活毒株本身即为疫苗株,不需要配合佐剂使用,免疫效果强而持久,但保质期相对较短,存在毒力返租的风险,需要在研发阶段进行大量的安全性与稳定性监测[9]。我国对于EHV-1减毒活疫苗的研发还处于开拓阶段。
根据XJ2015株的全基因测序及遗传进化分析表明,gp2基因为该病毒76个基因中保守性最低的基因[10]。而根据VON EINEM等[11]的报道,gp2基因缺失对EHV-1 Ab4、RacL11、RacH、KyA这4株病毒生长的影响存在差异性。本研究测定了EHV-1 XJ2015株和EHV-1 XJ2015-gp2-株在RK-13细胞上的一步生长曲线,结果显示gp2基因缺失株较亲本株增殖能力有所下降,其毒价在病毒增殖的不同时间段均低于亲本株,表明gp2基因影响病毒在细胞与细胞之间的传播。虽然非必需糖蛋白功能的缺失不影响病毒DNA的复制,但是影响了病毒在细胞间的传播和病毒从细胞中释放出来的能力,导致病毒吸附到细胞上的效率低于野生型毒株,病毒出膜和释放时间也受到明显的推迟。因此gp2基因的缺失可间接影响病毒的增殖。
同源重组是构建重组病毒常用的策略之一,BAC和CRISPR/Cas9等技术是在此基础上的一些加工和修饰的方法,以提高重组效率[12]。本研究虽采用传统的同源重组方法,但将转移载体进行了线性化处理,能提高同源重组的效率;同时使用LipofectamineTM3000试剂转染,在转染后每12 h更换1次营养液,使细胞的生长处于良好状态,为重组病毒的拯救提供了良好的环境;通过筛选得到转移载体与病毒基因组的最佳转染比例,提高了转染和基因重组的效率。此外,本研究通过反向同源重组的方法去除了外源的EGFP基因,排除了机体产生针对外源蛋白的抗体的风险,提高了基因缺失疫苗的稳定性和安全性。
本研究将通过构建EHV-1 XJ2015 US4基因缺失毒株并分析其生物学特性,为我国研发EHV-1基因缺失减毒活疫苗奠定基础,为预防和控制该病原所引起的马属动物疫病提供有效方法。

