牛奶淀粉样蛋白A的原核表达及单克隆抗体制备
张正荣,郭晨瑶,陈诗胜,赵亚男,任建鸾,汤 芳,薛 峰*,戴建君,2
(1.南京农业大学 动物健康与食品安全国际合作实验室,江苏 南京210095;2.中国药科大学 药学院,江苏 南京 211198)
奶牛乳腺炎(bovine mastitis)又称为奶牛乳房炎,是一种影响奶牛健康的主要疾病,乳腺炎导致牛奶产量减少、治疗开支负担加重,严重时会导致奶牛被淘汰,对养殖业、乳品业造成巨大的经济损失[1-3]。乳腺炎通常通过诸如加利福尼亚乳腺炎测试(CMT)、对体细胞计数(SCC)的实验室分析或乳汁病原微生物检测法来诊断[4-5]。乳汁病原微生物检测法是目前对于奶牛乳房炎检测的“金标准”,缺点在于该方法较为复杂繁琐、耗时较长、成本较高,急需研究和开发更加灵敏可靠的奶牛乳腺炎预测生物标志物。目前,乳汁急性期蛋白、乳酶、乳成分等指标,以及血常规指标已经成为这方面的研究热点[6]。
急性期反应期蛋白(acute phase protein,APP)是在压力、外伤、感染或炎症等刺激激发动物机体产生的早期蛋白[7-8]。血清淀粉样蛋白A(SAA)是一种具有多种蛋白质种类的APP,主要在肝脏遭受急性刺激时产生,它的主要同种型为SAA1、SAA2和SAA3,其中SAA1和SAA2主要在肝脏中产生,而SAA3在肝外部位产生,且主要在牛奶中发现,被称为乳腺相关淀粉样蛋白A(M-SAA3)[9]。SAA和M-SAA3一起被称为牛奶淀粉样蛋白A(MAA),可在牛奶样品中进行测量。目前研究发现,在奶牛发生隐性乳腺炎期间,奶牛乳中MAA含量显著升高,牛奶中这种蛋白质的水平可作为奶牛乳腺炎感染的敏感指标[10-13]。目前对于奶牛中MAA的相关研究与检测较少,现有的成熟的检测方法只有ELISA法[14-15]。为了进一步深入研究奶牛乳腺炎检测技术以及MAA的免疫学功能,制备具有免疫原性的MAA蛋白以及单克隆抗体,对于开展后续研究具有重要意义。
本试验从NCBI上查阅MAA基因序列并进行密码子优化后合成质粒,以pET28a-SUMO作为载体构建pET-28a-SUMO-MAA重组表达质粒,转化至大肠杆菌BL21(DE3)感受态细胞,IPTG诱导表达,优化表达条件以获得最大量可溶性融合蛋白。利用SUMO酶切除SUMO标签获得具有完全反应原性的MAA蛋白。以纯化后的MAA蛋白免疫小鼠并制备单克隆抗体,通过ELISA测定其效价,Western blot测定抗体特异性,为后续MAA检测方法及奶牛乳腺炎的诊断研究奠定基础。
1 材料与方法
1.1 实验菌株、质粒pET28a-SUMO载体购自淼灵质粒平台;大肠杆菌DH5α、BL21(DE3)感受态菌株均购自北京百灵威科技有限公司。
1.2 试剂与仪器所有引物均由南京擎科生物科技有限公司合成;限制性核酸内切酶BamHⅠ、SacⅠ、Exnase连接酶均购自TaKaRa公司;2×Phanta®Max Master Mix以及2×Taq Master Mix 购自南京诺唯赞生物科技有限公司;His-1694、His-1683蛋白来自本实验室表达并保存;BSA购自南京鼎思生物技术有限公司;质粒提取试剂盒、琼脂糖凝胶回收试剂盒均购自美国OMEGA公司;SDS-PAGE蛋白预制胶购自金斯瑞生物科技有限公司;PageRuler蛋白预染Marker为赛默飞公司产品;SUMO酶购自通用生物系统(安徽)有限公司;SPF级BALB/c小鼠购自北京斯贝福生物技术有限公司;Protein A填料纯化试剂盒、BCA法蛋白质浓度测定试剂盒购自生工生物工程(上海)股份有限公司;Ni2+亲和层析柱、 AKTA pure蛋白纯化仪购自美国GE公司。
1.3 重组融合蛋白质粒的构建根据GenBank上的MAA基因序列(GenBank登录号:AF540564.1)由金斯瑞生物科技有限公司进行合成,片段大小为396 bp。根据pET28a-SUMO载体序列以及BamHⅠ、SacⅠ酶切位点设计引物,由南京擎科生物科技有限公司合成MAA鉴别引物以及同源臂引物(表1)。按照质粒提取试剂盒抽提pET28a-SUMO质粒并对其进行BamHⅠ、SacⅠ双酶切,回收载体大片段;使用同源臂引物、高保真酶PCR预混液扩增MAA序列后回收PCR产物。将2组分按照同源重组试剂盒说明加入Exnase重组酶37℃连接30 min,取10 μL连接产物转化大肠杆菌DH5α感受态细胞,利用含卡那霉素(50 mg/L)的LB琼脂糖平板筛选阳性克隆菌株,对阳性克隆菌株进行菌液PCR鉴定,选取PCR鉴定正确的克隆抽提质粒,BamHⅠ、SacⅠ双酶切鉴定后进一步测序验证。PCR扩增体系共50 μL:PCR预混液25 μL,上、下游引物各2 μL,模板2 μL,加ddH2O 19 μL。PCR反应条件:95℃ 预变性 5 min;95℃变性 30 s,55℃退火 30 s,72℃ 延伸 30 s,扩增30个循环;最后72℃延伸10 min。
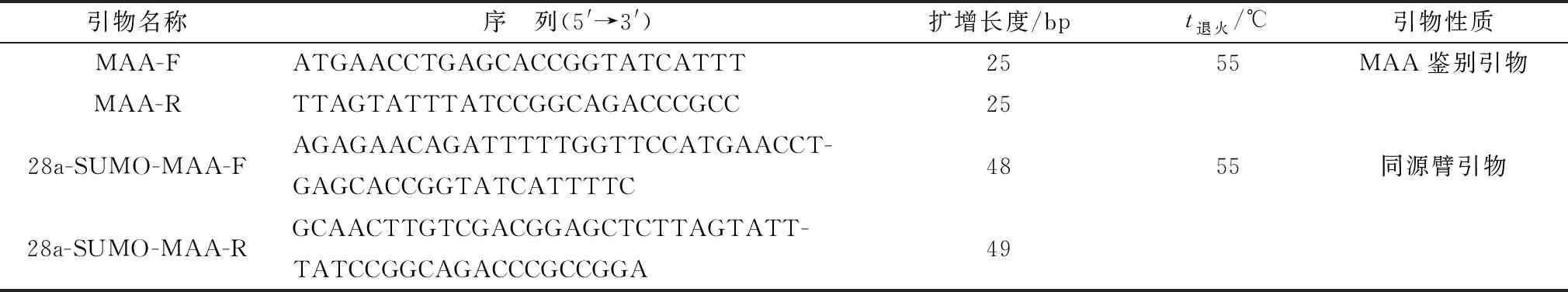
表1 引物序列及相关信息
1.4 重组表达菌株的制备及预表达将测序正确的pET28a-SUMO-MAA质粒转化至大肠杆菌BL21(DE3)感受态细胞,37℃培养至D600 nm为0.6~ 1.0,加入1.0 mmol/L的IPTG诱导表达8 h,诱导后的菌液8 000 r/min离心10 min,用PBS洗3次,重悬菌液后,提取蛋白,通过SDS-PAGE分析表达结果。
1.5 诱导条件的优化
1.5.1诱导温度的选择 制备等量表达菌液3管,37℃培养至D600 nm值0.6,加入1.0 mmol/L的IPTG后分别置于16,28,37℃诱导表达8 h,离心后以5 mL的PBS重悬,各自超声破碎后12 000 r/min离心30 min收集上清和沉淀,SDS-PAGE和Western blot分析不同温度下目的蛋白SUMO-MAA的表达情况,为制备可溶性表达的天然蛋白,选择上清表达量最大的诱导温度。
1.5.2诱导时间的选择 制备等量的表达菌液6管,37℃培养至D600 nm值0.6,加入1 mmol/L的IPTG后选择优化的温度诱导表达,分别诱导表达3,5,7,10,12 h,超声破碎后离心收集上清,SDS-PAGE分析不同诱导时间SUMO-MAA的可溶性表达情况。
1.5.3诱导剂IPTG浓度的选择 制备5管等量的表达菌液,37℃培养至D600 nm值0.6,分别加入0.3,0.5,0.8,1.0,2.0 mmol/L的IPTG诱导表达,选择优化后的温度以及最佳诱导时间,离心收集上清,SDS-PAGE分析目的融合蛋白的表达量。
1.6 MAA的大量表达与纯化
1.6.1SUMO-MAA的表达与纯化 按照优化后的条件培养表达菌液3 L,离心收集菌体,PBS洗3次后在上清Binding Buffer(20 mmol/L咪唑、20 mmol/LNa3PO4、0.5 mol/L NaCl、10%甘油、0.2% Tween-20)中重悬,超声破碎完全后离心收集上清,在1 mL镍离子亲和层析柱上利用AKTA pure蛋白纯化仪纯化目的蛋白。系统设置A液(20 mmol/L Na3PO4、0.5 mol/L NaCl、10%甘油、0.2% Tween-20)与B液(1 mol/L咪唑、20 mmol/L Na3PO4、0.5 mol/L NaCl、10%甘油、0.2% Tween-20)混合比例来设置梯度咪唑洗脱程序,对出峰位置进行SDS-PAGE分析以选择最佳的咪唑洗脱浓度。将收集到的SUMO-MAA融合蛋白透析,选择截留相对分子质量为7 kDa的透析袋,在PBS中4℃透析12 h,每3 h更换1次透析液,透析结束后以截留相对分子质量为3 kDa的超滤管浓缩,BCA法测蛋白浓度后保存。
1.6.2MAA蛋白纯化 以SUMO酶对SUMO-MAA进行酶切,每100 μg蛋白以5 U的SUMO酶于4℃酶切16 h。酶切后产物过镍柱并收集流出液进行SDS-PAGE分析,将收集到的MAA蛋白测浓度后于-40℃保存待用。
1.7 MAA单克隆抗体的制备将纯化后的重组蛋白与弗氏佐剂等体积混合至乳化状态,以皮下多点注射的方式免疫6周龄BALB/c雌鼠。免疫程序如表2所示。选择免疫性较好的小鼠脾脏细胞与小鼠骨髓瘤细胞Sp2/0进行融合筛选能够分泌单克隆抗体的融合细胞株。对8~10周龄BALB/c雌鼠腹腔注射融合细胞悬液,收集腹水,以Protein A亲和层析预装柱纯化抗体并采用间接ELISA法对其进行效价检测和特异性测定。
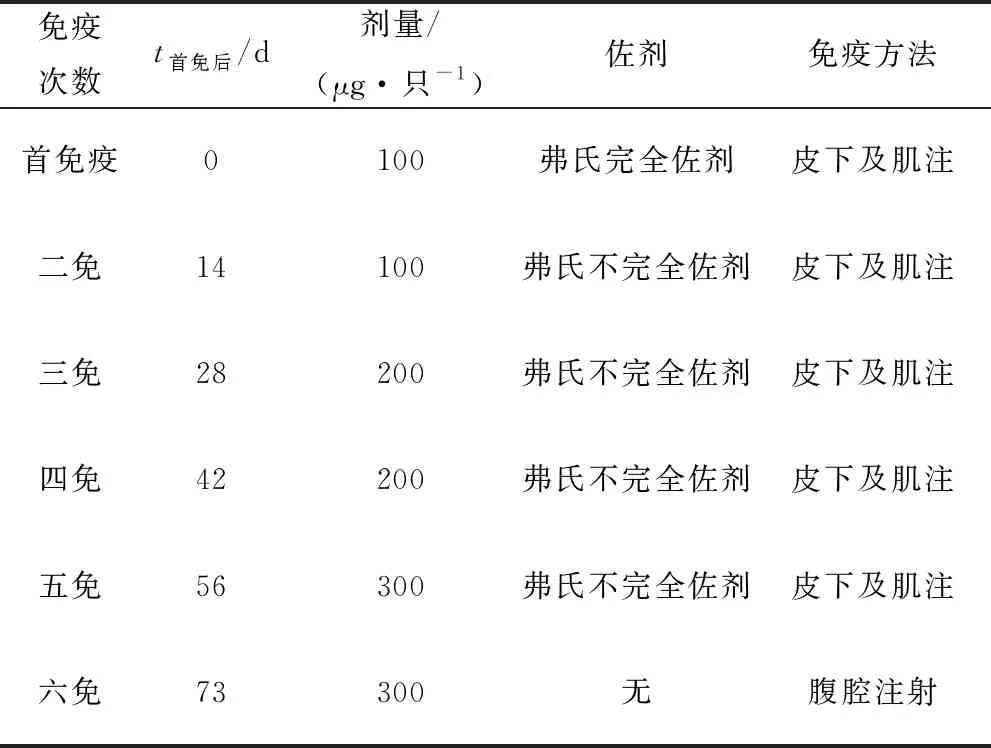
表2 免疫程序
2 结果
2.1 重组表达质粒的PCR及双酶切鉴定利用MAA特异性引物对pET28a-SUMO-MAA进行PCR鉴定,PCR扩增结果如图1A所示,目的片段大小396 bp与预期相符。图1B为重组质粒的双酶切鉴定,结果显示酶切后质粒由螺旋形变为线形,在396 bp出现目的基因条带,重组质粒测序结果显示目的基因连接成功并且与GenBank上的MAA基因序列同源性为100%,表明重组表达质粒构建成功。
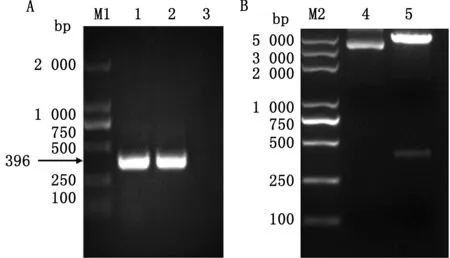
A.重组质粒的MAA基因PCR扩增结果;M1.DL2000 DNA Marker;1~2.MAA 基因PCR扩增产物;3.空白对照;B.重组质粒双酶切鉴定;M2.DL5000 DNA Marker;4.酶切前的重组质粒;5.酶切后的重组质粒
2.2 融合蛋白的诱导表达将测序正确的菌株经IPTG诱导后,与未诱导以及空载体进行SDS-PAGE对照分析,结果如图2所示,重组表达菌株pET28a-SUMO-MAA-BL21诱导后在35 kDa左右出现目的SUMO-MAA融合蛋白条带。未诱导的表达菌株同样在35 kDa处出现蛋白条带,说明在未诱导的菌株存在本底表达,由于炎症因子对菌体的毒性作用,蛋白表达量较少。空载体诱导前后和BL21产物在35 kDa均无目的条带。
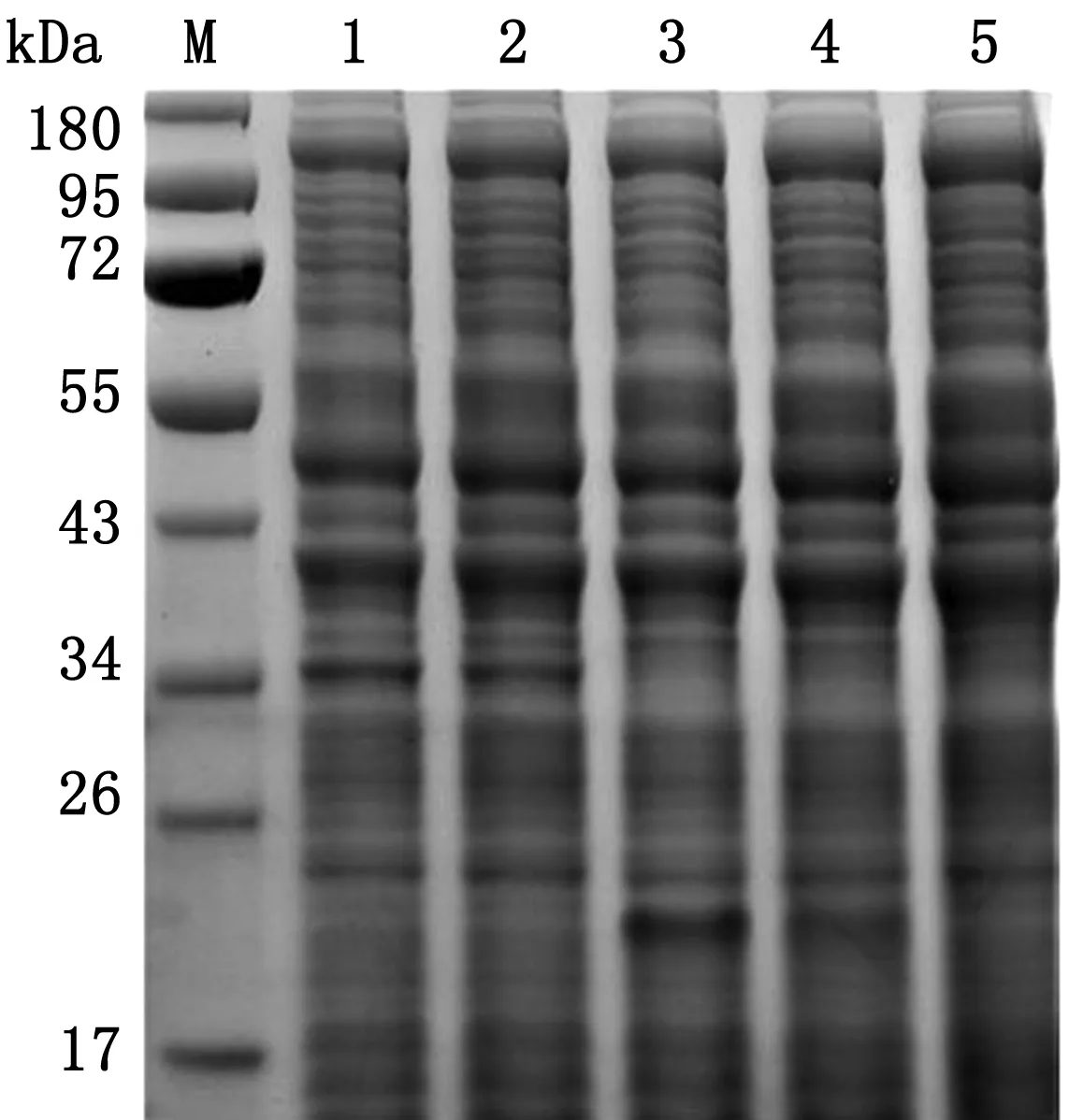
M.PageRuler蛋白质相对分子质量Marker;1.pET28a-SUMO-MAA诱导表达产物;2.pET28a-SUMO-MAA未诱导产物;3.pET28a-SUMO诱导表达产物;4.pET28a-SUMO未诱导产物;5.BL21产物
2.3 诱导条件的优化
2.3.1诱导温度的选择 研究表明,低温条件有利于大肠杆菌诱导表达重组融合蛋白,提高蛋白质稳定性,然而,诱导温度降低又极大限制了宿主菌的生长,导致蛋白质总体产量下降[16]。本试验选择3个常用表达温度16,28,37℃作为优化条件,如图3所示,SDS-PAGE结果显示在其他表达条件相同的情况下,融合蛋白在16℃上清表达量最多,Western blot显示相同结果,所以选择16℃为表达温度。
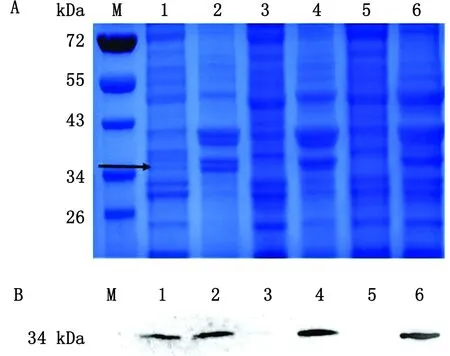
A.不同诱导温度下的SDS-PAGE结果;B.不同诱导温度下的Western blot结果;M.PageRuler蛋白质相对分子质量Marker;1.16℃诱导上清样品;2.16℃诱导沉淀样品;3.28℃诱导上清样品;4.28℃诱导沉淀样品;5.37℃诱导上清样品;6.37℃诱导沉淀样品
2.3.2诱导时间的选择 从图4可以看出,在其他诱导条件相同的情况下,诱导时间为7 h时融合蛋白的表达量相对最多,时间过长时蛋白表达量虽然增多,但由于MAA蛋白的毒性作用导致菌体裂解,相同体积菌液的蛋白量也相对减少,所以最终选择7 h为最佳诱导时间。
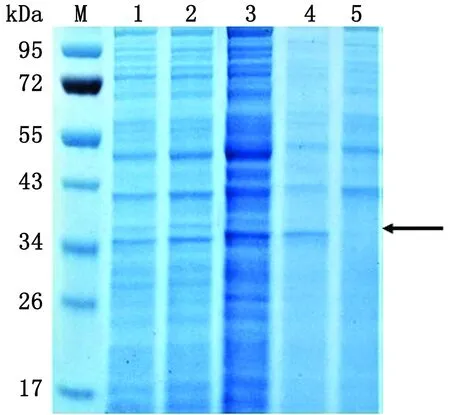
M.PageRuler蛋白质相对分子质量Marker;1~5.分别是3,5,7,10,12 h诱导时间下融合蛋白的表达产物
2.3.3诱导剂IPTG浓度选择 IPTG作为乳糖类似物,在诱导蛋白表达的同时也会对菌体带有毒性作用[17]。根据蛋白的相对表达量、稳定性以及SDS-PAGE结果,最终选择0.5 mmol/L的IPTG(图5)。
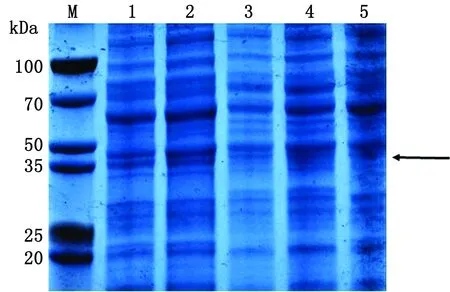
M.PageRuler蛋白质相对分子质量Marker;1~5.分别为0.3,0.5,0.7,1.0,2.0 mmol/L IPTG诱导下的蛋白表达
2.4 MAA蛋白的纯化
2.4.1SUMO-MAA融合蛋白纯化 通过镍柱以及AKTA pure蛋白纯化仪对融合蛋白进行纯化,从蛋白纯化仪峰图(图6A)以及出峰位置洗脱液的SDS-PAGE(图6B)分析可以看出,在咪唑浓度高于0.30 mol/L便可洗出目的蛋白,所以将washing buffer及elution buffer的咪唑浓度分别设置为0.20,0.50 mol/L。分别收集蛋白原液、蛋白样品流出液、washing buffer流出液、elution buffer蛋白洗脱液进行SDS-PAGE分析,结果如图6C所示,样品流出液里基本不存在目的蛋白,说明融合蛋白已大部分结合在镍柱上;washing buffer流出液也基本未出现目的蛋白条带,而蛋白洗脱液出现明显目的蛋白条带,说明所选择的washing buffer与elution buffer比较合适。
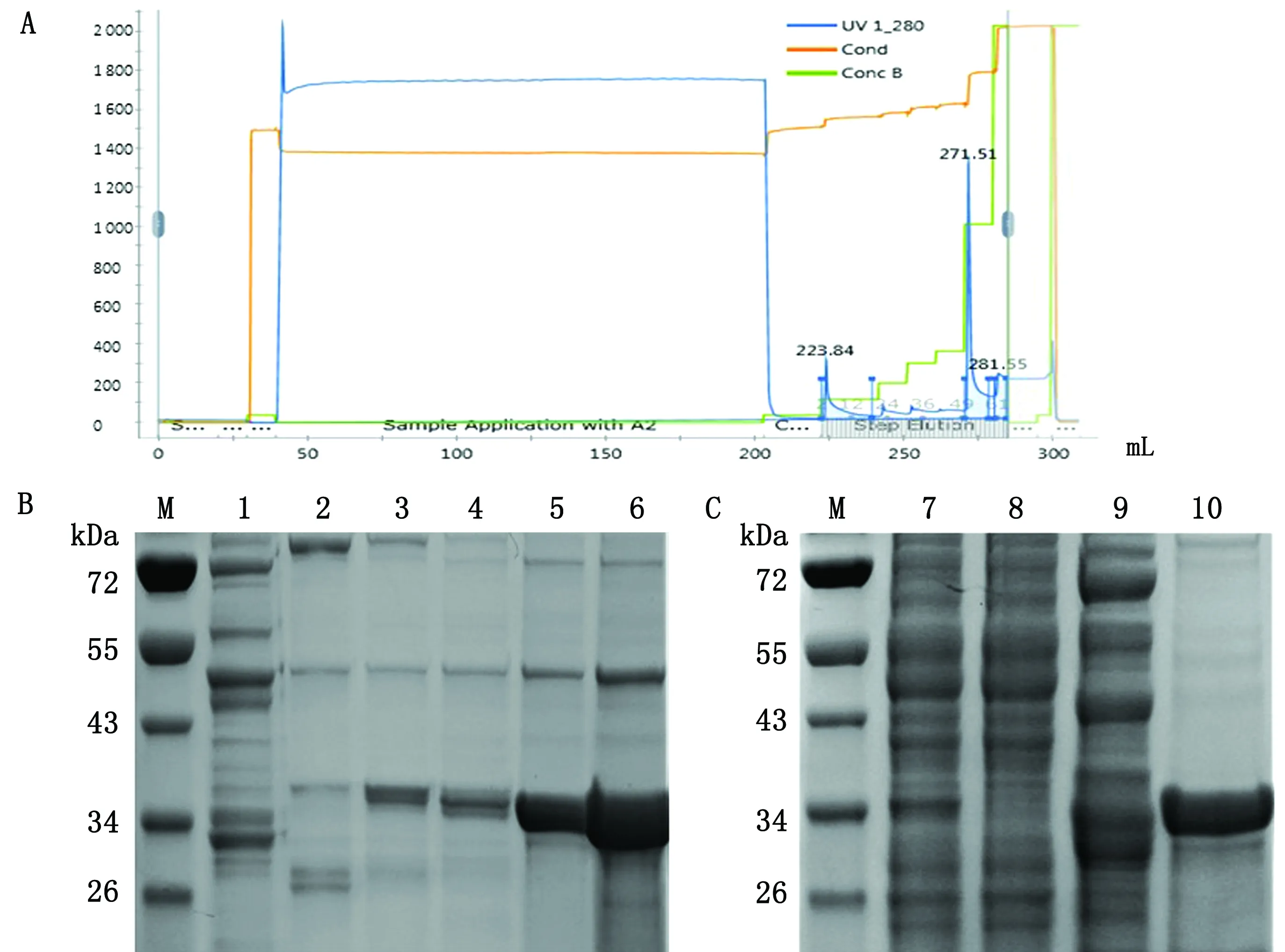
A.不同浓度咪唑蛋白洗脱液洗脱的蛋白峰图;B.不同浓度咪唑蛋白洗脱液洗脱的蛋白SDS-PAGE结果;M.PageRuler 蛋白Marker;1~6.分别为0.15,0.20,0.30,0.40,0.45,0.50 mmol/L咪唑蛋白洗脱液流出产物;C.融合蛋白纯化情况;7.纯化前蛋白样品;8.样品流出液;9.washing buffer流出液;10.蛋白洗脱液
2.4.2融合蛋白的酶切及纯化 将得到的融合蛋白经SUMO酶切后过镍柱再次纯化,带有His标签的SUMO蛋白以及SUMO酶与镍柱结合,无His标签的MAA蛋白流出镍柱。将酶切前后的样品和过镍柱后的样品进行SDS-PAGE分析,结果如图7所示,酶切后的蛋白液过镍柱后其流出液中基本只含有17 kDa的MAA蛋白,纯度达90%以上。
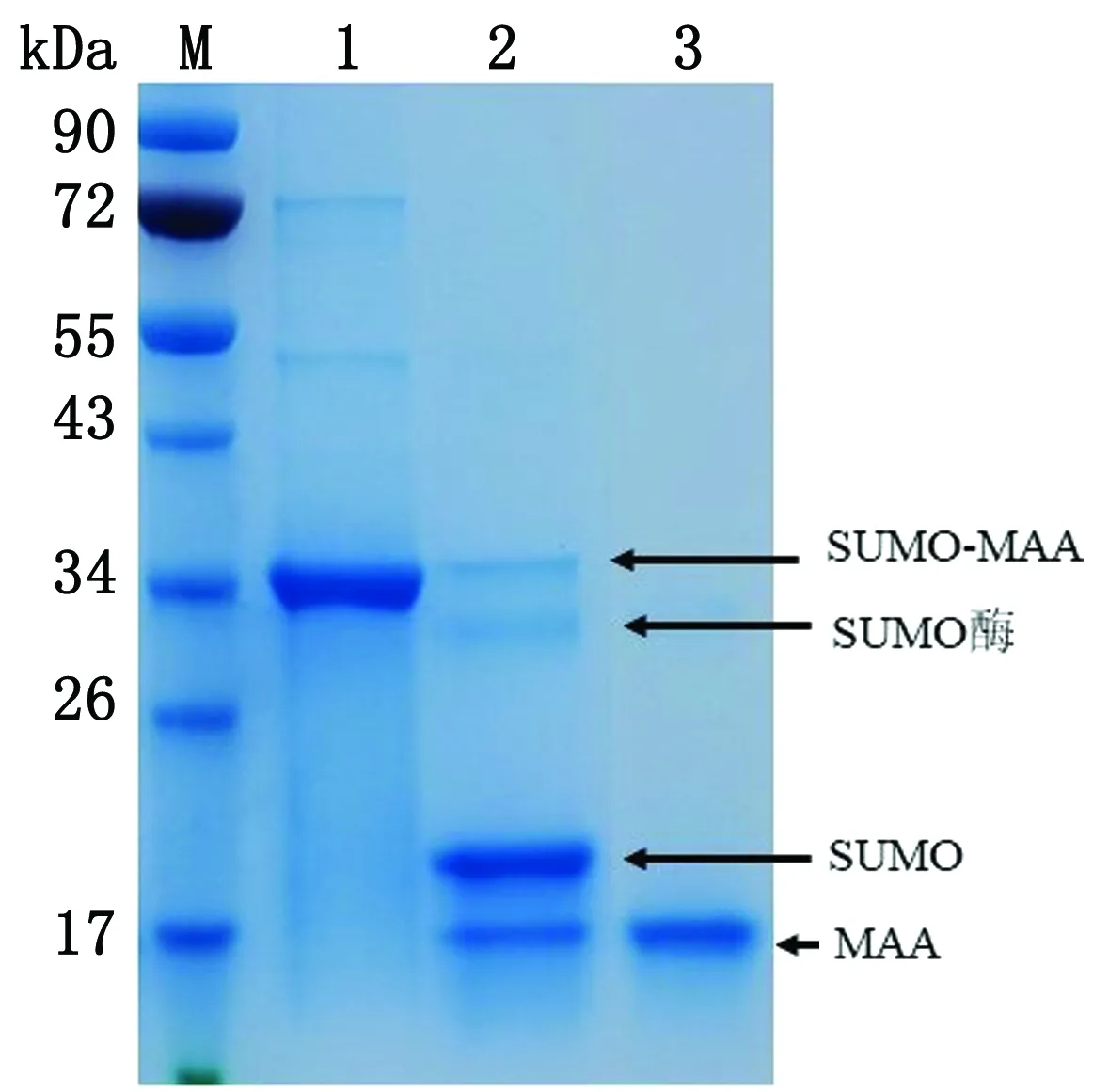
M.PageRuler蛋白质相对分子质量Marker;1.酶切前样品;2.酶切后样品;3.过镍柱纯化后样品
2.5 MAA单克隆单体的制备
2.5.1单克隆抗体的纯化 结果共筛选到了2株分泌单克隆抗体的融合细胞株,命名为3G11、8E10。Protein A纯化腹水后SDS-PAGE分析,如图8所示,纯化后蛋白胶上出现2条带,分别为单克隆抗体的轻链和重链。间接ELISA法测得效价分别为1∶25 600和1∶51 200,表明单克隆抗体制备成功。
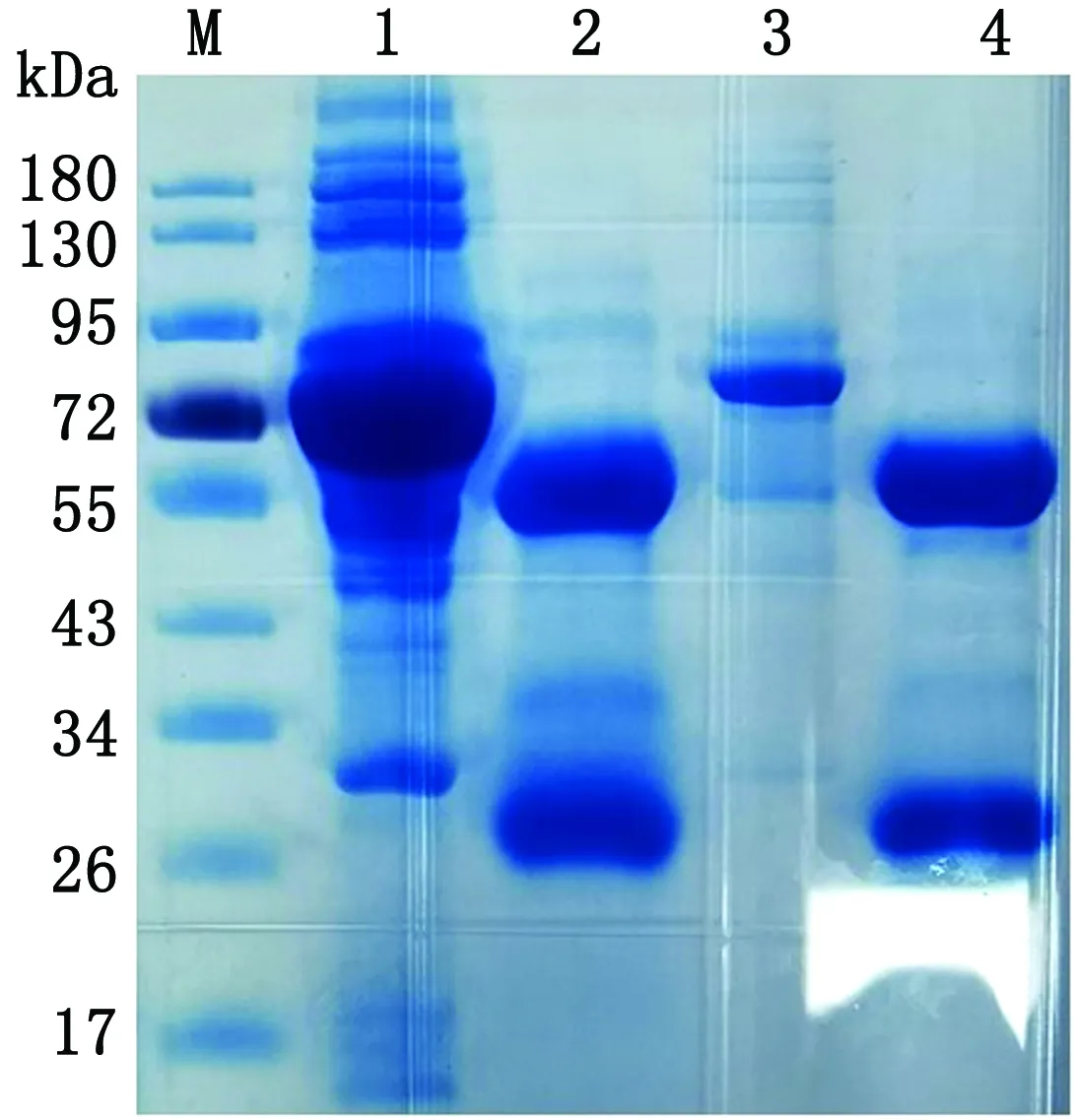
M.PageRuler蛋白质相对分子质量Marker;1.3G11纯化前;2.3G11纯化后;3.8E10纯化前;4.8E10纯化后
2.5.2单克隆抗体特异性测定 分别以相同浓度的MAA、BSA以及His-1694、His-1683为包被抗原,ELISA测定结果如图9所示,抗体3G11与8E10与MAA反应的D450 nm值均达0.9以上,而与其他干扰蛋白均小于0.4,证明抗体特异性较好。
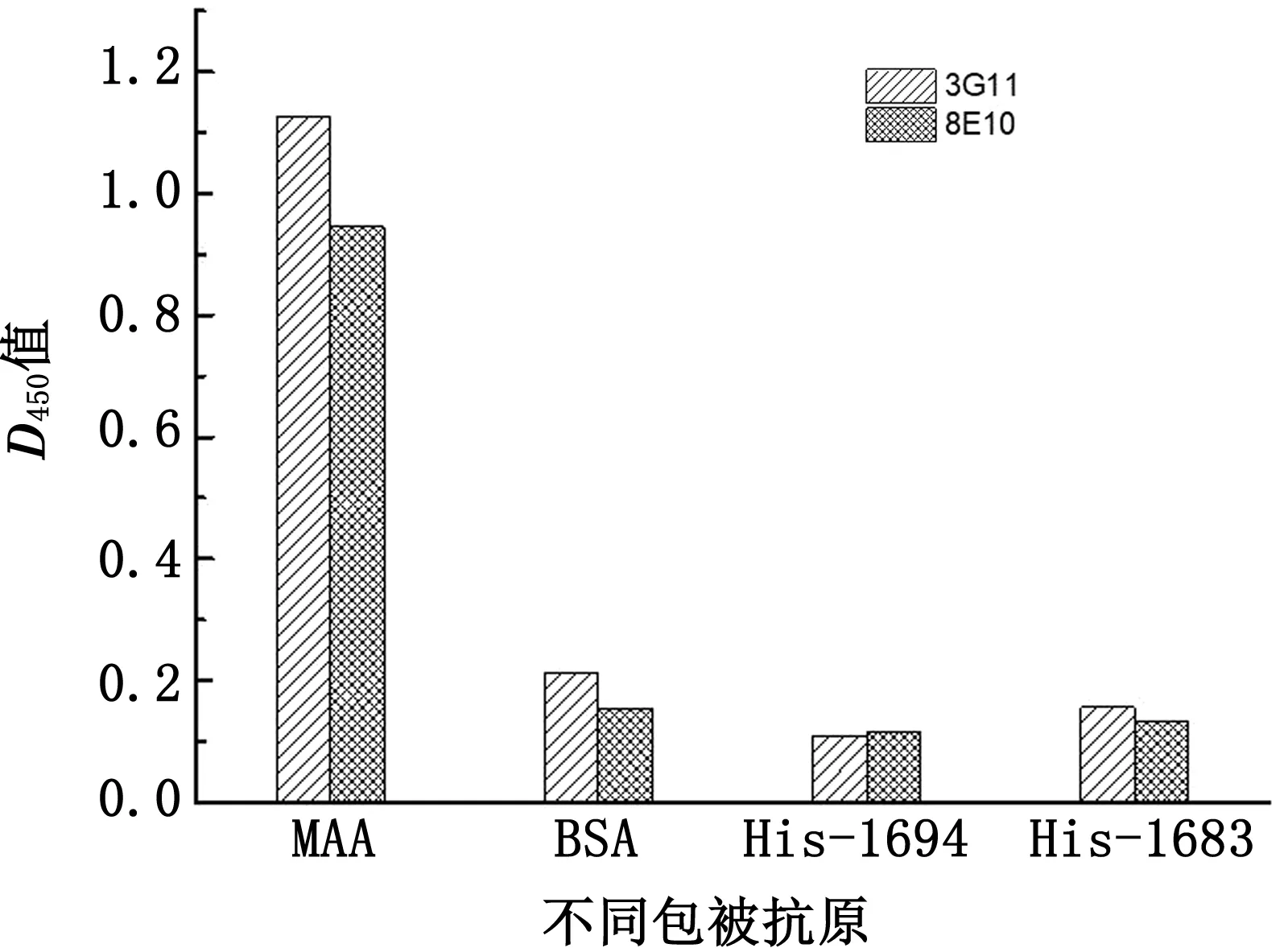
图9 2株单克隆抗体特异性测定结果
3 讨论
乳业参与者都深知奶牛乳腺炎所带来的经济损失和对牛奶质量的负面影响,因此尽早地发现乳腺炎是现存检测方法面临的挑战。目前存在几种乳腺炎指示标志包括体细胞数(SCC)、酶活性、电导率以及pH,一些研究还发现SCC受多种因素影响包括动物压力、营养、泌乳阶段、胎次和所采样牛奶的质量[19]。其他方法大多存在不稳定性和对低SCC敏感度低等缺点,并且温度、环境等能很大程度上影响酶活性。牛奶血清淀粉样蛋白A(MAA)在炎症阶段明显升高,能够有效指示隐性奶牛乳腺炎且不受其他条件的影响。MAA作为奶牛乳腺炎生物标志物已得到证实,早在2001年研究发现MAA对于区分健康奶牛和乳腺炎奶牛有重要价值,在牛奶中的敏感性和特异性分别为93%和100%[18-19]。MAA在人类医院临床诊断方面已达成熟,但对于奶牛方面的研究较少,为了进一步深入研究MAA的机理、检测方法等,获得天然活性蛋白及其单克隆抗体具有重要意义。
本研究使用目前应用最广的大肠杆菌原核表达系统对MAA进行表达。SUMO化修饰可以保持融合蛋白基因的稳定性,使多肽正常折叠,能够促使融合蛋白可溶性表达[20],同时SUMO 酶可以高效地将SUMO从融合蛋白上切除[21],因此,我们在构建重组表达质粒的时候引入SUMO基因获得可溶性融合蛋白,再利用SUMO酶切除制得天然型MAA蛋白。在对融合蛋白表达温度、诱导时间、IPTG浓度进行优化后进行大量表达,利用镍亲和层析柱获得纯度高、均一性好的MAA蛋白。同时将制备的MAA蛋白注射小鼠,通过细胞融合、亚克隆筛选、扩增培养获得2株分泌单克隆抗体的杂交瘤细胞株,小鼠腹腔注射杂交瘤细胞后收集腹水,经Protein A柱纯化获得单克隆抗体。
本研究成功表达了高纯度、高均一性的MAA蛋白以及高敏感性和特异性的单克隆抗体,MAA单克隆抗体的成功制备能够有效促进基于单克隆抗体的诊断技术研发,例如免疫荧光法、免疫阻抗、胶体金免疫层析等。在后续的研究中将探索基于MAA蛋白及其单克隆抗体的奶牛乳腺炎检测系统以期实现对奶牛乳腺炎及时准确地检测。

