永生化犬骨髓间充质干细胞株的建立
陈奕静,戴鹏秀,张露文,李佳锴,张翊华
(西北农林科技大学 动物医学院,陕西 杨陵 712100)
近年来,越来越多的家庭开始重视宠物的健康,虽然现代宠物医疗有了很大的提高,但仍有许多严重的疾病不能通过临床治疗手段解决。干细胞疗法是临床实践中的创新,间充质干细胞(MSCs)位于受损部位,分化为组织特有的细胞,并有助于组织修复[1]。利用骨髓间充质干细胞(BMSCs)进行临床疾病治疗是具有广阔前景的研究领域[2]。与其他干细胞的不同之处在于,它们不仅可分化为相同的中胚层谱系,如骨骼、软骨和脂肪细胞,而且还可分化为其他外胚层和内胚层谱系[3],因此,BMSCs是成体干细胞的独特类型。
BMSCs具有多向分化潜能、免疫原性及归巢能力,并且取材较为方便,动物骨髓可再生,因此是组织工程种子细胞的首要选择[4]。但BMSCs在骨髓中含量非常有限,体外培养周期短,如果不能尽快使用成功分离的BMSCs,待其传过多代后,各项性能将会明显下降,无法进行下一步研究和应用[5]。建立永生化细胞株可以使体外培养的细胞无限繁殖并且细胞间不存在差异。自发性永生化几率十分小,可利用基因转染等技术提高永生化的发生率,以此来建立永生化细胞株。因此,本试验将构建好的pLOX-Ttag-iresTK慢病毒载体包装后感染犬cBMSCs,连续培养传至50代,并通过细胞形态观察、细胞计数、RT-qPCR基因表达分析、Western blot以及流式和三系分化鉴定,建立永生化犬骨髓间充质干细胞(cBMSCs),为临床疾病治疗研究提供材料。
1 材料与方法
1.1 主要试剂和试验材料质粒pLOX-Ttag-iresTK、pLP/PsPAX、pLP/VSVG(Addgene公司);Stbl3感受态细胞(北京华越洋生物科技有限公司);293T细胞和cBMSCs由西北农林科技大学动物医学院外科实验室保存[6];无内毒素质粒提取试剂盒、2×Maxima SYBR Green/ROX qPCR Master Mix(杭州博日科技有限公司);TaKaRa MiniBEST Universal RNA Extraction Kit(TaKaRa,Japan);BOSTER Western blot检测试剂盒(博士德生物工程有限公司);Asvanced Transfection Reagent、胎牛血清(FBS)(ZETA LIFE,USA)、α-MEM培养基、DMEM培养基(Hyclone,USA);犬骨髓间充质干细胞成脂诱导分化完全培养液、成骨诱导培养液、软骨诱导完全培养液(赛业生物科技有限公司)。
1.2 cBMSCs的复苏与培养传代使用α-MEM培养基复苏实验室冻存的第3代cBMSCs,于37℃、5% CO2培养箱中进行培养。待其长至80%~90%融合时,用胰酶消化,待90%的细胞变圆时吸出胰酶,加入2 mL α-MEM完全培养基(含10% FBS),吹打细胞后按1∶2传代,十字形晃动培养皿使细胞均匀分布,平均3 d传1代。
1.3 包装携带SV40基因的慢病毒分别将包装质粒pLP/PsPAX、pLP/VSVG和质粒pLOX-Ttag-iresTK转化至Stbl3感受态细胞中,将菌液涂布在LB培养基(含100 mg/L 卡那霉素)上,37℃培养箱中倒置平板过夜培养。待质粒扩增后,用天根试剂盒提取质粒。以1×106个/mL的密度将293T细胞接种至60 mm培养皿中,加入含10% FBS的DMEM培养液,37℃、5% CO2条件下培养24 h。待细胞融合至60%左右时,将包装质粒pLP/PsPAX 2.8 μg、pLP/VSVG 2.0 μg和质粒pLOX-Ttag-iresTK 1.8 μg与10.0 μL转染试剂Asvanced Transfection Reagent混合,混匀后静置10 min,逐滴将转染复合物加至培养皿中。24 h后,换入新鲜培养基,继续培养48 h后,收集细胞上清并进行滴度测定。
1.4 永生化cBMSCs株的构建cBMSCs融合度达到60%时,将收集的慢病毒上清液和α-MEM培养液按照1∶1的体积比例换至cBMSCs进行转染;8 h 后吸出液体加入3 mL α-MEM培养液,48 h使用4 mg/L的嘌呤霉素进行筛选,将稳定转染的cBMSCs传代,用α-MEM(含10% FBS)进行培养,37℃、5%CO2条件下,连续传超过50代后,即可得到永生化的cBMSCs株。
1.5 永生化cBMSCs株的鉴定
1.5.1细胞生长曲线和群体倍增时间的测定 在相差显微镜下观察永生化cBMSCs的形态变化,并与未经转染的cBMSCs进行比较。取第50代永生化cBMSCs和未经转染的野生cBMSCs,以0.5×104个/孔的细胞密度接种于24孔培养板,每天取3孔进行细胞计数,取所得到的平均值记作当天的细胞数,连续计数7 d,绘制其生长曲线。cBMSCs的群体倍增时间(PDT)根据公式PDT=T×[lg2/(lgNt-lgN0)]估算。N0为接种细胞数,Nt为培养后的细胞数,T为培养时间,以h为单位。
1.5.2野生型和永生化第50代cBMSCs SV40的表达检测 人工设计并合成1对片段大小为386 bp的特异性检测引物(F:5′-TGACCTCCATAGAA-GACACCG-3′;R:5′-CAAATACCTCAGTTGCA-TCCC-3′)。按照TaKaRa MiniBEST Universal RNA Extraction Kit说明书对第50代永生化cBMSCs和未经转染的野生cBMSCs进行总RNA的提取,将mRNA反转录为cDNA。按照Maxima SYBR Green/ROX qPCR Master Mix说明书配置反应体系进行基因表达检测。每个样本基因检测3个复孔,数据采用2-△△Ct法进行分析。用细胞裂解法提取野生型和永生化第50代的cBMSCs细胞内总蛋白,BCA法鉴定蛋白浓度。按照BOSTER Western blot检测试剂盒说明书对SV40T进行Western blot检测,内参蛋白为GAPDH。
1.5.3永生化cBMSCs的分化潜能及表面标志鉴定 将第50代永生化cBMSCs按1×104个/cm2密度接种于24孔培养板中,待融合至80%左右用成脂、成骨、成软骨分化试剂盒进行诱导分化。诱导完成后分别使用油红O染色液、茜素红染液和阿利辛蓝染液对细胞进行染色,显微镜下观察染色结果。将第50代永生化cBMSCs重悬,计算调整细胞密度,制成2×106个/mL的细胞悬液,取流式细胞仪专用管11个,分别加入100 μL细胞悬液,随后分别加入FITC标记的CD105、CD14、CD166、CD29、CD44、CD45,PE标记的CD90、CD11、CD34抗体以及对照抗体各5 μL,避光孵育15 min,流式细胞仪检测细胞表面分子标记物。
2 结果
2.1 细胞形态观察相差显微镜观察发现,cBMSCs呈长梭状,少数为多角形,贴壁生长。野生型在第10代时细胞形态明显发生变化,生长缓慢,同期永生化细胞状态良好,生长速度较快。永生化在第50代时细胞活力仍较高,与原代细胞形态无明显差异,呈旋涡状排列(图1)。
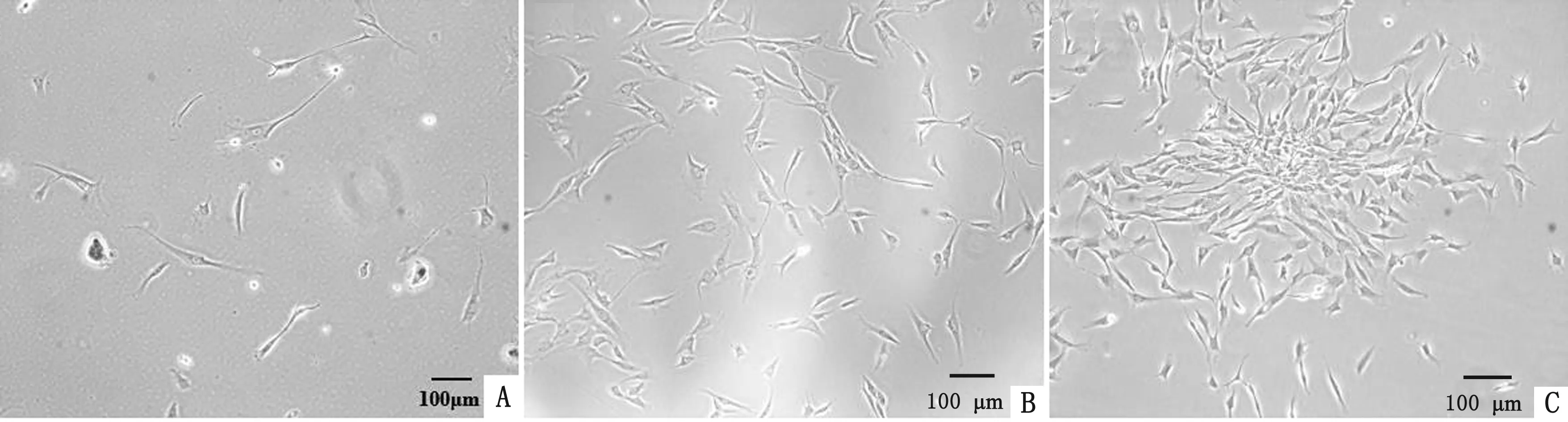
A.野生型第10代;B.永生化第10代;C.永生化第50代
2.2 细胞生长曲线测定对永生化第50代及野生型cBMSCs进行细胞计数并绘制生长曲线,结果如图2所示。2种细胞在培养过程中,均持续增殖呈“S”型状态,且成功转染SV40的永生化cBMSCs相对于野生型细胞潜伏期缩短,增殖较快且数量较多。永生化cBMSCs的群体倍增时间约为0.68 d,野生型cBMSCs的群体倍增时间约为0.97 d。

图2 永生化cBMSCs第50代与野生型cBMSCs的生长曲线
2.3 野生型和永生化第50代cBMSCs SV40的RT-qPCR检测和蛋白鉴定由图3可见,永生化cBMSCs中SV40的mRNA表达水平较野生型极显著升高(P<0.001)。使用GAPDH作为蛋白质标准化内参,对已经转染SV40的cBMSCs进行蛋白质免疫印迹测定,结果显示永生化cBMSCs成功表达SV40T抗原。
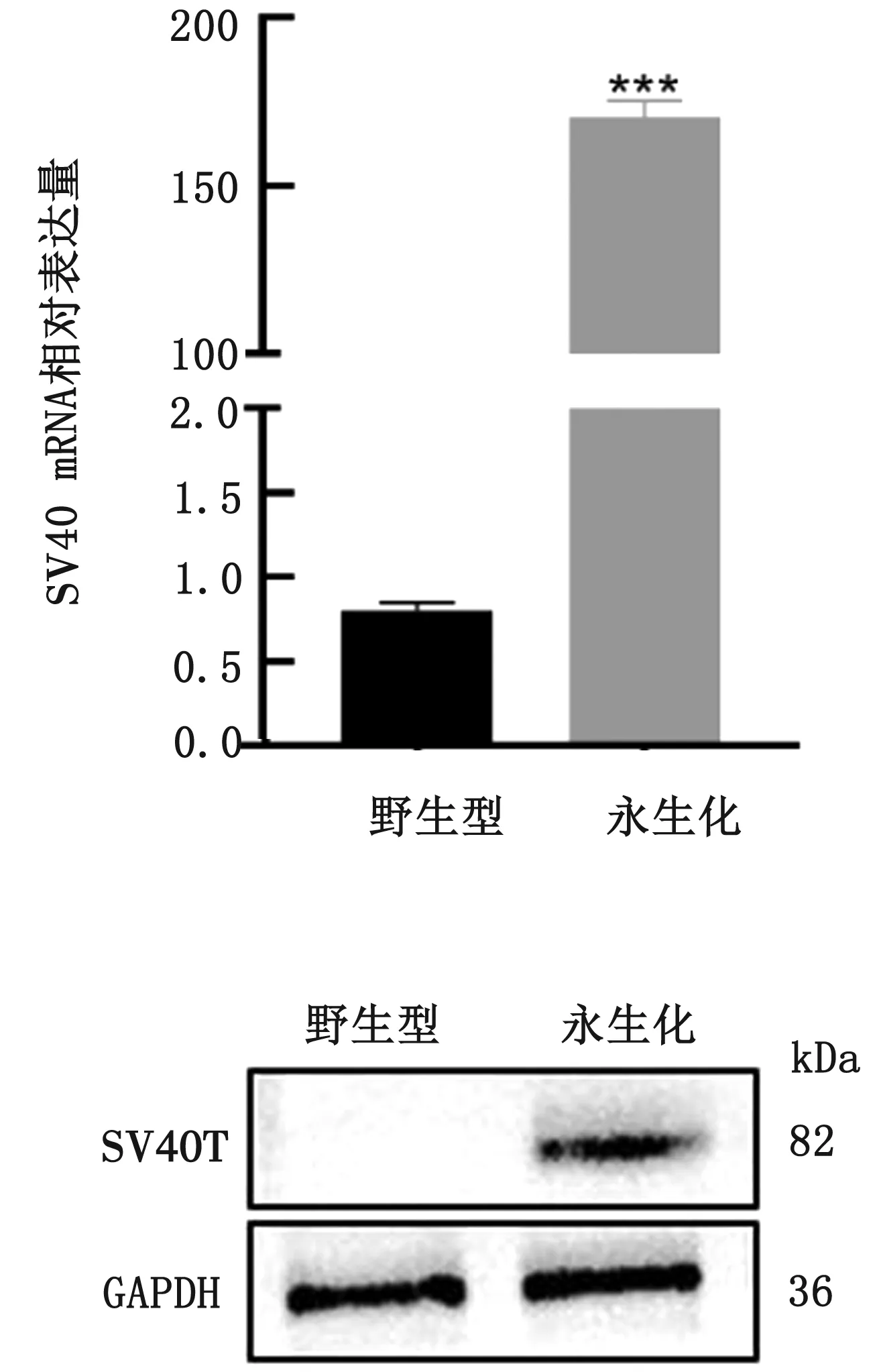
图3 永生化与野生型cBMSCs SV40 RT-qPCR(A)和Western blot结果(B)
2.4 永生化cBMSCs流式细胞术检测流式检测结果如图4所示,细胞表面分子CD105(97.0%)、CD90(93.4%)、CD166(98.8%)、CD29(92.2%)和CD44(93.6%)为阳性表达,而CD11(1.4%)、CD14(0.4%)、CD34(1.0%)和CD45(1.2%)为阴性表达。
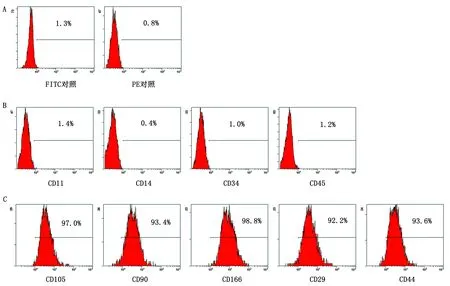
A.空白对照组;B.阴性表面分子;C.阳性表面分子
2.5 永生化cBMSCs三系分化永生化cBMSCs经成骨诱导后,可发现细胞形态发生变化,细胞变长或呈多边形伸展,茜素红染色可见橘红色钙化结节;经成软骨诱导后,细胞体积变大呈多边形,阿尔新蓝将软骨相关蛋白染成蓝色;经成脂肪细胞诱导培养7 d后,细胞变短,细胞质内出现脂滴,油红O染液将胞内脂滴染成红色(图5)。

A.cBMSCs成骨诱导后茜素红染色;B.cBMSCs成软骨诱导后阿尔新蓝染色;C.cBMSCs成脂肪诱导后油红O染色
3 讨论
BMSCs可从成体骨髓获取并非必须来自胚胎,因其来源广泛,易于获取,并且不涉及道德伦理问题,相较于其他干细胞有明显优势。因其免疫调节能力的独特性,有助于抑制移植后的排斥反应,所以BMSCs被认为是组织工程和再生医学的理想候选者。BMSCs在骨髓中含量非常有限,体外培养周期短,常因复制衰老而死亡限制了它们的试验和临床研究[7]。因此,永生化BMSCs的建立对于这些细胞的应用十分有利。
除了自发性永生化,常用病毒转染、端粒酶活化和癌基因转染等方法促使永生化[8]。人乳头瘤病毒和EB病毒易诱发细胞恶性转化,原癌细胞永生化操作困难,因此最常用的永生化基因是SV40和端粒酶逆转录酶。SV40T抗原影响细胞周期检查点,防止细胞凋亡衰老,并促使细胞增殖[9]。单独转染SV40不足以诱导哺乳动物细胞肿瘤的发生[10]。
程斌等[11]将含有SV40基因的真核表达载体导入BMSCs中,发现试验组细胞的生长速率明显高于对照组,且未发现成瘤性。AYALA-CUELLAR等[12]用SV40逆转录病毒转染ASCs使其永生化,与原始ASCs相比具有更高的集落形成潜能,并且群体倍增时间减少。ZHANG等[13]将SV40导入前软骨细胞后,发现细胞随着培养时间的延长,数量增加但端粒酶长度未明显缩短,证明SV40能够避免细胞凋亡。
我们成功通过转染SV40构建了cBMSCs永生化细胞株。通过细胞形态和生长曲线的观察,野生型cBMSCs在传代培养至第10代后有衰老死亡的迹象,细胞倍增时间明显延长,增殖速度显著下降,胞体形状也出现变化,多角及不规则形比例变大。与野生型cBMSCs相比,永生化的cBMSCs具有更高的生长速率,保持“长梭状”的细胞形态,并形成单克隆细胞群,传至50代后细胞仍然生长良好,同他人培养传代的细胞形态和生长曲线走向相似[14-15],证明了永生化cBMSCs具有更好的增殖能力。RT-qPCR和Western blot结果表明本次试验确定已将SV40转入cBMSCs并成功表达。
目前,BMSCs的特异性表面标记物还未确定,但根据以往长期研究发现,相对稳定的BMSCs高表达表面抗原标记包括CD105、CD29、CD44、CD106、CD166、CD90等,基本上不表达HLA-Ⅱ类抗原以及其刺激分子,如CD40、CD80、CD86、CD45、CD14、CD34、CD38,亦不表达CD11a、LFA-1等淋巴细胞表面抗原和造血干细胞标记分子[16]。CD44是参与细胞迁移和血管生成的透明质受体[17-18],而且它似乎与CD90在维持干性状态方面也有功能上的关联。CD45是一种跨膜蛋白酪氨酸磷酸酶,在T细胞和B细胞中作为抗原受体信号的关键调节因子,其在造血谱系的所有发育阶段高表达[12]。本试验对永生化第50代cBMSCs表面标志物进行分析,结果显示,细胞表达CD105、CD90、CD166、CD29、CD44,几乎不表达 CD11、CD14、CD34、CD45,与文献报道一致,表明构建的永生化细胞符合BMSCs的生物学特性。
据报道,BMSCs具有自我更新及多向分化能力,可在特定的体内外微环境下,分化为不同的组织细胞,如成骨细胞、软骨细胞、髓基质、神经元细胞、脂肪细胞、胰腺细胞、星形胶质细胞、血管内皮细胞、心肌细胞等[19]。与ASCs相比,其具有更高的成骨成软骨分化能力[20]。我们测试了永生化cBMSCs在分化成骨、成软骨、成脂肪方面的多能性,最终在各染色镜检所得图像中发现各分化方向的特异性染色标志,说明本次所得永生化cBMSCs细胞株是具有多向分化能力的细胞株。同其他相似试验所得诱导分化染色图像对比,染色标志的呈现大同小异[21],进一步确定得到的永生化cBMSCs具有分化潜能。
本研究通过转染SV40建立稳定的永生化细胞株,具有与原代细胞相似的特性,达到了使体外培养的BMSCs具有无限增殖能力且细胞间无差异的目的,并且可以成为进一步研究细胞信号并了解其性质的有效模型,帮助我们了解骨髓间充质干细胞增殖与衰老的分子机制,为研究疾病治疗如控制肿瘤细胞增殖及器官移植等奠定基础。

