鞣花酸通过内质网应激和线粒体损伤途径促进人宫颈癌细胞凋亡
周 瑶,李 晶
(1. 湖北科技学院药学院,湖北 咸宁 437100; 2. 湖州师范学院医学院,浙江 湖州 313000)
宫颈癌是全球女性中第四大常见癌症[1],也是很多国家女性肿瘤患者死亡的第三大原因。目前宫颈癌的治疗手段包括手术、放疗和化疗,效果有限,复发率高,各种副作用大。据报道,鞣花酸是一种多酚类物质[2],是没食子酸的二聚体衍生物,具有反式没食子酸的单宁结构,具有各种活性,包括抗炎、抗氧化、抗病毒和抗癌活性[3],但鞣花酸对宫颈癌细胞的杀伤作用及其机制目前报道尚少。我们推测鞣花酸可抑制人宫颈癌细胞探讨鞣花酸对宫颈癌细胞的作用及分子机制,探索新的潜在治疗方法对于加强宫颈癌的防治具有十分重要的意义。
1 材料与方法
1.1 材料
1.1.1试剂 GRP78(#3177)、CHOP(#2895)、PERK(#5683)、pPERK(#3179)、Bcl-2(#15071)、Bax(#5023)、cleaved caspase-3(#9661)、β-actin(#3700)抗体购自美国CST公司;IRE1(ab37073)、p-IRE1(ab124945)抗体购自美国Abcam公司;鞣花酸(#E2250)购自美国Sigma公司;DMEM培养基,购自美国HyClone公司;BCA蛋白定量试剂盒,购自VazymE公司。
1.1.2仪器 凝胶成像系统(上海嘉鹏科技有限公司);电泳槽、电转膜仪(伯乐生命医学产品有限公司);多功能酶标仪(北京楠华科技开发有限公司);超净工作台(吴江市伟峰净化设备有限公司);恒温空气浴摇床(上海晶坛仪器制造有限公司);细胞CO2培养箱(Thermo公司);CKX41倒置相差显微镜(日本OLYMPUS公司)。
1.2 方法
1.2.1鞣花酸的配制 用DMSO溶解鞣花酸,使其达到100 mmol·L-1作为母液,用DMEM稀释成工作液,涡旋混匀后使用。
1.2.2细胞培养 Hela细胞株购自中国科学院上海细胞库(中国上海)。细胞是在Dulbecco改良的Eagle培养基(Invitrogen)中添加10%胎牛血清、100 kU·L-1青霉素和100 g·L-1链霉素培养于37 ℃、5% CO2的湿化培养箱中。
1.2.3实验分组 1)MTT实验分组:①鞣花酸浓度梯度: control组(空白对照组加入同等体积的PBS)、鞣花酸(1、5、30、100 μmol·L-1)刺激24 h组。②鞣花酸时间梯度: control组(空白对照组加入同等体积的PBS)、鞣花酸(30 μmol·L-1)刺激0、12、24、48 h组。
2)流式细胞及荧光显微镜检测:control组(同等体积的PBS)、鞣花酸(1、5、30、100 μmol·L-1)刺激24 h组。
3)免疫印迹法:①鞣花酸浓度梯度: control组(同等体积的PBS)、鞣花酸(1、5、30、100 μmol·L-1)刺激24 h组。②抑制剂干扰试验: control组(同等体积的PBS)、鞣花酸(30 μmol·L-1)刺激24 h组、鞣花酸 30 μmol·L-1+4-phenylbutyric acid(4-PBA)20 μmol·L-1组。
1.2.4MTT检测细胞增殖 采用MTT法测定鞣花酸对Hela细胞生存率的影响。在96孔板中培养1×104个细胞,在37 ℃条件下用不同浓度的鞣花酸刺激细胞24 h;另一组实验中,用10 μmol·L-1鞣花酸刺激细胞0、12、24、48 h。然后,取出培养基,加入MTT,37 ℃下孵育4 h,加入150 μL DMSO,在570 nm处用micro-plate reader(Thermo Fisher Scientific, Inc.)读取吸光度。
1.2.5TUNEL(TdT-mediated dUTP nick-end labeling)染色检测细胞凋亡 细胞在玻片上培养,暴露于橙皮素中24 h。载玻片在4%多聚甲醛溶液中固定30 min,0.2% Triton X-100处理5 min,PBS洗涤两次,末端脱氧核苷转移酶荧光素标记。随后,细胞在室温环境下用DAPI(4′,6-Diamidino-2-Phenylindole,Dihydrochloride)染色3 min。所有图像均使用模型DMi8(徕卡微系统有限公司,德国)获取。
1.2.6免疫印迹法检测蛋白表达 细胞裂解30 min后,13 000×g离心20 min。上清蛋白采用BCA试剂盒定量,进行SDS-PAGE电泳。然后使用半干转移装置或湿转移装置将蛋白从凝胶转移到PVDF膜上。膜被封闭在5%的牛奶中1 h,用抗体孵育,使用增强化学发光的化学显微镜微型成像系统进行可视化处理。条带使用ImageJ软件分析。
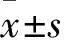
2 结果
2.1 鞣花酸对人宫颈癌细胞生存率的影响体外培养人宫颈癌Hela细胞,分组处理不同浓度鞣花酸24 h。如Fig 1A所示,随着鞣花酸浓度的增加,细胞生存率呈现浓度依赖性下降趋势,尤其鞣花酸浓度在30 μmol·L-1时,细胞生存率开始出现明显降低(P<0.05)。Fig 1B结果显示,30 μmol·L-1的鞣花酸刺激细胞0、12、24、48 h后,细胞生存率呈现时间依赖性下降趋势,尤其在24 h时,细胞生存率开始出现明显降低(P<0.05)。
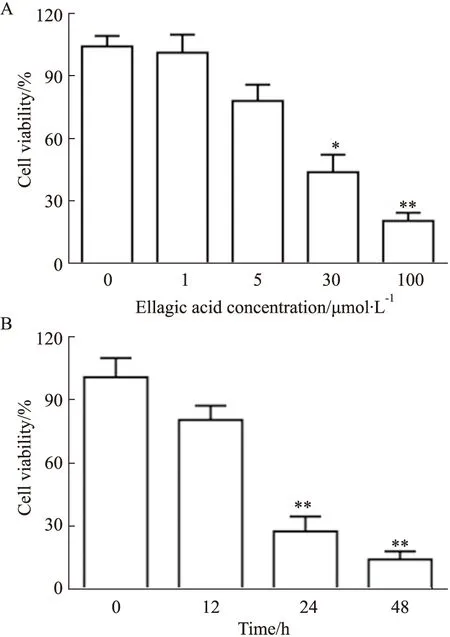
Fig 1 Effect of ellagic acid on survival rate of human cervical cancer cells
2.2 鞣花酸对人宫颈癌细胞凋亡水平的影响如Fig 2所示,经荧光显微镜检测发现,不同浓度鞣花酸刺激细胞,细胞内TUNEL标记的红色荧光呈现浓度依赖性增强趋势,尤其鞣花酸浓度为30 μmol·L-1时细胞内红色荧光开始出现明显增加(P<0.05)。如Fig 3所示,经流式细胞检测发现,不同浓度鞣花酸刺激细胞,细胞内红色荧光强度呈现浓度依赖性增加趋势,尤其鞣花酸浓度在30 μmol·L-1时,细胞内红色荧光开始出现明显增加(P<0.05)。
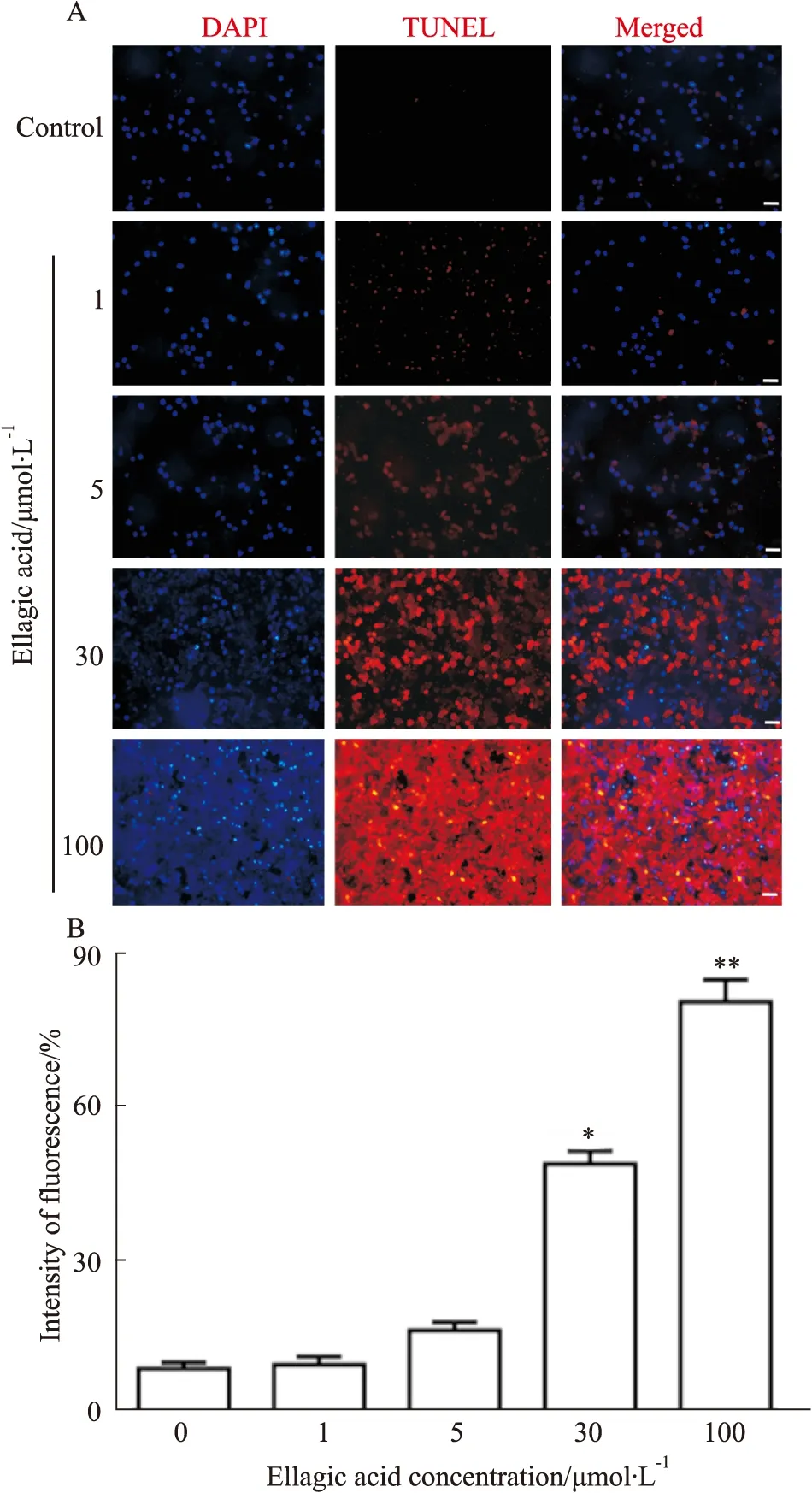
Fig 2 Effect of ellagic acid on apoptosis of human cervical cancer cells detected by fluorescence microscopy (scale bar: 50 μm)
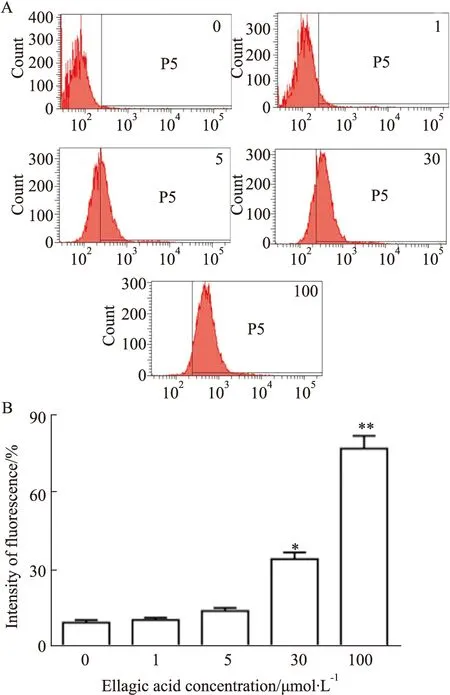
Fig 3 Effect of ellagic acid on apoptosis of human cervical cancer cells detected by flow cytometry
2.3 鞣花酸对人宫颈癌细胞中内质网应激(endoplasmic reticulum stress,ERS)-线粒体凋亡通路的影响如Fig 4A及4B所示,不同浓度鞣花酸刺激Hela细胞24 h时,ERS信号通路蛋白GRP78、CHOP、p-PERK及p-IRE1蛋白表达呈浓度依赖性升高趋势(P<0.05),鞣花酸给药浓度为30 μmol·L-1时蛋白表达开始明显升高,差异具有统计学意义(P<0.05)。如Fig 5A所示,不同浓度鞣花酸刺激Hela细胞24 h时,线粒体抗凋亡蛋白Bcl-2表达呈浓度依赖性降低趋势(P<0.05),线粒体促凋亡蛋白Bax、cleaved caspase-3表达呈浓度依赖性升高趋势(P<0.05),鞣花酸给药浓度为30 μmol·L-1时,蛋白表达的变化开始,差异具有统计学意义(P<0.05)。如Fig 5B所示,鞣花酸给药浓度为30 μmol·L-1时,Bcl-2蛋白表达明显降低(P<0.05),Bax、cleaved caspase-3等蛋白的表达明显升高(P<0.05)。而预处理ERS抑制剂4-PBA可以明显抵消鞣花酸的促凋亡作用(P<0.05)。
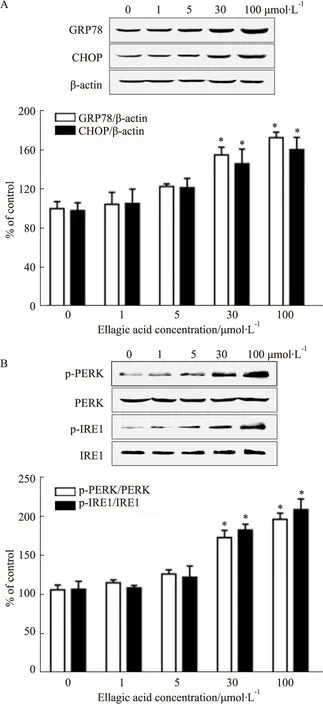
Fig 4 Effects of ellagic acid on expression of
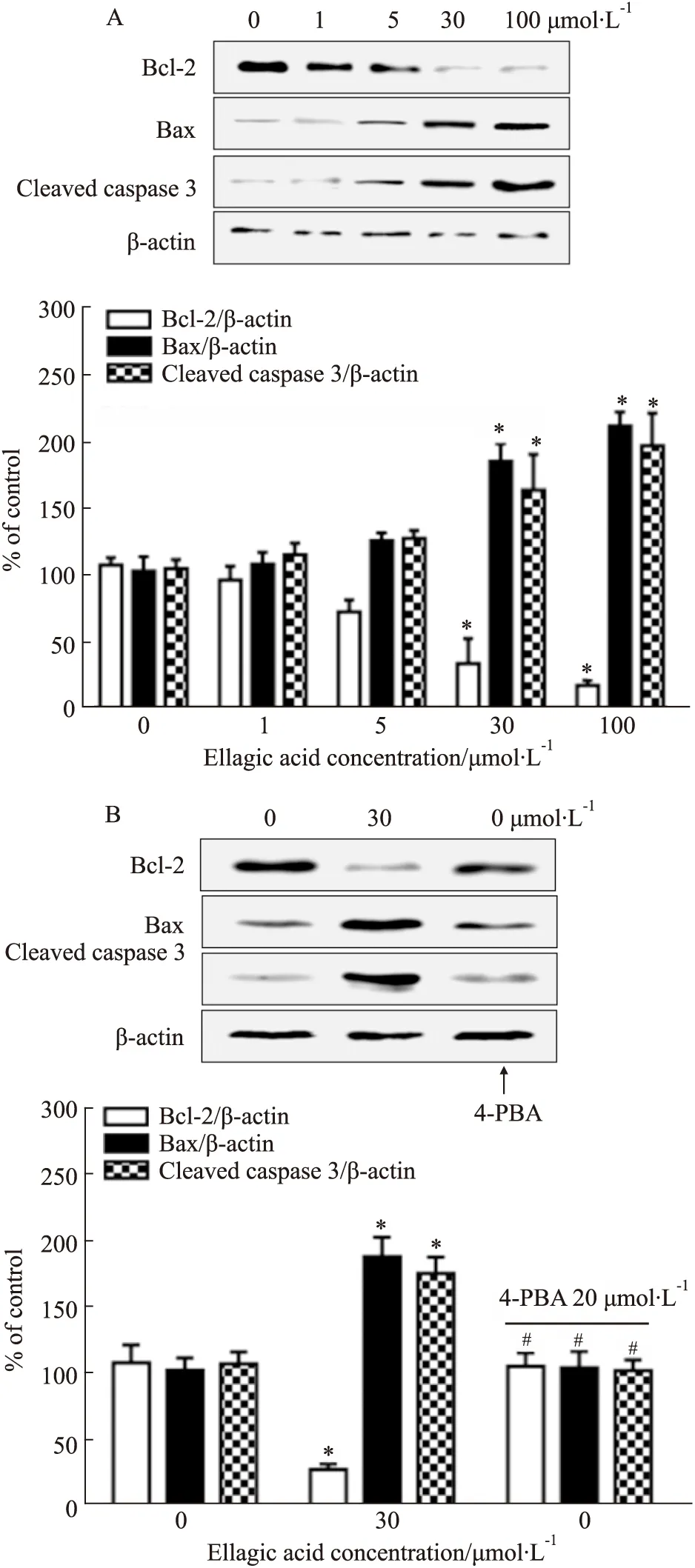
Fig 5 Effect of ellagic acid on expression of mitochondrial apoptosis pathway related proteins in human cervical cancer cells n=3)
3 讨论
宫颈癌是最常见的妇科恶性肿瘤之一[4],严重威胁着妇女的健康。宫颈癌的复发和转移率高,死亡率也高[5-7]。因此,如何抑制肿瘤的生长、复发和转移,降低死亡率,延长患者的无病生存,提高生活质量,是目前亟待解决的关键问题。
在该研究中,我们采用不同浓度的鞣花酸(1、5、30、100 μmol·L-1)分别处理宫颈癌Hela细胞24及48 h,发现Hela细胞的生存率有浓度及时间依赖性降低的趋势,尤其用30 μmol·L-1鞣花酸刺激24 h时Hela细胞的生存率开始出现明显的降低。这个结果提示我们,鞣花酸可以对宫颈癌细胞的生长起到明显的抑制作用。为了进一步观察鞣花酸对宫颈癌细胞的促凋亡作用,我们用TUNEL凋亡检测试剂盒进行了细胞免疫荧光染色实验,用荧光显微镜和流式细胞检测仪检测了细胞内的红色荧光强度,从结果可以看出,鞣花酸可以明显增加细胞内红色荧光,呈浓度依赖性趋势。这些结果充分地说明了鞣花酸对宫颈癌细胞的促凋亡作用。
在肿瘤发生的过程中,细胞经常会遇到缺氧、营养缺失、蛋白酶体功能障碍和蛋白质突变等问题。癌细胞由于不受控制的增殖和生长,对内质网蛋白的折叠和组装能力要求很高,这可能导致错误折叠蛋白的积累,触发ERS[9]。最近的研究通过揭示未折叠蛋白反应(unfolded protein response,UPR)对细胞转化、炎症、肿瘤血管生成、肿瘤侵袭性、肿瘤侵袭和转移的影响,增加了我们对ERS与肿瘤生物学关系的了解[10]。内质网中的蛋白稳定被强调为癌症发展和侵袭性的关键因素之一[11],一些UPR成分如GRP78[12]和CHOP[13]已被报道为独立预后的生物标志物。ERS时,从PERK、IRE1等ER跨膜蛋白GRP78解离,发生蛋白折叠,UPR通路激活[14],上调凋亡相关转录因子C/EBP同源蛋白CHOP的表达,有报道也提出,CHOP上调与线粒体通路相关[15]。本研究结果提示,鞣花酸可以诱发人宫颈癌细胞内ERS相关蛋白GRP78、p-PERK、p-IRE1、CHOP的表达及线粒体促凋亡蛋白BAX及cleaved caspase-3的表达,同时降低线粒体抗凋亡蛋白Bcl-2的表达,而预处理ERS抑制剂可以明显逆转鞣花酸诱发的线粒体凋亡相关蛋白的改变。这些结果表明,鞣花酸可以调控人宫颈癌细胞内ERS-线粒体凋亡信号通路,促进细胞凋亡。
综上所述,鞣花酸能通过ERS信号通路的调控,导致线粒体功能紊乱,最终诱导线粒体介导的肿瘤细胞凋亡,发挥肿瘤细胞杀伤作用,本研究为鞣花酸的抗肿瘤应用提供了依据和理论基础。

