Glisson蒂鞘外与鞘内法在腹腔镜解剖性右肝后叶切除的对比研究
夏果毅,刘苏来,宋颖辉,谭志国,郑核,彭创
(1.湖南省人民医院/湖南师范大学附属第一医院肝胆外科,湖南长沙410005;2.湖南省邵阳市中心医院肝胆外科,湖南邵阳422000)
Takasaki 教授[1-2]在1998年提出Glisson 蒂鞘外解剖横断法肝切除术理论,按照Takasaki 教授肝分段法VI,VII 为肝右段,起初用于开腹肝切除术中。1991年,Reich 等[3]报道了第1 例腹腔镜肝切除术(laparoscopic hepatectomy)的病例,经过30年的发展,腹腔镜肝切除从最初的肝部分切除、左肝外叶切除扩展到半肝切除、肝段以及亚段肝切除,其安全性和有效性已经得到广泛认可[4]。近年来,国内外专家将Glisson 蒂鞘外解剖横断法灵巧应用于腹腔镜肝切除术中取得了令人满意的效果[5-6]。但右肝后叶位置深,暴露困难,肝内管道变异较多,切肝平面难以把控,所以在腹腔镜肝切除领域按DSS-B 分级属于高难度手术[7],故只能在少数大型肝胆外科中心才能完成。而如何安全有效的阻断入肝血流则是手术成功的关键步骤[8]。本研究回顾性分析湖南省人民医院43 例行腹腔镜右肝后叶切除患者临床资料,探讨鞘外法与鞘内法在腹腔镜解剖性右肝后叶切除术中安全性及近期疗效,现报告如下。
1 资料与方法
1.1 一般资料
分析2015年1月1日—2019年9月30日间于湖南省人民医院肝胆外科行腹腔镜右肝后叶切除患者的临床资料,制定纳入以及排除标准,43 例患者符合研究要求,本组男23 例,女20 例;年龄39~76 岁;术前均完善上腹部CT 平扫+增强+血管成像以及上腹部MRI+MRCP,确定病变部位均位于右肝后叶;43 例患者均完成全腹腔镜右后叶切除,无中转开腹;术后病理学检查结果显示原发性肝细胞癌33 例,其他肝脏良性肿瘤10 例(肝血管瘤5 例,肝脏局灶结节性增生3 例,肝腺瘤2 例)。根据肝蒂处理方式将鞘外解剖法分为鞘外组,鞘内解剖法分为鞘外组。
1.2 纳入及排除标准
纳入标准:⑴病变位于Couinaud 分段VI,VII 段的原发性肝细胞癌和良性肿瘤;⑵肿瘤直径<10 cm;⑶肝功能为Child A 级以上,剩余有效肝功能体积>50%;⑷腹腔镜下解剖性右肝后叶切除;⑸患者无麻醉以及腹腔镜手术禁忌。排除标准:⑴除原发性肝细胞癌以外其他类型肝脏恶性肿瘤或转移瘤;⑵合并胆管结石;⑶肿瘤侵犯达到或超过右后叶肝蒂根部;⑷肿瘤侵犯右肝静脉;⑸合并其他恶性肿瘤;⑹合并糖尿病,冠心病,肾功能不全,结核、严重肾病或接受支架植入手术需长期口服抗凝、抗痨、或激素类药物治疗者等影响患者康复的慢性疾病;⑺患有精神疾病;⑻长期用药、不能配合随访者;⑼无法耐受气腹;⑽中转开腹;⑾资料不完整。
1.3 手术方法
鞘外解剖法处理右后叶Glisson 蒂(鞘外组):全麻后,分腿位,头高脚低,左侧倾斜30°。常规手术区域消毒铺巾。脐上右侧2 cm 处置入10 mm Trocar 为观察孔,右腋前线肋缘下穿刺12 mm Trocar,为主操作孔,5 mm Trocar 于右腋中线肋缘下及肋间隙穿刺作为辅助操作孔。剑突下,左腹直肌外缘分别穿刺10 mm Trocar 和12 mm Trocar 为助手操作孔。直视下根据术中情况调整穿刺孔位置。探查腹腔后常规切除胆囊,预置Pringle 阻断带,用超声刀沿Rouvier 沟打开腹侧以及背侧肝背膜,吸引器配合双极电凝钝性推开Rouvier 沟腹侧和背侧肝实质,显露右后叶Glisson 鞘,用“金手指”顺着Glisson 鞘后方将右后叶肝蒂套通,“哈巴狗夹”阻断后观察缺血线证实为右后叶肝蒂,强生切割闭合器离断右后叶肝蒂,沿缺血线绘制预切线,随后游离右肝周围韧带,显露第二肝门,超声刀“翻书法”从足侧向头侧开始断肝,切面大血管以及胆管用Hem-o-lock 夹夹闭后切断,小血管用超声刀或者Ligasure 凝断,显露右肝静脉末梢枝,找到右肝静脉主干,向第二肝门推进,结扎右肝静脉属支以及部分肝短静脉,全程显露右肝静脉右后缘,沿途注意有无粗大的右肝后下,后中,后上静脉[断肝过程中心静脉压维持在1~3 cmH2O(1 cmH2O=0.098 kPa)](图1A)。将标本移除装袋,取下腹部适宜切口取出标本袋,冲洗手术创面,留置引流管。固定管道缝合,缝合鞘孔后结束手术。
鞘内解剖法处理右后叶Glisson 蒂(鞘内组):体位以及Trocar 布局同鞘外组,常规切除胆囊,预置Pringle 阻断带,电凝钩靠近肝十二指肠韧带右缘,向Rouvier 沟方向打开表面浆膜,循胆囊动脉游离出右肝动脉,解剖出右后动脉用Hem-o-lock 双重结扎,牵开肝右动脉,显露后方门静脉主干,紧贴门静脉主干向肝内进一步分离就能容易显露门静脉右后支,随后用丝线联合Hem-o-lock 双重结扎(图1B),肝表面就能出现明显缺血线。断肝过程同鞘外组。
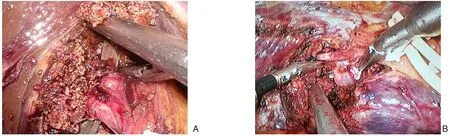
图1 术中图片A:鞘外法解剖右后叶肝蒂;B:鞘内法解剖右后叶肝蒂Figure 1 Intraoperative picturesA:Anatomy of the right posterior liver pedicle by extrathecal method;B:Anatomy of the right posterior liver pedicle by intrathecal method
1.4 观察指标
观察两组患者术中失血量,手术时间,术后住院时间,近期并发症(胸腹水、胆瘘、腹腔感染等)发生率,以及术后第3 天肝功能指标[总胆红素(TBIL)、白蛋白(ALB)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST),凝血酶原时间(PT)]。
1.5 统计学处理
对所收集的数据采用SPSS 26.0 统计数据包进行分析,计量资料以(±s)表示,采用t检验;计数资料以例数(百分比)[n(%)]表示,采用χ2检验;双侧P<0.05 认为差异有统计学意义。
2 结果
2.1 两组患者一般资料
两组患者的性别、年龄、体质量指数(BMI)、TBIL、ALB、AST、ALT、PT 的差异均无统计学意义(均P>0.05);两组病理类型均主要以原发性肝细胞癌为主,疾病构成差异无统计学意义(P>0.05)(表1)。

表1 两组患者一般资料比较Table 1 Comparison of general data between two groups
2.2 两组患者术中、术后指标比较
鞘外组手术时间短于鞘内组[(191.72±38.11)minvs.(231.54±37.26)min],差异有统计学意义(P<0.05),而两组患者术中失血量,术后第3天肝功能指标、PT、住院时间、近期并发症发生率差异均无统计学意义(均P>0.05)。鞘外组术后出现2 例胸腔积液,保守治疗后治愈;3 例出现腹腔积液,予以利尿后治愈;1 例出现胆瘘,经腹腔引流管引流保守治疗后治愈。鞘内组术后出现1 例膈下积液予以B 超引导下穿刺引流治愈;1 例出现腹腔积液,利尿后治愈;1 例出现胆瘘,经腹腔引流管引流保守治疗后治愈。两组未出现死亡病例以及严重并发症(Clavien-Dindo IIIa 级以上)(表2)。
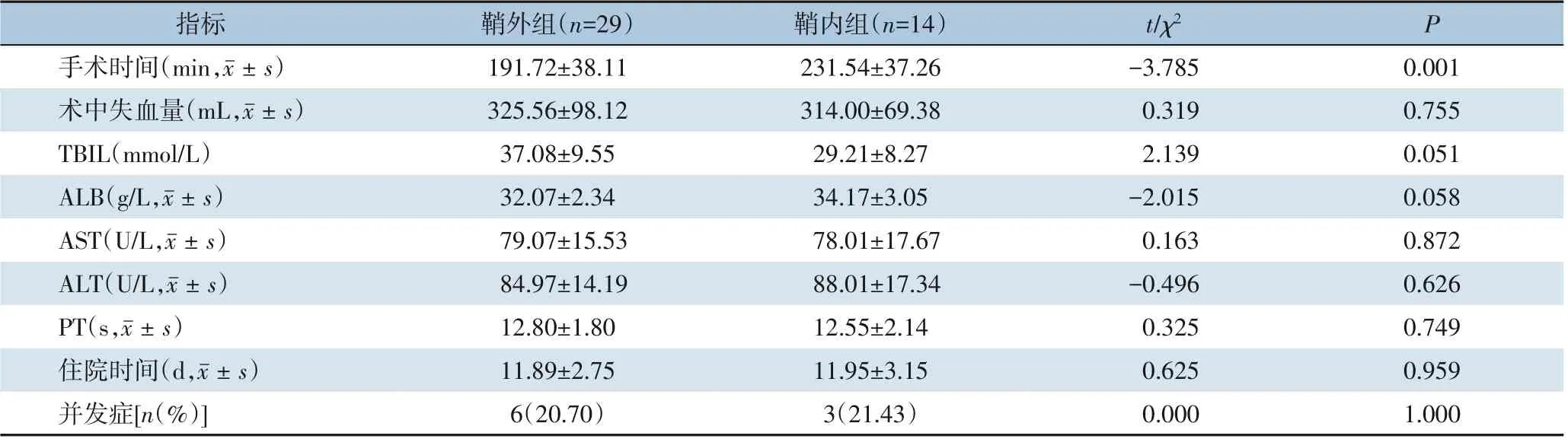
表2 两组患者术中、术后指标比较Table 2 Comparison of intraoperative and postoperative variables between two groups
3 讨论
右肝后叶位置深,视野差,解剖游离较为困难,第二肝门以及右肝静脉根部显露难度较大,断肝平面难以把控,出血难以控制,故右肝后叶切除是腹腔镜肝切除中较难术式[9]。腹腔镜微创技术近年来发展迅速,其独特视角以及放大效应更能清晰解剖肝内管道,对解剖性肝切除有其独有优势,腹腔镜右后叶切除可行性以及安全性已经得到广泛认可[10],逐渐成为各大肝胆外科中心常规术式[11-12],。
目前右后叶肝蒂区域阻断常用有鞘外和鞘内法两种方式[13-14]。本研究中29 例使用鞘外法阻断,14 例使用鞘内法阻断行腹腔镜右后叶切除,围手术期无死亡病例,无严重并发症发生,两种阻断方法均安全切实可行。两组患者在术中失血量、术后肝功能、凝血酶原时间、住院天数、术后并发症差异无统计学意义,两种方法均有效处理右后叶肝蒂,都是选择性的阻断患肝的血流同时保留了正常肝组织的血流,对阻断的最终结果并无本质差别,故术后肝功能以及凝血酶原时间无显著差异。腹腔镜操作熟练的主刀医生处理第一肝门以及断肝过程中对出血的预判能力较强,故术中出血量、术后并发症及住院天数无显著差异。本研究中两组患者手术时间差异有统计学意义,鞘内法需分别解剖并离断肝动脉及门静脉,可能损伤门静脉及门短血管导致需要花费大量时间去缝合血管甚至被迫中转开腹,而鞘外法无需打开Glisson 鞘,仅需在Rouviere 沟套出右后叶肝蒂直接横断即可,不但降低了副损伤发生的几率,而且缩短了手术操作时间。但需准确找到Glisson 鞘与肝实质Laennec 膜之间的间隙[15-16],对术者操作以及对第一肝门解剖的熟悉程度相对要求较高[17-18]。
需要强调的是鞘外法并不适用于需要淋巴结清扫以及需要胆肠吻合的患者,例如肝内胆管细胞癌,肝门部胆管癌等。鞘外法解剖右后叶肝蒂需充分了解右后叶肝蒂解剖变异[19-20],包括门静脉右后叶分支形态和肝内胆管汇合变异的方式。术前需充分完善肝胆增强CT 扫描,磁共振水成像以及胆道造影等检查,近年来3D 打印技术广泛利用更加有助于评估门静脉以及胆管变异情况[21],如门静脉右后支呈独立分支型(即P6 和P7 无共干或共干很短),右肝后叶胆管汇入左肝管等情况就不适用于鞘外法解剖。部分患者Rouviere 沟呈隐匿性[22],难以判断右肝后叶肝蒂准确位置,需切除较多肝实质后才能将右后叶肝蒂显露,这种情况下可能鞘内解剖法较为安全[19,23]。切肝平面可通过缺血线从尾侧入路找到肝右静脉末梢[24],沿肝右静脉右后侧向头侧推进,也可用术中B 超确定右肝静脉行程[25],鞘外法联合荧光腹腔镜反染能更加清楚的显示肝实质内右肝后叶边界。以右肝静脉、肝实质染色边界,下腔静脉前壁确定切肝平面,有助于安全、规范的完成解剖性肝切除[26-27]。在接近第二肝门时,要特别小心损伤V7 招致大出血,此时手术已经进行较长、人疲马乏,容易在接近胜利时中转开腹。术中采取低中心静脉压(CVP)技术可有效控制术中出血[28]。
综上,鞘外法与鞘内法在腹腔镜解剖性右肝后叶切除术中同样安全[29-30]。术前应该有充分的增强CT 及磁共振影像学资料以及对肝内管道解剖结构和变异情况充分了解,同时合理利用3D 打印、术中超声以及荧光腹腔镜染色技术精准的实施肝切除术。在严格掌握手术适应证、遴选合适患者、腹腔镜手术操作熟练的前提下运用鞘外法能简化手术流程,缩短手术时间,提高手术效率,值得临床推广。但不足之处为本研究为单中心数据分析,尚需多中心大样本数据分析进行论证。鞘外法前景广阔,在腹腔镜肝切除经验欠丰富的临床单位需合理利用手术技艺,逐渐从鞘内法过渡到鞘外法。

