肝脏缺血再灌注损伤的ceRNA网络构建和潜在治疗药物筛选
邓家琦,钱保林,张丽云,况容,李明星
(西南医科大学附属医院1.超声医学科2.肝胆外科3.健康管理部,四川泸州646000)
肝脏缺血-再灌注(ischemia/reperfusion,I/R)损伤是肝组织经过一段时间缺血后,再恢复血液灌注时触发一系列复杂级联反应导致肝损伤进一步加重的病理生理过程[1]。临床上肝脏I/R 损伤常发生于肝移植和肝切除等肝脏手术过程中。肝脏在缺血状态下血流再灌注后,常引起术后肝功能短时间内急剧下降、凝血系统障碍等多种并发症,同时会产生肝脏乃至全身的一系列代谢紊乱,若未能得到及时处理,还可能引发肝功能衰竭,严重者甚至导致患者死亡,大大降低肝切除或肝移植手术成功率及阻碍患者术后康复,影响患者预后[2]。目前临床上通常使用全入肝血流阻断法(Pringle 法)进行术中肝脏血流的阻断,正常的肝实质连续性Pringle 法阻断的安全时限可达90 min,而间歇性Pringle 法阻断(每次阻断10~15 min,间歇5 min 后重复)的累计缺血安全时限可长达120 min[3-4]。如果超过这一时限可能导致肝坏死、肝衰竭的发生。
肝脏I/R 损伤的发生机制十分复杂,可能与活性氧产生、细胞凋亡、钙离子超载及大量炎性细胞浸润导致的炎性反应有关,这些机制在肝脏缺血的过程中开始出现,并在血液再灌注后进一步加重[5]。lncRNA 作为一类长度超过200 个核苷酸的非编码RNA,具有复杂的种类和多样化的功能。近年来随着对lncRNA 研究的深入,发现lncRNA、mRNA、miRNA 三者可通过竞争性内源性RNA(competing endogenous RNA,ceRNA)机制互相作用,形成ceRNA 调控网络,干扰许多因子的表达影响多种疾病的整体进程[6]。然而ceRNA 网络在肝脏I/R 损伤中的功能仅有少量报道。Ying 等[7]研究发现lncRNA Gm4419/miR-455/SOX6 轴通过促进缺氧复氧处理的BRL-3A 细胞凋亡,加速肝脏I/R 损伤。Dai 等[8]研究表明lncRNA AK054386/miR-199 通过激活内质网应激通路,加速肝脏I/R 损伤。Tang 等[9]发现lncRNA HOTAIR / miR-20b-5p/ATG7 轴可通过激活细胞自噬,加速肝脏I/R 损伤。Huang 等[10]证明lncRNA MEG3/miR-34a/NRF2 网络通过抑制细胞凋亡,降低血清ALT 和AST 的表达,保护肝脏I/R 损伤。本研究旨在利用生物信息学方法从基因表达数据库中挖掘在肝脏I/R 损伤中可能发挥重要作用的基因,并构建潜在ceRNA 网络,为后续机制研究提供数据支持。同时基于这些差异基因从药物数据库筛选出潜在的天然药物,以期减轻肝脏I/R损伤为肝脏手术后的恢复创造有利条件。
1 材料与方法
1.1 材料
从GEO(Gene Expression Omnibus)数据库中按照以下标准获取肝脏I/R 损伤的基因芯片数据:以“hepatic ischemia/reperfusion injury”为关键词;选择物种为“Mus musculus”、研究类型为“expression profiling by array”两个过滤条件进一步筛选数据;最后选定I/R 组织样本数、缺血后适应(IPO)组织样本数与假手术对照组织样本数均≥3 的芯片。根据筛选结果,获得Zhang等[11]2019年提交的GSE117066 数据集:I/R 组通过夹闭左门静脉和中门静脉分支行70%肝脏缺血,60 min 后重新恢复血供,并再灌注4 h 后处死小鼠。IPO 组通过70%肝脏缺血60 min,然后用连续35 s周期的再灌注治疗之后,持续的再灌注4 h。采集肝脏标本进行基因表达谱测序。GSE117066 数据集(平台:GPL21103)有9 个样本:3 个正常样本(样本编号:GSM3269879、GSM3269880 和GSM3269881),3 个 I/R 样本(样本编号:GSM3269882、GSM3269883 和GSM3269884),3 个IPO 样本(样本编号:GSM3269885、GSM3269886和GSM3269887)。获得Huber 等[12]2008年提交的GSE10654 数据集:I/R 组通过70%肝脏缺血,90 min后重新恢复血供,并再灌注1 h 后处死小鼠。采集肝脏标本进行基因表达谱测序。GSE10654 数据集(平台:GPL5759)有6 个样本:3 个正常样本(样本编号:GSM269536、GSM269537 和GSM269538),3 个I/R 样本(样本编号:GSM269560、GSM269561和GSM269562)。获得Zheng 等[13]2015年分析的GSE72315 数据集差异 miRNA 结果(PMID:26859886)。
1.2 方法
1.2.1 差异表达基因的筛选使用GEO 数据库下载表达谱数据,并使用R 语言中的limma 包进行数据分析。删去数据集中没有注释的探针,并对一个基因的多个探针取最大值。使用R 语言中的ggplot2包进行总基因散点图和火山图绘制。以|logFC|>1.0、P<0.05 为筛选条件进行差异mRNA 的筛选,使用R 语言中的ggplot2 包进行差异mRNA 热图绘制。
1.2.2 对差异mRNA 进行GO/KEGG 功能富集分析利用Metascape 数据库对筛选出的差异mRNA 进行GO/KEGG 功能富集分析,得到这些差异mRNA主要参与的生物学过程,P<0.05 为有统计学意义。
1.2.3 对差异mRNA 进行蛋白互作网络构建及分析使用String 数据库及Cytoscape 软件进行蛋白互作(protein-protein interaction,PPI)网络构建。首先使用String 数据库(https://string-db.org/)对差异mRNA 进行构建蛋白互作网络,选取combined score >0.4 的蛋白互作关系对导入Cytoscape 3.8.0 软件进行网络可视化。
1.2.4 miRNA 及lncRNA 的预测分析使用miRTarBase 数据库(http://mirtarbase.cuhk.edu.cn/php/index.php)检索靶向关键差异基因的miRNA。使用starBase:ceRNA 数据库(http://starbase.sysu.edu.cn/ceRNA.php?source=mRNA)构建ceRNA 网络。
1.2.5 比较毒物基因组学数据库筛选关键差异基因的候选药物使用比较毒物基因组学数据库(Comparative Toxicogenomics Database,CTD,http://ctdbase.org/)筛选对关键差异基因表达具有潜在作用的药物。参数设定如下:Analyze 选择Batch Query;input type 选 择 Genes;Chemical-gene interactions 选择expression。
2 结果
2.1 GEO表达谱数据筛选差异表达基因
GSE10654 数据集共包括14 685 个蛋白编码基因芯片数据,GSE117066 数据集共包括10 976 个蛋白编码基因芯片数据。总基因散点图结果显示I/R 组与假手术组相比,GSE10654 数据集中明显上调基因有52 个,下调基因有62 个(|logFC|>1.0,P<0.05)(图1A),GSE117066 数据集中明显上调基因有162 个,下调基因有195 个(|logFC|>1.0,P<0.05)(图1B)。进一步通过基因表达热图可直观显示出GSE10654 与GSE117066 数据集中差异表达基因的变化情况(图1C-D),利于下一步的功能分析。为获得两个数据集中共同上调或下调基因,通过Venn 图分析(图2A),获得18 个在I/R 组共同上调表达的基因,分别是:Atf3、Btg2、Chka、Cxcl2、Dusp1、Dusp6、Fos、Fosb、G6pc、Hspa1a、Ier2、Ifrd1、Jun、Klf6、Nr4a1、Pdk4、Rhob 和Slc25a25;7 个在I/R 组共同下调表达的基因,分别是:Cyp2b10、Il1r1、Lyve1、Mt1、Mt2、Saa4 和Scara5,其变化趋势如图2B所示。
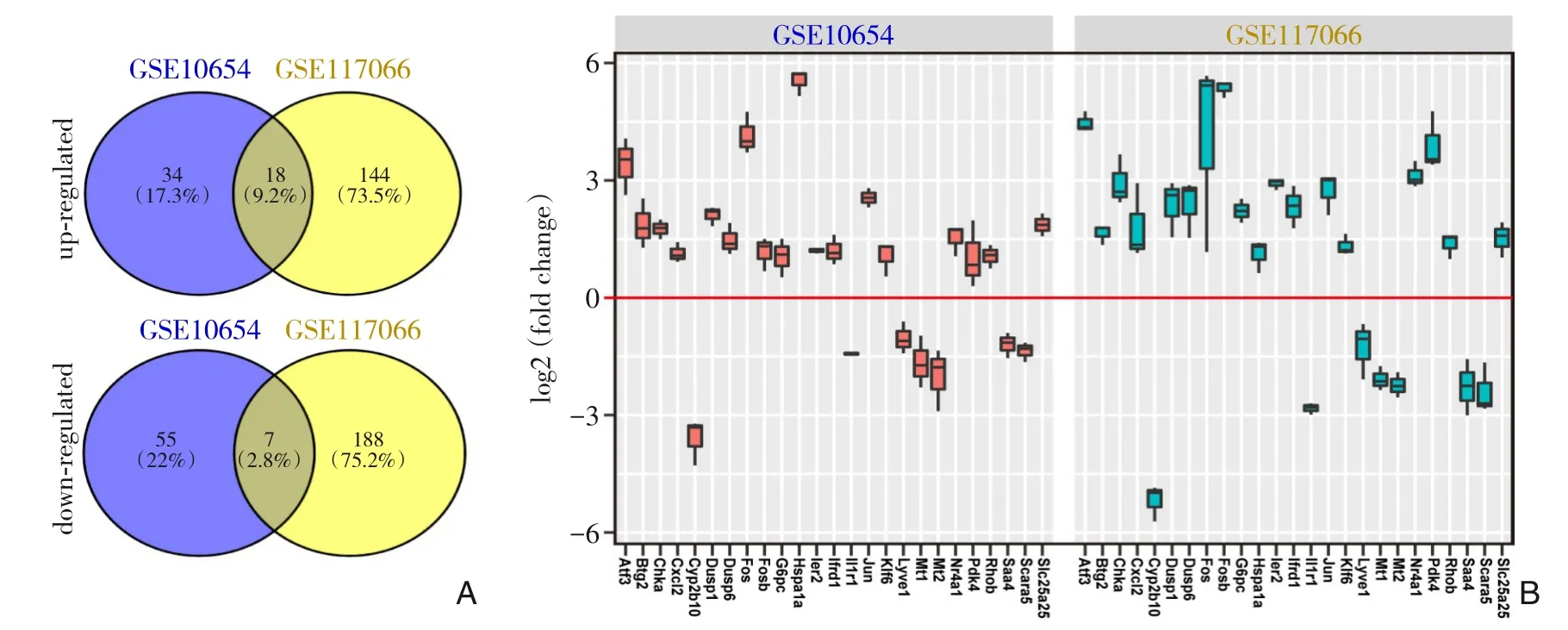
图2 GSE10654与GSE117066数据集差异基因的表达情况A:GSE10654与GSE117066上调或下调基因的Venn图分析;B:GSE10654与GSE117066数据集共同上调或下调基因的表达情况Figure 2 The expressions of differential genes between GSE10654 and GSE117066 datasetsA:Venn diagram analysis of upregulated or down-regulated genes between GSE10654 and GSE117066;B:The expression of co-up-regulated or co-downregulated genes in the GSE10654 and GSE117066 datasets
2.2 与I/R 损伤相关的差异基因PPI 网络可视化分析
为确定与假手术组相比,I/R 组差异表达基因的功能,进一步分析了GSE117066 数据集中IPO 组与I/R 组中基因的表达变化。总基因散点图结果显示IPO 组与I/R 组相比,GSE117066 数据集中显著上调基因有283 个,下调基因有242 个(|logFC|>1.0,P<0.05)(图3A)。通过基因表达热图可直观显示出GSE117066 数据集中差异表达基因的变化情况(图3B)。通过Venn 图分析(图3C),获得16 个在I/R 组上调表达,在IPO 组下调表达的基因,分别是:Atf3、Btg2、Chka、Dusp1、Dusp6、Fos、Fosb、G6pc、Hspa1a、Ier2、Ifrd1、Jun、Nr4a1、Pdk4、Rhob 和Slc25a25;7 个在I/R 组下调表达,在IPO 组上调表达的基因,分别是:Cyp2b10、Il1r1、Lyve1、Mt1、Mt2、Saa4 和Scara5。进一步通过String 数据库构建PPI 网络,该网络中共有18 个差异表达基因,分别是:Atf3、Btg2、Cyp2b10、Dusp1、Dusp6、Fos、Fosb、G6pc、Hspa1a、Ier2、Ifrd1、Il1r1、Jun、Mt1、Mt2、Nr4a1、Pdk4 和Rhob(图3D),提示这些基因可能是I/R 损伤中的关键基因。
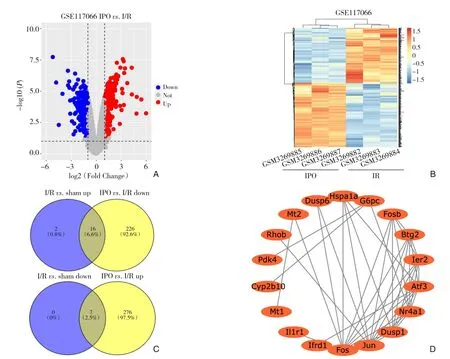
图3 与I/R损伤相关的差异基因PPI网络可视化分析A:GSE117066数据集总基因散点图(红色表示基因上调,蓝色表示基因下调);B:GSE117066数据集总基因火山图;C:Venn图分析;D:PPI网络可视化分析Figure 3 V isualized analysis of PPI network of differential genes related to I/R injuryA:Scatter plot of the total genes in the GSE117066 dataset(red color standing for up-regulation of genes,blue color standing for down-regulation of genes);B:Total gene volcano map of GSE117066 dataset;C:Venn diagram analysis;D:PPI network visualization analysis
2.3 与I/R损伤相关的差异基因功能富集分析
利用Metascape 对PPI 网络中的18 个差异表达基因进行GO/KEGG 功能富集分析,GO 功能富集分析结果显示,在生物学过程(biological processes)方面,主要参与细胞死亡的正调控及对细胞外刺激的反应。KEGG 通路富集结果显示:差异基因主要参与MAPK 信号通路。GO/KEGG 富集分析网络图如图4A所示。进一步转录调控网络数据库(transcriptional regulatory relationships unraveled by sentence-based text mining,TRRUST)分析可能调控这些差异基因的转录因子,发现有6 个转录因子参与对这些靶基因的调控,分别是:Trp53、Cebpb、Crebbp、Fos、Nfkb1 及SP1(图4B)。
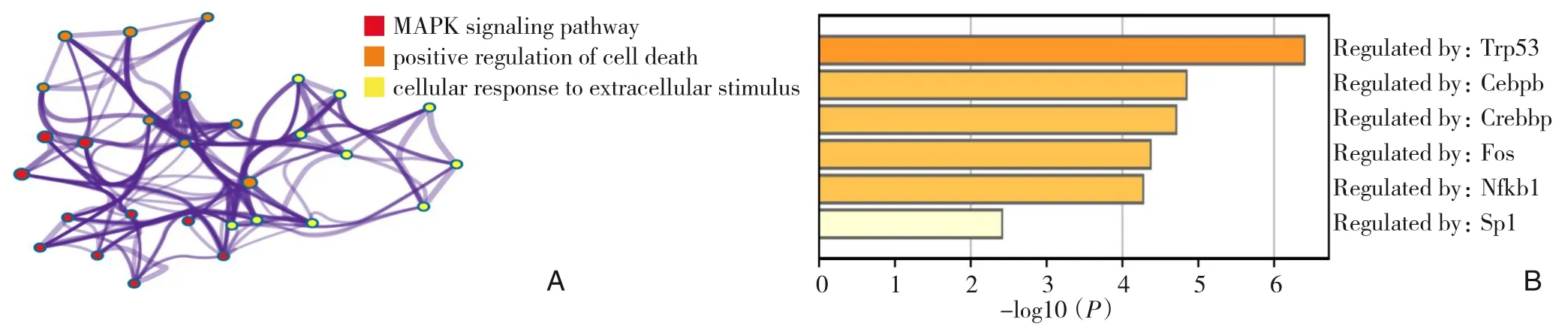
图4 与I/R损伤相关的差异基因功能富集分析A:GO/KEGG功能富集分析;B:转录因子富集分析Figure 4 Function enrichment analysis of differentially expressed genes related to I/R injuryA:GO/KEGG function enrich‐ment analysis;B:Transcription factor enrichment analysis
2.4 筛选与I/R损伤相关的差异miRNA
PPI 网络中的关键基因在体内的异常表达可能是肝脏I/R 损伤发生发展的重要因素。基因的表达水平在真核生物体中主要受转录后调控,而miRNA 作为一类由内源基因编码的长度约为22 个核苷酸的非编码单链RNA 分子,其可通过靶向mRNA 的3'UTR(非编码区)区抑制mRNA 翻译或使其发生降解从而发挥转录后调控作用。miRTarBase 数据库作为一个专门收集有实验证据支持的miRNA-mRNA 靶向关系的数据库,通过对PPI网络中的18 个差异表达基因进行预测分析,获得与I/R 损伤相关基因互作的miRNA(图5A)。为进一步分析这些miRNA 在I/R 损伤中的功能,分析了GSE72315 数据集中miRNA 在I/R 损伤后的差异表达,如图5B所示。结合构建的miRNA 网络我们构建了在I/R 损伤过程中差异表达的miRNA-mRNA 网络,如图5C所示。基于miRNA 对靶基因的负调控作用,发现两个miRNA-mRNA 轴(mmu-miR-32-5p-Btg2 与mmu-miR-9-5p-Mt2)可能在肝脏I/R 损伤中发挥重要的作用。
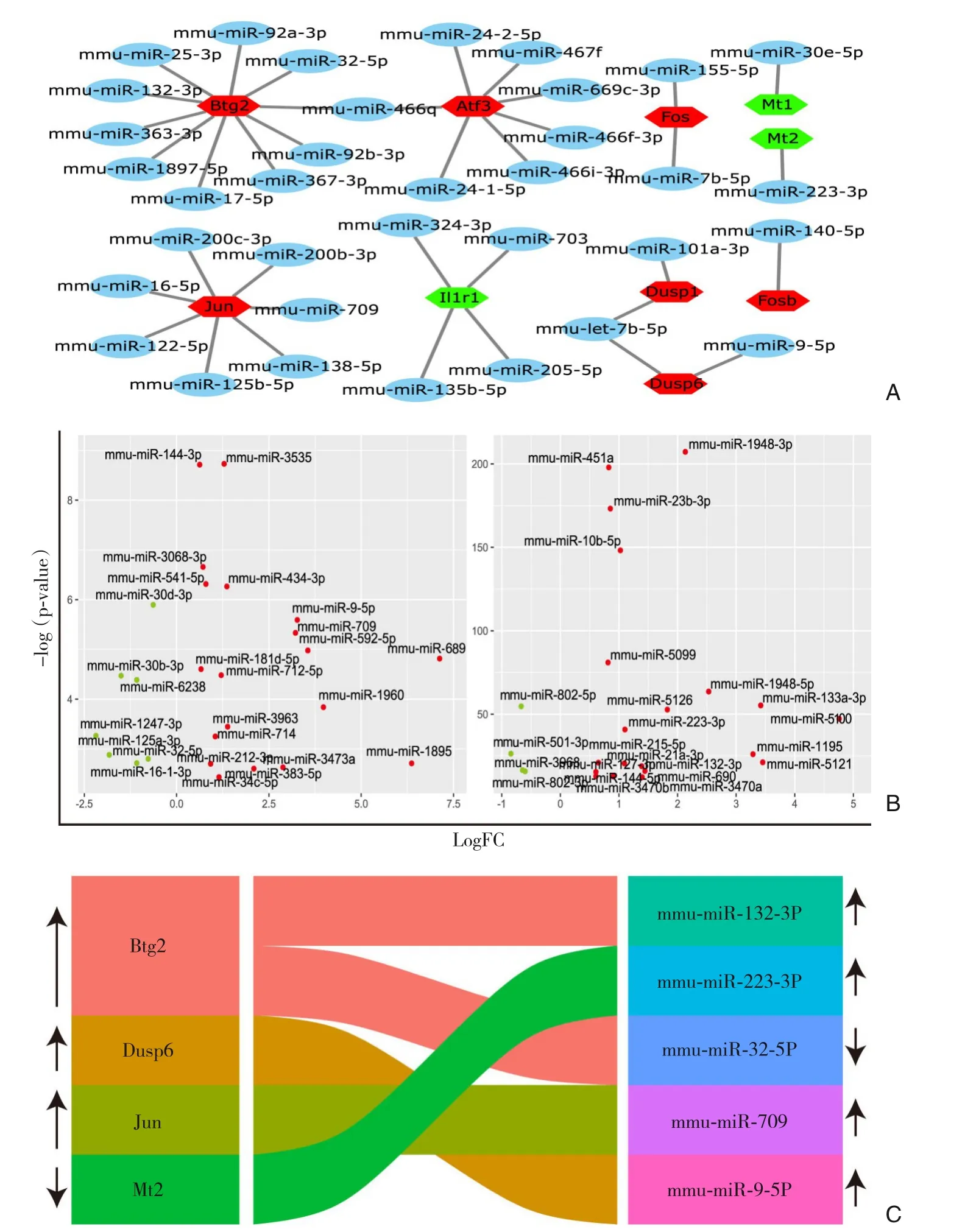
图5 与I/R损伤相关的差异miRNAA:与差异基因结合的miRNA网络分析;B:miRNA在I/R组中的表达;C:与I/R损伤相关miRNA网络Figure 5 Differentially expressed miRNAs related to I/R injuryA:Analysis of miRNA networks combined with differentiallyexpressed genes;B:Expressions of miRNA in I/R group;C:The miRNA network associated with I/R injury
2.5 构建与I/R损伤相关的ceRNA网络
长链非编码RNA(lncRNA)是长度>200 bp,不编码蛋白质的内源性RNA 分子。近年来的研究表明,lncRNA 可以作为一种ceRNA 吸附miRNA,参与靶基因的表达调控。鉴于miR-132-3p、miR-223-3p、miR-32-5p、miR-790 及miR-9-5p 在人与小鼠中序列的保守性,通过starBase:ceRNA 数据库分析可调控PPI 网络中的18 个差异基因表达的ceRNA 网络,获得9 条ceRNA 网络,分别是:XIST/MEG8/LINC00963/MALAT1-miR-32-5p-Btg2、XIST/NEAT1-miR-132-3p-Btg2、HSPA9P1/RALGAPA1P 1/RPS26P39-miR-9-5p-Dusp6(图6)。
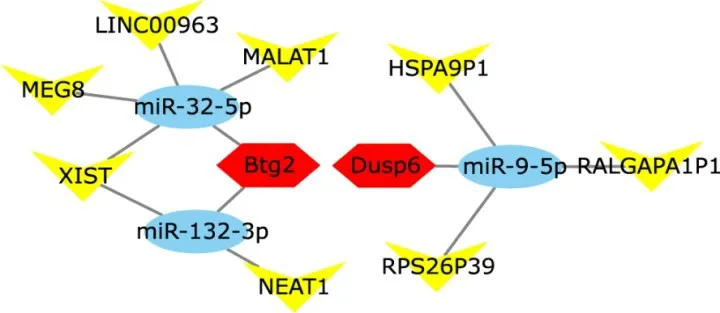
图6 与I/R损伤相关的ceRNA网络Figure 6 The ceRNA network associated with I/R injury
2.6 肝脏I/R损伤的潜在治疗药物筛选
在比较毒物基因组学数据库(comparative toxicogenomics database,CTD)中检索能够减少PPI网络中关键基因表达的天然植物药,并构建药物分子和靶点之间网络关系,共获得7 种天然药物分别是槲皮素(quercetin,ID:D011794)、白藜芦醇(resveratrol,ID:D000077185)、染料木黄酮(genistein,ID:D019833)、香豆雌酚(coumestrol,ID:D003375)、姜黄素(curcumin,ID:D003474)、辣椒素(capsaicin,ID:D002211)及东莨菪碱(scopolamine,ID:D012601)(图7)。
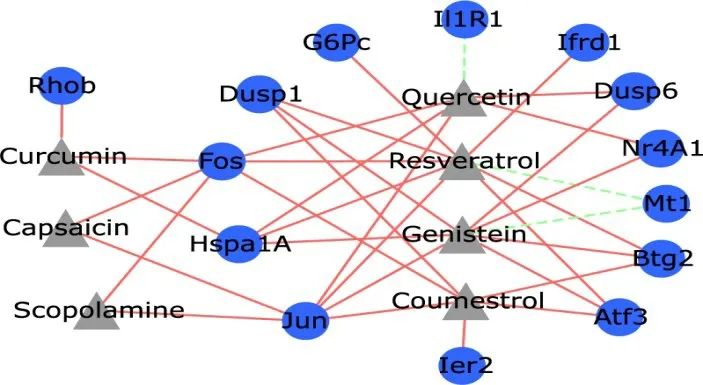
图7 与I/R损伤治疗相关的药物-靶点网络(▲表示药物,○表示靶点,红色直线表示下调表达,绿色虚线表示上调表达)Figure 7 Drug-target network related to I/R injury treat‐ment(▲standing for drug,○standing for tar‐get,the red straight line standing for the down-regu‐lated expression,and the green dashed line standing for up-regulated expression)
3 讨论
肝脏I/R 损伤是多因素共同导致的复杂病理生理过程,可引起肝功能损害甚至衰竭,影响肝移植和肝切除等肝脏手术的预后[14]。ceRNA 作为一种调控机制,可参与多种疾病的进展,具有重要的生物学意义。lncRNA 和circRNA 作为常见的参与ceRNA 调控的RNA 分子,在肝脏I/R 损伤中的功能越来越受到重视。目前基于circRNA 的ceRAN 网络已有研究,Zhang 等[15]的研究首次表明circRNA 与肝脏I/R 损伤密切相关,并发现靶向mmu_circRNA_005186-miR-124-3p-Epha2 通路可能减轻肝脏I/R 损伤。然而基于lncRNA 的ceRAN 网络在肝脏I/R 损伤的研究还鲜有报道,因此应用生物信息学方法从基因表达数据库中挖掘差异基因,构建基于lncRNA 的ceRNA 调控网络,探索肝脏I/R 损伤的发生机制,同时基于这些差异基因从药物数据库筛选出潜在的治疗药物具有重要意义。
目前报道的肝脏I/R 损伤发生机制包括:无氧代谢、钙离子超载、氧化应激反应、线粒体结构功能的损坏、库普细胞激活和中性粒细胞的活化聚集、细胞因子作用、细胞凋亡与细胞自噬等[16-17]。在本研究中通过对差异基因的GO/KEGG功能富集分析发现,差异基因主要参与细胞死亡的正调控及对细胞外刺激反应的生物学过程,并参与MAPK信号通路的调控。这与目前的Zhang等[11]和Amersi等[18]的研究报道是一致的。ceRNA 调控网络作为一种精细而又复杂的基因表达调控模式,可参与多种疾病的发生发展。本研究最终获得9条ceRNA网络,分别是:XIST/MEG8/LINC00963/MALAT1-miR-32-5p-Btg2、XIST/NEAT1-miR-132-3p-Btg2、HSPA9P1/RALGAPA1P 1/RPS26P39-miR-9-5p-Dusp6。研究表明,MALAT1 及NEAT1 可能通过调节细胞凋亡和炎症而加重肝脏I/R损伤[19-20]。miR-9-5p 通过下调N-κB 亚基p65 的表达,保护肝脏免受I/R 损伤[21]。Zhang 等[11]的实验数据表明,与对照组相比,Dusp6 在I/R 组显著上调,在IPO 组显著下调。然而鉴定出的ceRNA 网络在肝脏I/R 中的功能仍需进一步的研究。
ceRNA 调控网络可在转录后水平实现对肝脏I/R损伤关键mRNA 的调控,但这些关键mRNA 的表达同样受转录水平的调控。转录因子作为一类DNA结合蛋白,可与基因启动子结合,实现对靶基因的调控。在本研究中,通过TRRUST 转录调控网络数据库分析获得6 个与肝脏I/R 损伤相关的转录因子,分别是:Trp53、Cebpb、Crebbp、Fos、Nfkb1及SP1。其中Trp53 也称为p53,是一种重要的肿瘤抑制基因,其介导的细胞信号转导途径在调节细胞正常生命活动中起重要作用。Fos 蛋白作为一类核蛋白转录因子,在调控细胞生长、分裂、增殖、分化乃至程序性死亡等方面具有重要的作用。Nfkb1 也称为p50,与RelA(p65)形成p50/RelA 二聚体,参与NF-кB经典信号通路的激活。在肝脏I/R损伤中的研究表明,Trp53、Fos 及Nfkb1 可调控细胞凋亡、自噬及炎症等参与肝脏I/R 损伤[22-24]。转录因子Sp1 在肿瘤组织中的异常表达和活化可参与调控肿瘤的增殖、血管生成和转移潜能,Cebpb(作为一种含有亮氨酸拉链结构域的转录因子)与Crebbp(CREB 结合蛋白)在血液系统肿瘤中发挥重要作用,但它们在肝脏I/R 损伤中功能仍有待研究。
天然药物作为一种自然界中存在的有药理活性的天然产物,一般地讲,其副作用比人工合成的化学药物要小的多,但也有些天然药物毒性较大。目前,多种天然药物及化学药物已报道可显著改善肝脏I/R 损伤[25-26]。如表1所示,目前已报道有26 种天然药物可显著改善肝脏I/R 损伤[27-53]。同时如表2所示,有22 种化学药物被报道可减轻肝脏I/R 损伤[54-78]。两种药物的作用机制相似,主要通过抑制炎症反应、氧化应激和细胞凋亡等发挥作用。为进一步获得潜在的可改善肝脏I/R 损伤的天然药物,本研究利用CTD 数据库分析筛选出7 种天然药物(槲皮素、白藜芦醇、染料木黄酮、香豆雌酚、姜黄素、辣椒素及东莨菪碱)可能对肝脏I/R 损伤具有一定治疗作用。其中槲皮素、白藜芦醇、染料木黄酮及姜黄素对于肝脏I/R 损伤的治疗作用已有证实。Wu 等[42]的研究表明,槲皮素预处理通过抑制ERK/NF-κB 途径减轻肝I/R 诱导的细胞凋亡和自噬;He 等[48]的研究发现,白藜芦醇可通过抑制TLR4/NF-κB 通路减弱炎症反应和细胞凋亡,从而改善肝脏I/R 损伤;Akinci 等[53]证明,染料木黄酮通过减少炎症因子TNF-α 及IL-6 的表达保护肝脏I/R 损伤;Wang 等[37]的研究表明,姜黄素通过抑制TLR4/NF-κB 途径来预防肝I/R 损伤。香豆雌酚、辣椒素及东莨菪碱已报道对脑I/R 损伤具有保护作用。Castro 等[79]的研究认为,香豆雌醇发挥神经保护作用的潜在机制可能与雌激素受体激活、抗氧化活性和其它介导雌二醇神经保护作用的膜受体的激活有关。Huang 等[80]发现辣椒素对皮质神经元的神经保护作用是TRPV1 依赖性的,NMDA 受体表达和功能的下调有助于辣椒素提供的保护作用。Wang 等[81]的研究表明东莨菪碱作为一种治疗心脏骤停的药物,通过减轻脑组织水肿和炎症反应,对心肺复苏后急性脑I/R 损伤具有保护作用。但香豆雌酚、辣椒素及东莨菪碱在肝脏I/R 损伤的作用暂无报道,这为今后肝脏I/R 损伤的治疗提供新的潜在治疗药物。
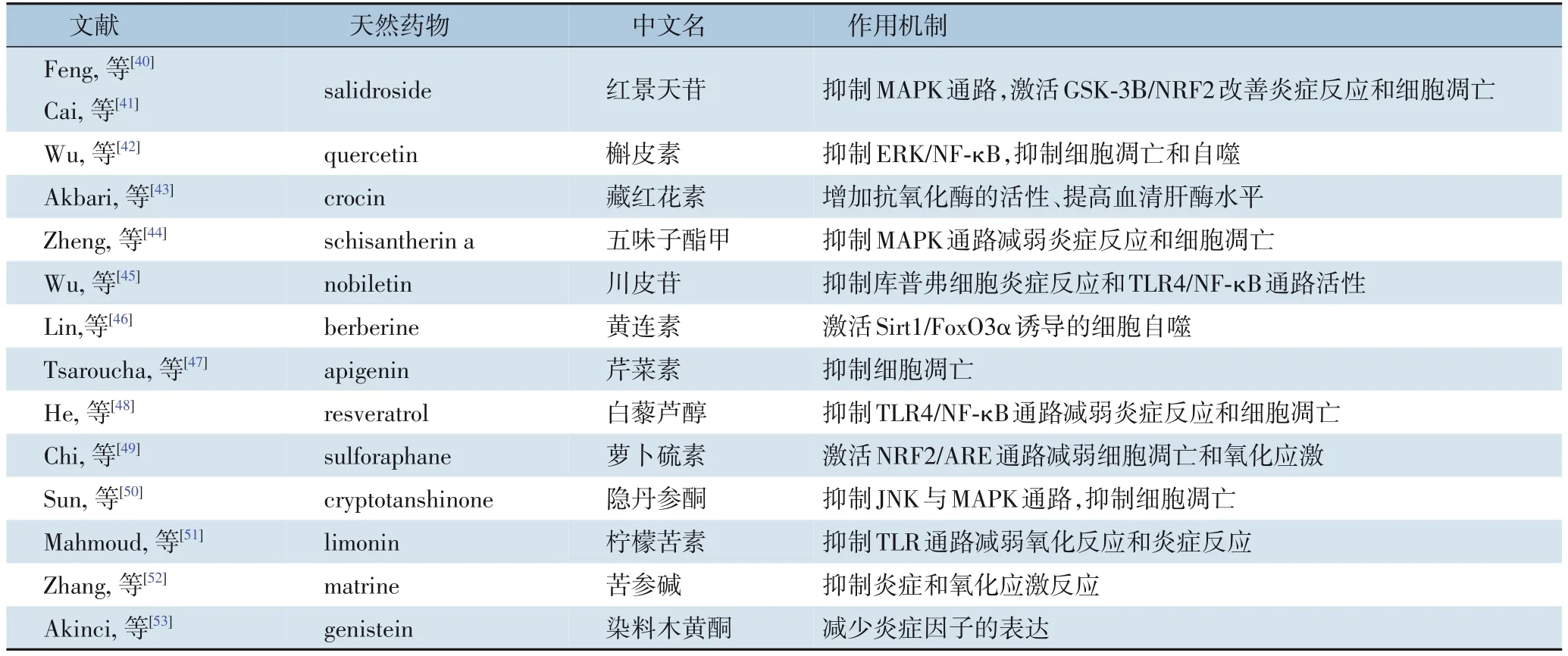
表1 改善肝脏I/R损伤的天然药物汇总(续)Table 1 Summary of natural medicines to improve liver I/R injury(continued)
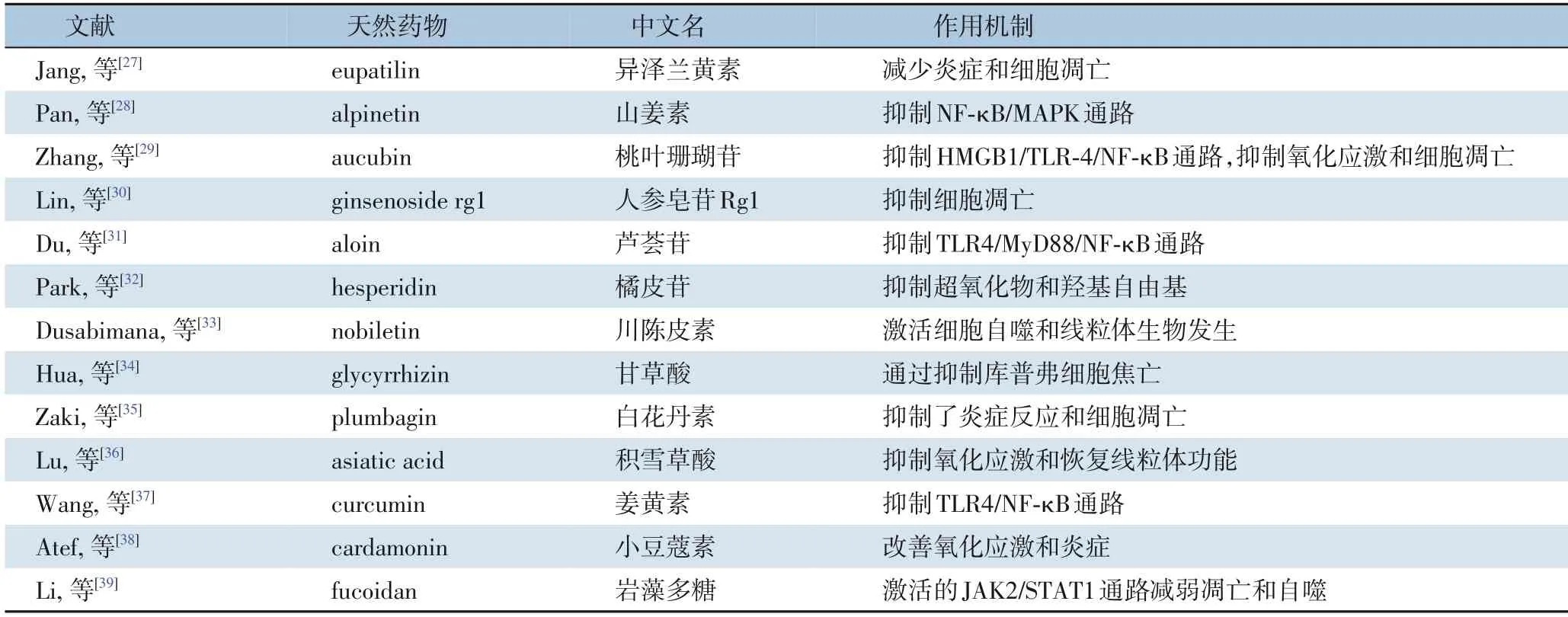
表1 改善肝脏I/R损伤的天然药物汇总Table 1 Summary of natural medicines to improve liver I/R injury
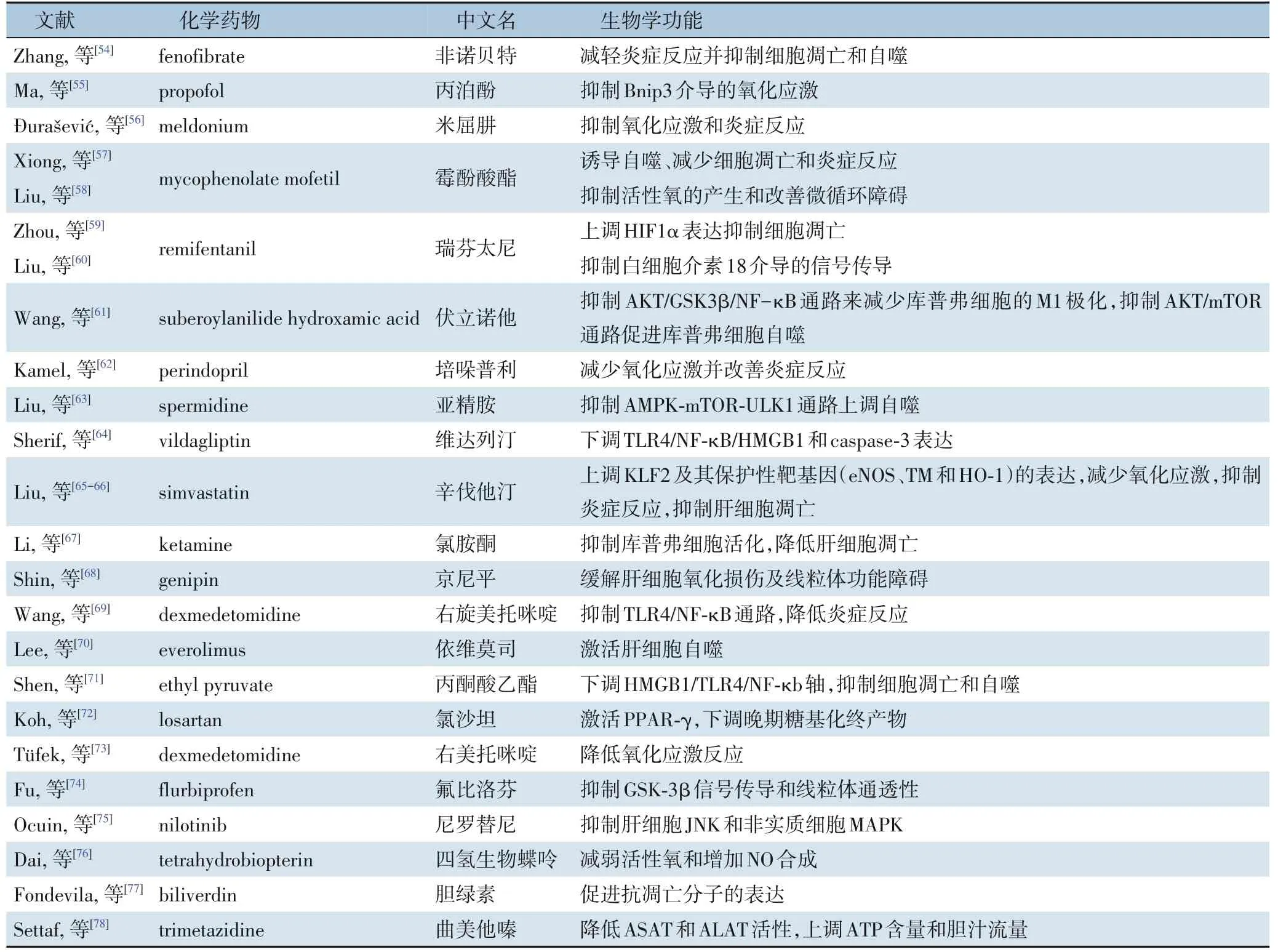
表2 改善肝脏I/R损伤的化学药物汇总Table 2 Summary of chemical drugs to improve liver I/R injury
综上所述,本研究通过生物信息学方法构建肝脏I/R 损伤过程中的关键ceRNA 网络,并筛选潜在治疗药物。同时本研究也具有一定的局限性,主要基于鼠类肝脏缺血再灌注的相关数据进行挖掘,与人类基因的相关表达可能有较大差异,同时获得的ceRNA 网络及潜在天然药物缺乏临床数据及实验数据的验证。但本研究可对未来进一步深入了解肝脏I/R 损伤的分子机制提供重要指导作用,并对未来临床治疗提供更多依据。

