miR-373靶向VEGFA对糖尿病视网膜病变大鼠的作用
郭 宁,阿依努·努拉厚,卜 倩,浏 梦,王 雁
0引言
糖尿病视网膜病变(DR)是糖尿病微血管常见并发症之一,导致患者视力受损。DR的特征是毛细血管周细胞早期丢失和基底膜增厚,导致内皮细胞过度增殖和血管生成,而血管内皮生长因子A(VEGFA)能够促进血管生成,VEGFA的异常表达水平可加重病理性血管生成和DR的发生[1]。目前DR的主要治疗手段有玻璃体腔注射抗VEGF药物、激光治疗、类固醇疗法及玻璃体切除术等[2]。但实践证明这些治疗手段仅可预防或暂时缓解视力丧失。因此,亟需探究DR治疗的新的治疗靶标和方法。微小RNA(miRNA)是一类小的非编码RNA,通过降解或阻断信使RNA翻译,在转录后水平调控靶基因的表达。研究表明,miRNA通过抑制炎症反应、视网膜新生血管形成及神经元凋亡和变性对DR的早期治疗具有一定作用[3-4]。另有研究发现miR-373与眼底疾病具有一定的相关性[5-6]。然而,miR-373是否参与DR发生发展目前罕见报道。此外,通过Mirtarbase网站预测到miR-373与VEGFA 3’UTR存在结合位点,因此,本研究主要探讨miR-373在DR视网膜组织中的表达及其靶向VEGFA对DR的影响。
1材料和方法
1.1材料
1.1.1动物健康SPF级雄性SD大鼠40只,体质量180~220g,7周龄,购买且饲养于新疆医科大学北校区动物实验中心[许可证号:SCXK(新)2018-0002,SYXK(新)2018-0003]。本研究符合动物实验伦理要求,经伦理委员会审批通过。
1.1.2主要试剂和仪器设备293T细胞购于无锡欣润生物科技有限公司;RPMI-1640、胎牛血清购于Gibco公司;苏木精伊红(HE)染色试剂盒、BCA试剂盒、DAB显色试剂盒购自北京索莱宝生物科技;miR-373 agomir、agomir-NC、miR-373 mimic、mimic-NC购于上海艾博思生物科技有限公司;突变型VEGFA 3’UTR、野生型VEGFA 3’UTR购于广州辉骏生物科技股份有限公司;Bcl-2相关X蛋白(Bax)、β肌动蛋白(β-actin)兔抗大鼠单克隆抗体(ab32503、ab115777)、VEGFA、B淋巴细胞瘤-2基因(Bcl-2)兔抗鼠多克隆抗体(ab46154、ab194583)购于美国Abcam公司;磷脂酰肌醇3-激酶(PI3K)、磷酸化-磷脂酰肌醇3-激酶(p-PI3K)、丝苏氨酸蛋白激酶(AKT)、磷酸化-丝苏氨酸蛋白激酶(p-AKT)兔抗大鼠多克隆抗体(GTX100462、GTX132597、GTX121937、GTX128414)、山羊抗兔HRP标记二抗(GTX213110-01)购于GeneTex公司;Dual-Luciferase Reporter System购于Promega公司;Lipofectamine 2000、TRIzolTM、SuperScript Ⅳ反转录酶、PowerUp SYBR Green预混液购于赛默飞世尔科技(中国)有限公司。主要仪器:血糖仪(上海罗氏制药有限公司);切片机(上海莱卡仪器有限公司);全自动酶标仪、ABI实时荧光定量PCR仪(美国Thermo Fisher Scientific公司);正立金相显微镜(日本Olympus公司)。
1.2方法
1.2.1造模、分组与给药将40只大鼠随机分为对照组(10只)和DR组(30只),DR组大鼠腹腔注射60mg/kg链脲霉素(STZ,10g/L)诱导糖尿病;对照组注射等量柠檬酸盐缓冲液。注射STZ 72h后,尾静脉取血检测血糖,血糖值≥16.7mmol/L提示糖尿病大鼠建模成功。将造模成功的大鼠随机分为模型组(10只)、miR-373 agomir组(10只)、agomir-NC组(10只),miR-373 agomir组和agomir-NC组大鼠分别于右眼玻璃体腔注射200μL miR-373 agomir(200nmol)和agomir-NC(200nmol),每周1次,共处理12wk;模型组大鼠右眼采用玻璃体腔注射200μL生理盐水,每周1次,共处理12wk。每月记录各组大鼠体质量,并通过血糖仪检测各组大鼠血糖值。
1.2.2HE染色观察视网膜病变情况处理12wk后,每组大鼠用30mg/kg戊巴比妥钠麻醉,摘取右眼眼球,并迅速剥离视网膜组织进行冷冻储存备用。经固定,常规石蜡包埋,切片,苏木精伊红染色,脱水,透明,中性树脂封固,镜下观察。
1.2.3RT-qPCR检测视网膜组织中相关mRNA表达水平处理12wk后,取每组大鼠视网膜组织100mg加入1mL TRIzolTM试剂,提取总RNA,合成cDNA,进行PCR反应。反应体系:cDNA 200ng;正向引物(10μmol/L) 0.5μl;反向引物(10μmol/L) 0.5μL;10×HA Buffer 2.0μL;2×PowerUp SYBR Green Master Mix 10μL;加入ddH2O至20μL。反应条件:预变性95℃ 5min 1个循环;变性94℃ 15s,退火58℃ 20s,延伸72℃ 1min,共40个循环;补充延伸72℃ 5min 1个循环。以U6和β-actin为内参,采用2-△△Ct进行相对定量分析。引物序列:miR-373上游引物5’-GCCAGAAGTGCTTCGATTTTG-3’,下游引物5’-GTGCAGGGTCCGAGGT-3’;U6上游引物5’-CTCGCTTCGGCAGCACA-3’,下游引物5’-AACGCTTCACGAATTTGCGT-3’;VEGFA上游引物5’-TGGCTCACTGGCTTGCTCTA-3’,下游引物5’-ATCCAACTGCACCGTCACAG-3’;β-actin上游引物5’-CTCCATCCTGGCCTCGCTGT-3’,下游引物5’-ACTAAGTCATAGTCCGCCTAGA-3’。
1.2.4双荧光素酶实验验证miR-373与VEGFA靶向关系将293T细胞接种到24孔板中,并使用Lipofectamine 2000将野生型VEGFA 3’UTR或突变型VEGFA 3’UTR与miR-373 mimic共转染至293T细胞,同时转染mimic-NC与野生型VEGFA 3’UTR或突变型VEGFA 3’UTR为对照,转染48h后,收集各组细胞裂解,并根据双荧光素酶报告基因检测试剂盒测量荧光素酶活性。相对荧光素酶活性=海肾荧光素酶活性/萤火虫荧光素酶活性。
1.2.5Western-blot检测视网膜组织中相关蛋白表达水平处理12wk后,取各组大鼠视网膜组织100mg,分别加入RIPA裂解液,离心,收集上清,采用BCA试剂盒测定蛋白含量。取50μg蛋白液进行SDS-PAGE电泳,PVDF转膜,封闭,分别加入一抗VEGFA(1∶500)、Bax(1∶2000)、Bcl-2(1∶2000)、PI3K(1∶2000)、p-PI3K(1∶2000)、AKT(1∶2000)、p-AKT(1∶2000)、β-actin(1∶10000)4℃过夜,加入二抗(1∶10000)室温孵育1h。ECL曝光成像,凝胶成像系统观察拍照,以Image J图像分析系统分析条带灰度值。以β-actin为内参,目的蛋白相对表达水平=目的蛋白条带灰度值/β-actin条带灰度值。
统计学分析:采用GraphPad Prism 7软件进行数据分析。计量资料采用均数±标准差表示,多组间比较采用单因素方差分析和重复测量数据的方差分析,两组间比较采用独立样本t检验,多组间或组内两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2结果
2.1DR大鼠模型评价造模前后,两组大鼠体质量和血糖浓度比较,差异均有统计学意义(体质量:F时间=56.147,P时间<0.001;F组间=1385.833,P组间<0.001;F交互=81.619,P交互<0.001;血糖浓度:F时间=99.852,P时间<0.001;F组间=760.987,P组间<0.001;F交互=119.360,P交互<0.001)。造模前,对照组大鼠体质量和血糖浓度与DR组差异均无统计学意义(P>0.05);造模4、8、12wk后大鼠无死亡,DR组大鼠体质量显著低于对照组(P<0.001),血糖浓度显著高于对照组(P<0.001),见表1。HE病理切片结果显示,对照组大鼠视网膜组织细胞排列整齐,结构清晰,无病理性变化,DR组大鼠视网膜水肿,细胞分层模糊且排列紊乱,提示DR大鼠模型建立成功,见图1。
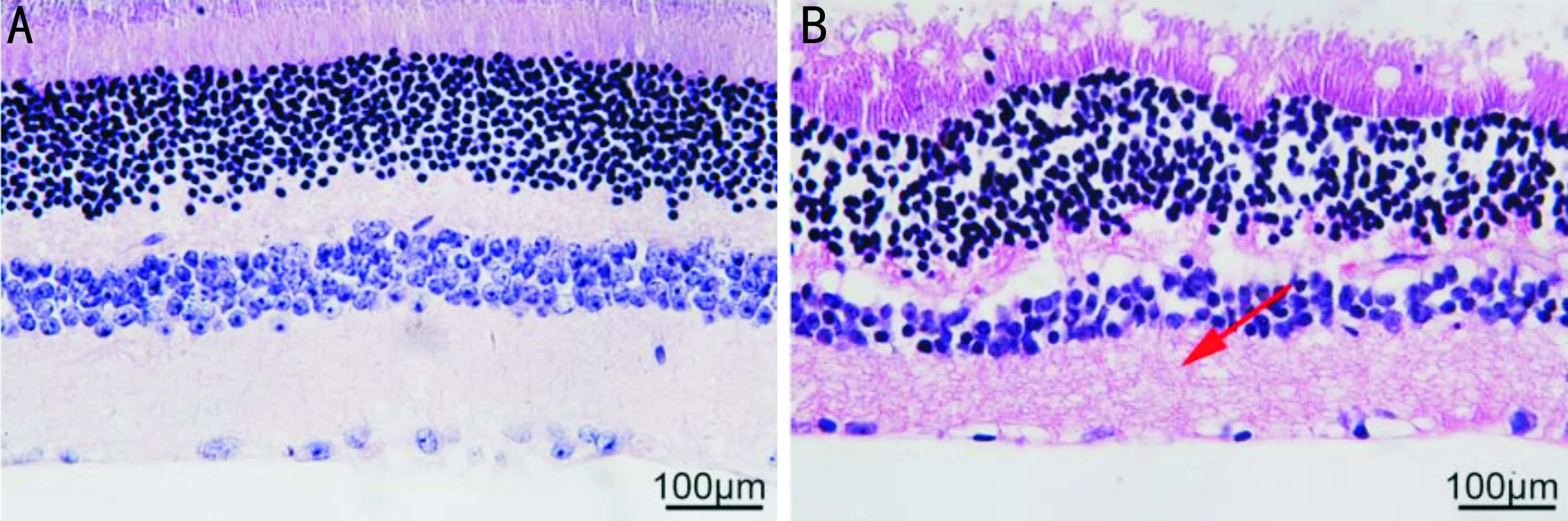
图1 两组大鼠视网膜病理切片结果 A:对照组;B:DR组,箭头表示细胞核固缩及组织排列紊乱。
表1 两组大鼠造模前后体质量及血糖浓度
2.2各组大鼠视网膜组织中miR-373和VEGFAmRNA表达水平对照组、模型组、agomir-NC组和miR-373 agomir组大鼠视网膜组织中miR-373表达水平(1.00±0.06、0.34±0.03、0.34±0.03、4.37±0.15)和VEGFA mRNA表达水平(1.00±0.09、3.54±0.17、3.52±0.19、1.50±0.24)比较,差异有统计学意义(F=5513.582、536.590,均P<0.001)。与对照组比,模型组和agomir-NC组大鼠视网膜组织miR-373表达水平显著下降,VEGFA mRNA含量显著升高(P<0.05);与agomir-NC组比,miR-373 agomir组视网膜组织miR-373表达水平显著升高,VEGFA mRNA含量显著下降(P<0.05),见图2。
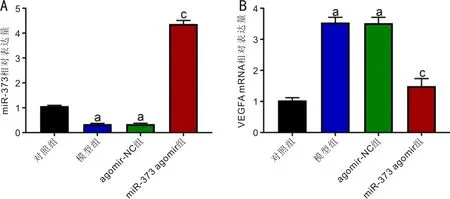
图2 各组大鼠视网膜组织中miR-373和VEGFA mRNA表达水平 A:miR-373表达水平;B:VEGFA mRNA表达水平。aP<0.05 vs 对照组;cP<0.05 vs agomir-NC组。
2.3miR-373对大鼠体质量和血糖浓度及视网膜组织病理变化的影响处理12wk后,agomir-NC组大鼠体质量为171.29±15.16g,血糖浓度为21.41±2.67mmoL/L,miR-373 agomir组大鼠体质量为264.62±14.02g,血糖浓度为17.22±0.30mmoL/L,与agomir-NC组比,miR-373 agomir组大鼠体质量显著升高(t=14.292,P<0.001),血糖浓度显著下降(t=4.927,P<0.001)。HE病理切片结果显示,视网膜组织水肿情况得到缓解,细胞分层较为清晰,且排列较为整齐,见图3。
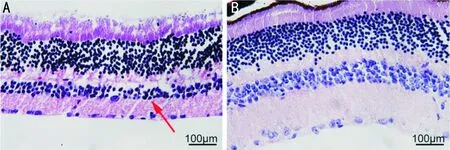
图3 miR-373 agomir对大鼠视网膜组织病理变化的影响 A:agomir-NC组,箭头表示细胞核固缩及组织排列紊乱;B:miR-373 agomir组。
2.4各组大鼠视网膜组织Bax和Bcl-2蛋白表达情况对照组、模型组、agomir-NC组和miR-373 agomir组大鼠视网膜组织Bax蛋白表达量(0.20±0.03、0.97±0.05、0.98±0.05、0.55±0.05)和Bcl-2蛋白表达量(1.00±0.06、0.22±0.02、0.23±0.03、0.46±0.04)比较,差异有统计学意义(F=197.155、243.227,均P<0.001)。与对照组比,模型组和agomir-NC组大鼠视网膜组织Bax蛋白表达量显著升高,Bcl-2蛋白表达量显著下降(P<0.05);与agomir-NC组比,miR-373 agomir组大鼠视网膜组织Bax蛋白表达量显著下降,Bcl-2蛋白表达量显著升高(P<0.05),见图4。
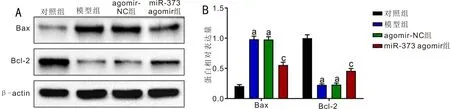
图4 各组大鼠视网膜组织中Bax和Bcl-2蛋白表达情况 A:Western-blot检测结果;B:Western-blot检测结果量化分析。aP<0.05 vs 对照组;cP<0.05 vs agomir-NC组。
2.5miR-373靶向VEGFA 通过Mirtarbase网站(http://mirtarbase.cuhk.edu.cn/php/index.php)预测到miR-373与VEGFA 3’UTR存在结合位点。双荧光素酶实验显示,miR-373 mimic显著抑制野生型VEGFA 3’UTR荧光素酶活性,对突变型VEGFA 3’UTR荧光素酶活性无影响(图5A)。Western-blot结果显示,对照组、模型组、agomir-NC组和miR-373 agomir组大鼠视网膜组织VEGFA蛋白表达量(0.19±0.03、0.96±0.07、0.96±0.06、0.34±0.04)比较,差异有统计学意义(F=205.045,P<0.001),与agomir-NC组比,miR-373 agomir组VEGFA蛋白表达水平显著下降(P<0.05),见图5B。

图5 miR-373靶向VEGFA A:双荧光素酶实验检测结果,aP<0.05 vs mimic-NC组;B:Western-blot检测结果,aP<0.05 vs 对照组;cP<0.05 vs agomir-NC组。
2.6miR-373对PI3K/AKT信号通路的影响对照组、模型组、agomir-NC组和miR-373 agomir组大鼠视网膜组织PI3K蛋白表达量(1.12±0.04、1.03±0.11、1.02±0.11、1.02±0.10)和AKT蛋白表达量(0.93±0.09、0.90±0.10、1.00±0.10、1.00±0.10)差异无统计学意义(F=0.755、0.806,均P>0.05),p-PI3K蛋白表达量(0.10±0.01、0.80±0.10、0.74±0.07、0.38±0.02)和p-AKT蛋白表达量(0.10±0.01、1.20±0.10、1.20±0.12、0.40±0.04)差异有统计学意义(F=83.216、145.211,均P<0.001)。与对照组比,模型组和agomir-NC组大鼠视网膜组织PI3K、AKT蛋白表达水平无显著变化,p-PI3K、p-AKT蛋白表达水平显著升高(均P<0.05);与agomir-NC组比,miR-373 agomir组大鼠视网膜组织PI3K、AKT蛋白表达水平无显著变化,p-PI3K、p-AKT蛋白表达水平显著下降(均P<0.05),见图6。
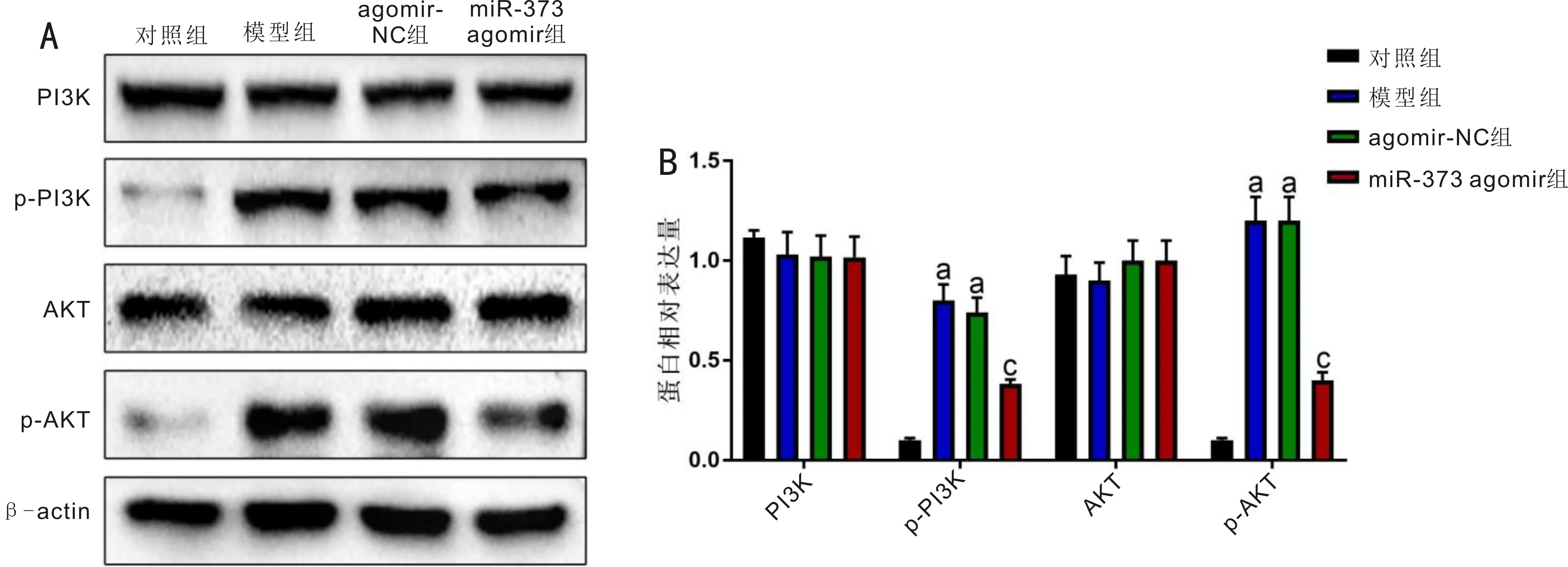
图6 miR-373对PI3K/AKT信号通路的影响 A:Western-blot检测结果;B:Western-blot检测结果量化分析。aP<0.05 vs 对照组;cP<0.05 vs agomir-NC组。
3讨论
在我国,DR的发病率和患病率逐年上升,以毛细血管周细胞减少、内皮细胞/基底膜增厚及血管新生为主要临床特征,可分为增殖性和非增殖性糖尿病视网膜病变,其中增殖性糖尿病视网膜病变是导致25~65岁人群失明和视力损害的主要诱因[2]。目前研究表明DR的发病机制极为复杂,涉及炎症、神经元调亡、细胞增殖、分化等多种病理过程,其具体机制仍需进一步阐明[7]。目前,许多研究证实miRNA参与DR发生与发展,且可能成为DR的新生物标志物[8-11]。如miR-204通过调节沉默信息调节因子1(SIRT1)的表达,抑制DR大鼠的炎症反应和细胞凋亡[8]。在DR体外模型中,miR-199a-3p通过靶向VEGF/PI3K/AKT信号通路抑制血管生成,miR-590-3p通过靶向NLRP1抑制NADPH氧化酶(NOX4)信号通路的激活,减少细胞焦亡[9-10]。Liu等[11]研究表明2型糖尿病(T2DM)诱发的DR患者血清中miR-221的表达明显升高,与糖化血红蛋白等代谢参数显著正相关,且对DR的诊断准确性高于血管紧张素Ⅱ(Ang Ⅱ)和VEGF。
miR-373位于染色体19q13.4.21,属于miR-520/miR-373家族,该家族由3个不同的miRNA簇组成,分别是miR-302/miR-367、miR-371/miR-372/miR-373和miR-520[12]。越来越多的证据表明,miR-373可以通过调控特定基因在人类癌症中发挥癌基因或抑癌基因的作用[13-14]。糖尿病视网膜细胞凋亡的分子基础涉及促凋亡和抗凋亡的基因,Bax是视网膜神经元凋亡的关键因素,也是保护受损视网膜神经元的治疗性基因策略的靶点之一。Bcl-2与视网膜神经细胞凋亡有关,Bcl-2与Bax的表达比例对决定细胞寿命至关重要[15]。本研究结果表明,miR-373在DR大鼠视网膜组织中表达量下调,视网膜组织Bax蛋白表达显著增加,Bcl-2蛋白表达显著减少;过表达miR-373后,可以明显降低DR大鼠血糖,抑制视网膜组织Bax蛋白表达并促进Bcl-2蛋白表达,抑制视网膜细胞凋亡,改善DR。与Teng等[16]研究结果相同,该研究报道过表达miR-373可抑制细胞凋亡。结合Yang等[5]和Tian等[6]研究结果,我们推测miR-373可能参与DR的发病过程,上调miR-373表达可改善DR。VEGFA属于VEGF家族,在血管生成、肿瘤生长及缺血性疾病中扮演着重要角色,与其受体结合,激活PKC、NOS、AKT、MAPK等途径诱导血管生成。同时,也有研究表明VEGFA在DR视网膜组织中可以通过促进新生血管形成,从而促使DR发生发展[17]。VEGF抑制剂如雷珠单抗、阿柏西普、康柏西普等因具备促使视网膜新生血管萎缩,改善视功能预后等功能,目前在临床上被广泛应用。本研究通过生物信息学网站预测到miR-373可以与VEGFA的3’UTR区互补结合,并且应用双荧光素酶实验验证了VEGFA是miR-373的直接靶点。提示miR-373可能通过下调VEGFA表达阻碍DR发生发展。结合Oltra等[18]研究结果表明采用miRNA降低VEGF可以作为治疗DR的一种方法。
PI3K/AKT信号通路参与细胞的增殖、凋亡和分化,是体内重要的细胞信号通路,同时在葡萄糖转运、糖原合成、糖酵解和糖异生的调节中也发挥重要作用。Fang等[19]研究指出根据KEGG通路数据库的预测可知,VEGF位于PI3K/AKT通路的下游,且Simó等[20]研究表明胰岛素通过激活PI3K/AKT通路诱导小鼠主动脉平滑肌细胞内VEGF转录和表达,从而引起DR恶化。本研究发现DR大鼠过表达miR-373后,p-PI3K、p-AKT及VEGFA蛋白表达水平显著下调。上述结果提示,miR-373通过下调VEGFA的表达并抑制PI3K/AKT通路蛋白的表达,从而改善DR。这与Wang等[9]研究结果一致。
综上所述,本研究在动物水平上表明miR-373通过靶向VEGFA参与DR的病理生理过程,其机制可能与miR-373抑制PI3K/AKT信号通路有关,提示miR-373可能成为治疗DR的一个潜在的新靶点。
- 国际眼科杂志的其它文章
- Safety and efficacy of 25G anterior vitrectomy in glaucoma and cataract with extremely shallow anterior chamber
- HMGA1在葡萄膜黑色素瘤中的表达及对细胞增殖和侵袭的影响
- 电针对透镜诱导型近视豚鼠脉络膜血流和内皮素-1及其受体表达的影响
- The distribution characteristics of retinal nerve fiber layer thickness in macular area and its relationship with vessel density in highly myopic eyes
- 高度近视行Trans-PRK术中联合MMC对术后haze的影响
- 成纤维活化蛋白在眼睑基底细胞癌相关成纤维细胞中的表达研究

