成纤维活化蛋白在眼睑基底细胞癌相关成纤维细胞中的表达研究
周金蕙,王 宁,母强元,刘 朱,王大庆
0引言
基底细胞癌(basal cell carcinoma, BCC)是人类最常见的恶性肿瘤之一[1],也是眼睑部位最常见的恶性上皮源性肿瘤,约占眼睑恶性肿瘤的90%,多见于60~80岁老年人,好发于下睑(50%)[2-6]。眼睑BCC易出现倒睫、睑内翻等并发症,因而属于高危型BCC。大量研究证实,紫外线、放射线及遗传因素等均是导致眼睑BCC发生的危险因素[7-8]。原癌基因异常激活或抑癌基因失活,多种相关蛋白、细胞因子等发生改变,均可导致细胞过度增殖、分化, 凋亡受阻, 最终引发肿瘤[9],但其确切发病机制尚不清楚。
正常情况下,细胞外基质是抗肿瘤形成的屏障。但当细胞发生癌变时,其周围邻近的细胞外基质(extracellular matrix, ECM)也会发生相应的变化以支持癌症的发展[10-11],从而被称之为肿瘤微环境(tumor microenvironment, TME)[12]。肿瘤的发生、发展与其微环境改变的相关性在众多研究中得到了验证[12-14],其中癌相关成纤维细胞(carcinoma-associated fibroblasts, CAFs)是存在于肿瘤微环境中最丰富的细胞类型之一,其主要功能是提供并维持良好的肿瘤细胞生长和增殖的微环境,从而在肿瘤的增殖、侵袭、转移及血管生成过程中起关键作用[10,13-15]。
成纤维活化蛋白(fibroblast activation protein,FAP)是CAFs 最具代表性的分泌产物之一,在90%以上的上皮细胞癌CAFs和部分肿瘤细胞中高水平表达,而在人类正常组织中几乎不表达,已有研究表明FAP的高表达与大部分肿瘤的侵袭转移具有一定的相关性[12,16]。眼睑BCC发病率高,具有侵袭性生长的特点,但其恶性程度和转移性较低[17],其微环境中CAFs表达FAP的情况以及FAP在其侵袭性生长中的作用尚不明确。因此,为了回答上述问题,本研究经原代细胞培养获得眼睑基底细胞癌CAFs及正常成纤维细胞(normal fibroblasts,NFs),然后检测FAP在两种细胞中的表达情况,以期进一步探讨FAP在人眼睑基底细胞癌CAFs中的作用,探索影响眼睑BCC发生、发展的关键因素,为BCC的预防、早期诊断及治疗提供理论依据及新思路。
1材料和方法
1.1材料
1.1.1标本来源选取川北医学院附属医院眼科2016-10/2017-05期间收治的拟行眼睑基底细胞癌切除术和老年性眼睑皮肤松弛症矫正术共6例6眼患者的组织标本作为研究对象。其中3例3眼眼睑BCC患者(图1A)为CAFs标本来源;3例3眼老年性眼睑皮肤松弛症患者(图1B)为NFs标本来源,组织标本均经术后病理证实。6例患者均无创伤及其他部位肿瘤等疾患,年龄为47~80岁,男女比例为1∶2,符合标本来源均衡性(P<0.05)。本研究经本院伦理委员会审批通过,组织标本的收取均获得患者的知情同意并签署知情同意书。
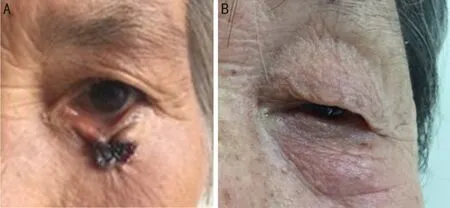
图1 标本来源 A:CAFs标本来源;B:NFs标本来源。
1.1.2主要实验材料主要试剂:高糖DMEM培养基(H-DMEM)、0.25%胰蛋白酶(美国Hyclone公司), 胎牛血清(FBS,美国Gibco公司),RNA提取试剂(TRIzol)(北京Leagene生物有限公司),逆转录试剂盒、RT-PCR试剂盒(Thermo),兔抗人波形蛋白(vimentin,VIM)单克隆抗体、鼠抗人细胞角蛋白(cytokeratin,CK)(广谱)单克隆抗体(北京中杉金桥生物技术有限公司),鼠抗人α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)单克隆抗体、兔抗人成纤维细胞活化蛋白(fibroblast activation protein,FAP)多克隆抗体(英国Abcam公司),鼠抗人β-actin抗体、山羊抗兔/小鼠IgG/HRP聚合物(杭州华安生物科技公司)。主要仪器设备:生物安全柜(BSC-1000 II A2,苏净安泰公司,中国)、二氧化碳细胞培养箱(CCL-170B-8,ESCO,印尼)、倒置相差显微镜(DM1L,Leica,德国)、实时定量PCR仪(11491,Roche,瑞士)、酶标仪(iMark,BIO-RAD,日本)、电泳仪(PowerPacTMHC,BIO-RAD,新加坡)、电转仪(Trans-Blot SD Cell,BIO-RAD,美国)、Fusion曝光仪(Vilber Fusion solo4,Vilber,法国)。
1.2方法
1.2.1标本的收集和处理从川北医学院附属医院眼科手术室在无菌条件下完整切取新鲜基底细胞癌组织和正常眼睑皮肤组织,尽可能不破坏组织完整性,将其放置于预先加入少许合成培养基的无菌1.5mL离心管中,用含冰袋的保温箱低温迅速转移至实验室超净工作台。所有标本取材均由同一位有经验的术者操作。
1.2.2CAFs及NFs细胞原代培养及细胞处理用含0.1%双抗的PBS溶液反复清洗标本3次,置于细胞培养皿中剪去除多余上皮和脂肪组织,将剩余的组织分成大小约1mm3的小块后播种于含4mL合成培养基的培养瓶中,平放在含5% CO2的37℃ 恒温细胞孵育箱中培养原代细胞。早期每天用倒置相差显微镜观察培养情况,每2~3d换液。当细胞生长铺满瓶底时,采用胰酶差速消化法进行细胞传代和纯化,使用第3~6代纯化细胞进行实验研究。
1.2.3观察细胞并鉴定细胞倒置相差显微镜下,观察第3代纯化的眼睑CAFs和NFs细胞形态,拍摄图片。细胞免疫化学染色(SP法)鉴定两种细胞,步骤如下:爬片:将5.0×103个CAFs和NFs接种于酸预处理置于6孔板中的无菌载玻片上;固定:载玻片浸入4%多聚甲醛中室温固定30min;破膜:0.5% Triton X-100溶液处理15min;灭活:3% H2O2灭活内源性过氧化物酶室温处理30min;封闭:正常山羊血清封闭液室温孵育30min;一抗孵育:滴加用PBS液稀释的一抗(稀释比例均为1∶100),湿盒,4℃过夜孵育;二抗孵育:滴加山羊抗兔/小鼠 IgG/HRP 聚合物(稀释比例均为1∶100),37℃避光孵育30min;显色:滴加DAB显色液(按DAB试剂盒说明临时配制使用,原液与稀释液比例为1∶50),3~5min,自来水洗涤终止;复染:苏木素染核;脱水、透明、封片,显微镜观察并拍照记录结果。
1.2.4细胞生长增殖活力测定将眼睑CAFs和NFs分别接种于96孔板中(4.0×103个/孔),每例细胞设置6个复孔,置于37℃含5% CO2细胞培养箱中继续培养。每隔24h,取出一块96 孔板,向每孔加入20μL 0.5% MTT溶液,作用4h后吸除含MTT溶液的上清液,加入150μL DMSO后置于酶联免疫检测仪上,避光震荡10min使紫色结晶物充分溶解,选择490nm波长,检测其吸光光度值(OD值);按以上步骤连续进行7d,记录数据,并进行统计学分析,绘制生长曲线。
1.2.5实时定量聚合酶反应用TRIzol处理细胞提取总RNA后逆转录合成cDNA。RT-qPCR循环条件为:初始变性(95℃下10min)、40次变性(95℃下15s)、退火(60℃下60s)、延伸(60℃下60s)。引物序列如下:FAP mRNA引物序列:上游引物:5’-TAG AAC CAT GCT TTG GAG ATA CT- 3’;下游引物:5’-CAA CAG GCG ACC AGC ATA AA- 3’。β-actin引物序列:上游引物:5’-ACA GAG CCT CGC CTT TGC C- 3’;下游引物:5’-GAT ATC ATC ATC CAT GGT GAG CTG G- 3’。以β-actin作为内参对照标准进行定量分析。使用公式2-△△Ct获得实验组样本基因的相对表达量。
1.2.6蛋白免疫印迹分析用RIPA裂解缓冲液提取蛋白,使用BCA蛋白分析试剂盒测定总蛋白含量。用10% SDS-PAGE分离等量蛋白质,然后将蛋白带转移到膜上。在4℃条件下,与一抗抗体(稀释比例:FAP 1∶3000,β-actin 1∶1000)轻轻摇匀共同孵育一夜。添加二抗抗体(稀释比例:羊抗兔二抗 1∶10000,羊抗鼠二抗 1∶2000),在室温下孵育1h。采用Fusion FX5程序曝光显影对其免疫反应进行检测和分析,引入β-actin作为内参对照。应用Image J软件对所获得的条带灰度值进行统计分析。
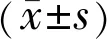
2结果
2.1眼睑CAFs和NFs的细胞培养和分离及纯化结果在原代培养第3d可见上皮细胞和CAFs从癌组织块边缘爬出,癌上皮细胞呈团状生长,CAFs排列紧密,呈放射状生长,约7d铺满瓶底;NFs组细胞生长相对缓慢,原代培养第5~7d组织块边缘可见少量的上皮细胞和NFs,NFs形态规则,排列稀疏,约11~13d铺满瓶底。待细胞铺满瓶底经胰酶差速消化法传代与纯化后,CAFs和NFs在形态上均未发生明显改变,上皮细胞消失,原代CAFs生长速度明显快于NFs。
2.2眼睑CAFs及NFs的初步鉴定结果
2.2.1细胞形态学观察结果倒置显微镜下可见,眼睑CAFs体积较大,呈长梭形或纺锤形,胞质突明显减少,而胞浆内具有较多颗粒,细胞大小差异明显,生长较快,排列紊乱且密集,丧失接触抑制和密度抑制,存在明显的重叠生长现象(图2A);NFs呈扁平长梭形,胞浆内颗粒较少,细胞大小相对均一,分散排列,存在接触抑制和密度抑制现象(图2B)。
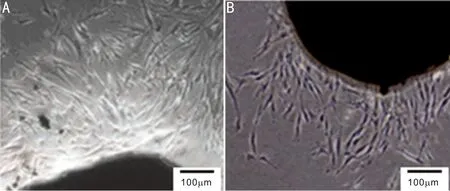
图2 细胞培养 A:CAFs从组织块边缘呈放射状爬出,细胞较紧密,出现重叠现象;B:NFs从组织块边缘散在爬出,细胞较松散,未见紧密接触。
2.2.2免疫细胞化学检测结果FAP、VIM、α-SMA、CK在细胞中阳性表达主要表现为胞质中出现淡棕色或棕黄色颗粒。免疫化学染色结果示:CAFs组: FAP、VIM、α-SMA呈阳性,CK呈阴性(图3A~D);NFs组:除了阳性表达VIM外,其余均为阴性表达(图3E~H)。
图3 免疫细胞化学染色 CAFs:A:CK呈阴性表达, B:VIM呈阳性表达,C:α-SMA呈阳性表达,D: FAP呈阳性表达;NFs:E:CK呈阴性表达,F:VIM呈阳性表达,G:α-SMA呈阴性表达,H:FAP呈阴性表达。
2.3细胞生长增殖活力检测结果两组间OD值比较差异有统计学意义(F组间=1882,P组间<0.0001;F时间=1464,P时间<0.0001;F组间×时间=323.5,P组间×时间<0.0001),见表1。绘制细胞生长曲线,并在细胞对数生长期以y分别为0.27、0.54划线,其与细胞生长曲线交叉点x的差值分别表示CAFs和NFs的群体倍增时间,即Tc=4.39-1.01=3.38d、Tn=5.06-1.01=4.05d。通过绘制细胞生长曲线及倍增时间比较可见CAFs增殖速度相对更快,且呈持续增长状态,但其在第4d后增速逐渐减缓;而NFs于第5d细胞数达峰值后开始逐渐减少,见图4。在第2~7d的增殖活力测定中,CAFs及NFs两者之间同一天内的增殖能力比较差异有统计学意义(P<0.01)。
表1 细胞生长增殖活力MTT法检测结果
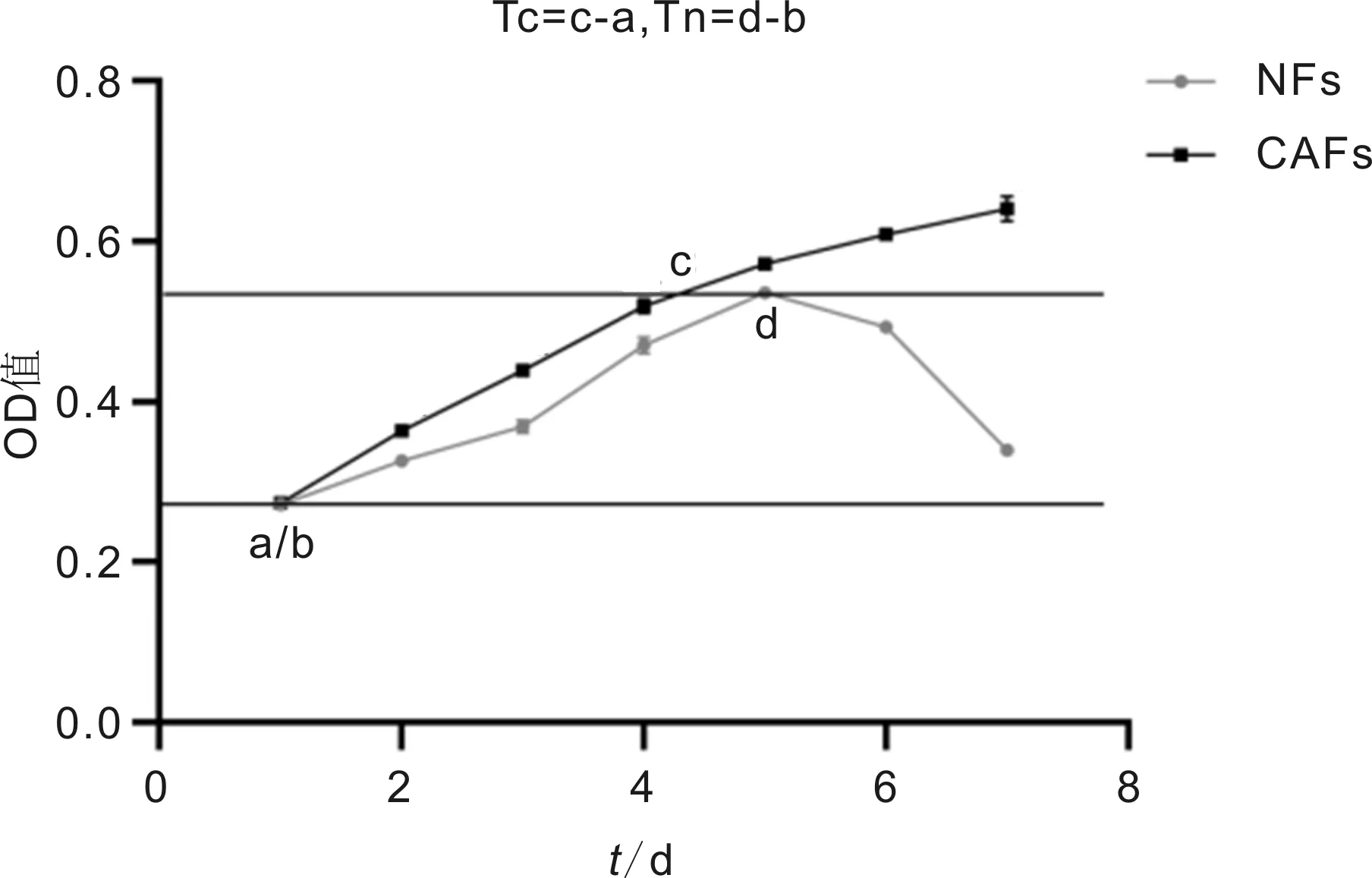
图4 CAFs与NFs生长曲线比较图。
2.4RT-qPCR法检测两种细胞中FAPmRNA含量统计分析结果显示眼睑CAFs中FAP mRNA扩增含量(3.672±0.221)明显高于眼睑NFs含量(1.034±0.024),差异具有统计学意义(t=21.58,P=0.002),见图5。

图5 FAP mRNA相对表达水平比较。
2.5WesternBlot检测FAP蛋白表达结果Western Blot法检测两种细胞中FAP蛋白的表达结果示CAFs表达较高水平的FAP,而NFs几乎不表达FAP(图6A)。统计分析结果示,FAP在CAFs中的表达量明显高于NFs,两者之间的差异具有统计学意义(t=11.720,P=0.007),见图6B。

图6 FAP蛋白表达水平 A:具有代表性的FAP蛋白水平的Western Blot图像;B:用三个独立实验的总结数据对免疫印迹进行定量分析。
3讨论
肿瘤或癌的发生、发展是多种因素共同作用的结果,许多证据表明,肿瘤的发生、发展与肿瘤微环境变化紧密相关[18-19]。大量研究表明,CAFs是肿瘤微环境中最重要、最丰富的间质细胞之一,其存在有利于合成更多的细胞外基质蛋白质,为肿瘤的生长、侵袭等提供更有利的物质条件,故而也被认为是肿瘤发生、发展、转移和侵袭的关键调节因素之一[20]。FAP是Ⅱ型跨膜丝氨酸蛋白酶,属于二肽基肽酶家族一员,具有二肽基肽酶和内肽酶双重蛋白水解酶活性,其内肽酶活性可降解肿瘤组织细胞外基质,参与细胞外基质的重塑,在多种人类恶性上皮肿瘤CAFs中高表达,也在部分肿瘤细胞中表达[8],通过不断释放促肿瘤生长和促血管生成介质,介导上皮间质转化并抑制免疫应答,参与肿瘤的生长、侵袭、转移,并与部分患者的不良预后密切相关[11-12, 16]。眼睑BCC以局部侵袭性生长为特征,但恶性程度和转移性均较低,所以本次我们探讨了其微环境中CAFs表达FAP的情况以及FAP在其侵袭性生长中的作用。
本实验采用组织块贴壁法,成功获得了纯化的原代眼睑CAFs与NFs,并对CAFs的生物学特性进行了初步鉴定,发现CAFs呈纺锤形或长梭形,胞质突减少,增殖速率更快,存活能力更强,排列紧密,可重叠生长,丧失了接触抑制现象,分泌更多骨膜蛋白、生长因子等,与NFs存在明显的不同,这些差异与国内外文献报道相似[21-22]。除了形态学特征改变之外,还需要使用细胞的特异性蛋白进行免疫细胞化学染色来鉴定两种细胞。因为CAFs是肿瘤间质中活化的成纤维细胞,具备平滑肌细胞和成纤维细胞双重特征,所以它们既表达肌纤维母细胞特异标记α-SMA、FAP等[19,23-25],又表达成纤维细胞标志物VIM[26],但上皮细胞标志物CK为阴性表达[27-28]。因此,我们选用既往研究中常见的α-SMA、FAP、VIM及CK作为CAFs检测指标,运用免疫细胞化学方法对眼睑CAFs及NFs进行了鉴定。实验结果显示:眼睑CAFs表达α-SMA、FAP及VIM均阳性,CK为阴性;NFs除表达VIM阳性外,其余均阴性。其中α-SMA和FAP已被证实在体外培养的NFs中无表达或极低表达,免疫细胞化学染色技术不能发现,但RT-qPCR方法可能检出[29],本实验的结果与国内外研究结果一致[30]。
我们通过MTT实验检测发现,CAFs较NFs具有更强的生长增殖及存活能力(P<0.05),其群体倍增时间明显较NFs缩短,表明肿瘤组织中CAFs呈激活状态,与NFs正常表型存在明显差异,本实验的结果与我们前期的研究结果一致[22]。然后,我们进一步通过RT-qPCR实验发现,眼睑基底细胞癌CAFs中FAP mRNA扩增水平明显高于NFs(P<0.05);且Western Blot实验发现眼睑CAFs高表达FAP,而NFs不表达FAP(P<0.05),与国内外许多相关研究结果一致[11,23,31-33],提示眼睑基底细胞癌肿瘤微环境发生了变化,进一步诱导NFs生物学特性和功能发生变化,最终转变为CAFs。以上分析结果表明,眼睑基底细胞癌CAFs中FAP表达增强可能与其生长增殖特性改变以及浸润性生长有关。
目前关于FAP与CAFs相关的研究结果大多来源于一些恶性程度高、转移性强且范围广的肿瘤类型,如乳腺癌[32]、胃癌[34]、结直肠癌[35]等。不同来源的肿瘤和不同区域肿瘤的CAFs的表型组成不同,因此其形态、功能具有异质性[33]。多数研究认为FAP促进肿瘤生长、转移、侵袭,但也有研究发现FAP-a除了发挥其酶的活性外,还具有非酶功能,认为其在肿瘤发生发展过程中可能具有抑制作用[33]。有研究发现FAP可能参与FAK、PTEN/PI3K/Akt和Ras-ERK信号通路调控细胞增殖、迁移、侵袭及转移[32-33]。
本实验通过对比研究发现眼睑BCC与正常眼睑皮肤组织中相关成纤维细胞生物学特性以及FAP的表达存在明显差异,这说明肿瘤微环境中成纤维细胞已经发生生物学特性和分泌功能的变化,并参与基底细胞癌的发生发展。FAP作为CAFs特异性的标记蛋白,其在眼睑基底细胞癌表达明显增高,推测其可能与CAFs的生长增殖特性改变以及眼睑基底细胞癌的浸润性生长有密切联系,可能是眼睑基底细胞癌病因及防治的新靶标,但其具体作用机制有待进一步深入研究。

