HMGA1在葡萄膜黑色素瘤中的表达及对细胞增殖和侵袭的影响
明 媚,张 劲,罗 钢,蔡丽英,梅 雪
0引言
葡萄膜黑色素瘤(uveal melanoma,UM)作为成人眼部最为常见的起源于葡萄膜的恶性肿瘤,发病率高居眼部肿瘤的第二位,且近年来呈上升趋势[1]。尽管现有诊疗手段不断进步,但患者总体生存率依然较低,预后不佳[2]。研究发现,高增殖活性及易发生眼外转移是导致该肿瘤诊疗困难及死亡率高的主要原因,有超过90%的患者死于肝转移[3]。高迁移率族蛋白A1(high mobility group A1,HMGA1)作为一种核蛋白,在细胞分化、转移、胚胎形成及调控基因转录中发挥重要作用[4],研究发现HMGA1蛋白在多种恶性肿瘤组织中呈高表达[5]。亦有研究指出,HMGA1参与了肿瘤细胞增殖及侵袭过程[6],但其在UM中的作用鲜有报道。本研究分析UM组织中HMGA1蛋白表达,并观察其与人UM细胞系M23增殖、迁移和侵袭的相关性,以期为UM的病理机制研究提供基础资料。
1对象和方法
1.1对象选取2014-02/2019-08在我院接受手术治疗的UM患者53例53眼,其中男29例29眼,女24例24眼;年龄28~76(平均48.36±11.14)岁;眼别:左眼25例,右眼28例;发生部位:睫状体18眼,脉络膜35眼;病理学类型:上皮细胞型19眼,梭形细胞型25眼,混合型9眼;35眼出现巩膜浸润。所有患者术前未行放化疗治疗,均行病理学检查确诊,于眼球摘除后,剥离肿瘤组织,甲醛固定,石蜡包埋保存。同期,留取因外伤摘除眼球的正常葡萄膜组织34例34眼,其中男20例,女14例,年龄26~77(平均48.07±10.92)岁;眼别:右眼19例,左眼15例。所有患者排除UM和其他肿瘤。两组患者性别、年龄、眼别差异均无统计学意义(P>0.05),均衡可比。本研究通过医院伦理委员会批准,入选对象均知情同意。
1.2方法
1.2.1主要试剂和设备免疫组织化学试剂盒及试剂购自北京中杉金桥生物技术有限公司,兔抗人HMGA1多克隆抗体购自英国Abcam公司,人UM细胞系M23购自上海烜雅生物科技有限公司,胎牛血清购自杭州四季青生物工程有限公司,RPMI1640培养液、青霉素-链霉素购自美国Gibco公司,HMGA1干扰序列和阴性对照序列由上海美轩生物科技有限公司提供,HMGA1和内参引物由上海生工生物公司设计合成,Trizol总RNA提取试剂盒和转染试剂盒购自美国Invitrogen公司,逆转录和PCR试剂盒购自大连宝生物工程有限公司,CCK-8试剂购自武汉博士德生物工程有限公司,Transwell小室购自上海夏夷实业有限公司,Matrige基质胶购自美国BD公司,StepOnePlus实时荧光定量PCR仪购自美国ABI公司。
1.2.2免疫组织化学法检测组织中HMGA1蛋白表达取组织石蜡标本,按4μm厚度连续切片,脱腊、水化,浸入枸橼酸盐缓冲液行加热处理,PBS冲洗3次,浸入3%过氧化氢溶液,PBS冲洗3次,将一抗兔抗人HMGA1多克隆抗体1∶400稀释后加入,过夜孵育(4℃),PBS冲洗3次,加入HRP标记二抗,室温反应60min,PBS冲洗3次,经显色、复染、脱水、封片,显微镜下观察,高倍镜下随机取5个视野,根据染色情况和阳性细胞比例进行判定[7]:(1)染色情况:不染色0分,淡黄色1分,棕黄色2分,黄褐色3分;(2)阳性细胞比例:≤5% 0分,6%~25% 1分,26%~50% 2分,51%~75% 3分,≥76% 4分;(3)将(1)和(2)评分相乘,≤3分为阴性(-),>3分为阳性(+)。
1.2.3细胞培养和处理用含10%胎牛血清的RPMI1640培养液培养细胞。5% CO2、37℃、饱和湿度培养24h,胰酶消化,传代。待细胞融合度达到90%时,按照转染试剂盒说明进行分组转染,HMGA1下调组转染HMGA1干扰序列(5’-GAGTCAGAAAGAGCCCAGT-3’);阴性对照组转染阴性对照序列(5’-TTCTCCGAACGTGTCACGT-3’);空白组不作处理。各组转染后按上述条件继续培养48h。
1.2.4实时荧光定量PCR术检测HMGA1mRNA表达取细胞,加入裂解液,提取总RNA并检测浓度,用逆转录试剂盒进行逆转录获得cDNA,使用实时荧光定量PCR仪按扩增试剂盒说明进行扩增,引物序列:HMGA1:上游:5’-GCAGGAAAAGGATGGGACTG-3’,下游:5’-AGCAGGGCTTCCAGTCCCAG-3’;GAPDH:上游:5’-CTTCTTTTGCGTCGCCAGCCGA-3’,下游:5’-ACCAGGCGCCCAATACGACCAA-3’。反应条件:95℃ 3min,95℃ 30s,60℃ 30s,74℃ 30s,连续36个循环。用2-△△Ct法计算HMGA1 mRNA表达量。
1.2.5CCK-8法检测细胞增殖能力取各组细胞,胰酶消化,制备细胞悬液,接种于96孔板,5×104/孔,继续培养,分别在0、24、48、72、96h时,向各孔加入CCK-8液20μL,利用酶标仪取450nm波长下对各孔检测,记录吸光度值(OD),重复实验3次,每次设置6个复孔。
1.2.6Transwell法检测细胞迁移能力取各组细胞,胰酶消化,用无血清培养液制备单细胞悬液,密度为5×105/mL,取200μL加入Transwell小室上室,将含有20%胎牛血清的培养液加入小室下室,继续培养24h,将小室取出,PBS冲洗,甲醛固定,结晶紫染色,将散落细胞拭去,镜下观察,随机取5个高倍视野,对穿膜细胞进行计数[8]。
1.2.7Transwell法检测细胞侵袭能力将Matrige基质胶用培养液稀释后,在Transwell小室上室内进行均匀平铺,过夜风干。其余步骤同1.2.5中Transwell实验操作步骤。
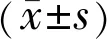
2结果
2.1UM和正常葡萄膜组织中HMGA1蛋白表达UM组织中HMGA1蛋白阳性表达率为77%(41/53),高于正常葡萄膜组织中的29%(10/34),差异有统计学意义(χ2=19.630,P<0.001),见图1。
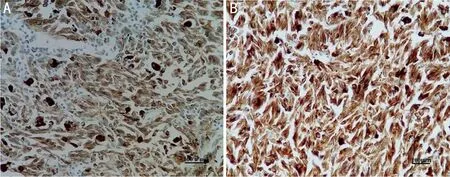
图1 免疫组织法检测UM和正常葡萄膜组织中HMGA1蛋白表达(SP) A:正常葡萄膜组织中HMGA1蛋白呈低表达;B:UM组织中HMGA1蛋白呈高表达。
2.2UM患者肿瘤组织中HMGA1蛋白表达情况HMGA1蛋白阳性表达率在不同年龄、性别、眼别、发生部位、视盘受累、继发视网膜脱落、肿瘤高度和病理学类型患者中差异均无统计学意义(P>0.05),但与未发生巩膜浸润、未累及睫状体和未发生眼外生长的患者相比,HMGA1蛋白在发生巩膜浸润、累及睫状体和发生眼外生长的患者肿瘤组织中阳性表达率升高,差异均有统计学意义(P<0.05),见表1。
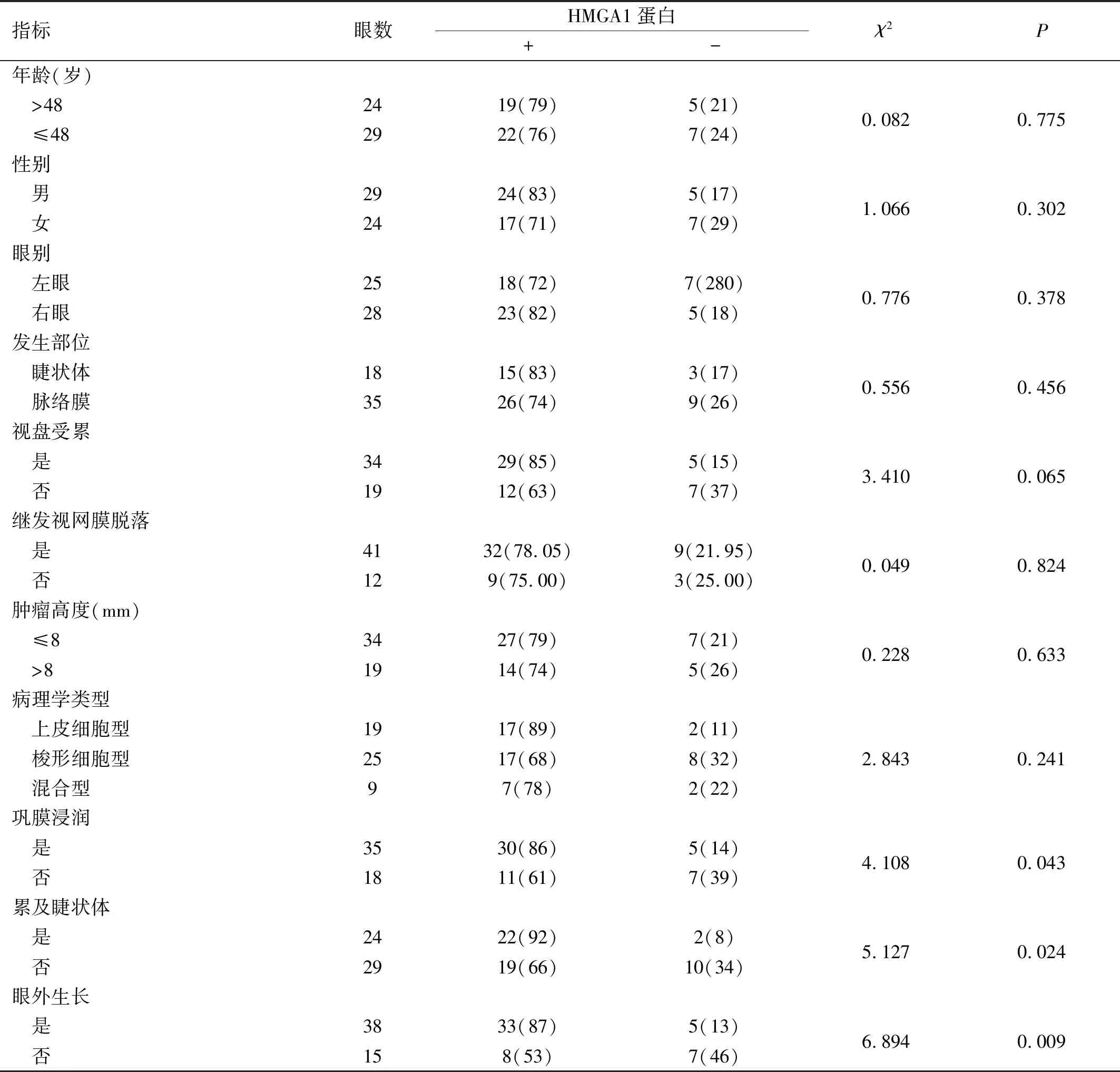
表1 UM患者肿瘤组织中HMGA1蛋白表达情况眼(%)
2.3各组细胞中HMGA1表达HMGA1下调组、阴性对照组和空白组细胞中HMGA1 mRNA相对表达量分别为0.29±0.08、0.98±0.07和1.01±0.06,差异有统计学意义(F=193.400,P<0.001),HMGA1 mRNA在阴性对照组和空白组细胞中相对表达量差异无统计学意义(P=0.431),HMGA1 mRNA在HMGA1下调组细胞中相对表达量低于阴性对照组和空白组,差异均有统计学意义(P<0.05)。
2.4各组细胞增殖能力与阴性对照组和空白组相比,HMGA1下调组细胞培养24、48、72、96h时吸光度OD值降低,差异均有统计学意义(P<0.05),见表2。
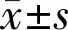
表2 各组细胞不同时间点吸光度OD值比较
2.5各组细胞迁移能力各细胞迁移能力相比,阴性对照组和空白组迁移细胞数差异无统计学意义(P>0.05),HMGA1下调组迁移细胞数明显少于阴性对照组和空白组,差异均有统计学意义(P<0.05),见图2,表3。

图2 Transwell法检测各组细胞迁移能力 A:HMGA1下调组;B:阴性对照组;C:空白组。
2.6各组细胞侵袭能力各组细胞侵袭能力相比,阴性对照组和空白组侵袭细胞数差异无统计学意义(P>0.05),HMGA1下调组侵袭细胞数明显少于阴性对照组和空白组,差异均有统计学意义(P<0.05),见图3,表3。
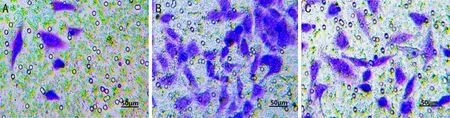
图3 Transwell法检测各组细胞侵袭能力 A:HMGA1下调组;B:阴性对照组;C:空白组。
表3 各组迁移细胞数和侵袭细胞数比较个)
3讨论
UM作为眼内常见的恶性肿瘤,发病率仅次于视网膜母细胞瘤,且恶性程度高、增殖力和侵袭力强,早期便可发生转移[9],有研究指出,转移特别是突破眼眶的远处转移,是导致患者死亡的重要原因[10]。因此,积极寻找与UM转移相关的敏感基因对患者诊疗及改善预后具有重要意义。HMGA1定位于人染色体6q21,在胚胎期高表达,但在成人正常组织中普遍低表达,可通过调控多条途径而在细胞生长、分化、细胞周期、基因转录及DNA复制修复中发挥重要作用[11]。近年研究发现,HMGA1蛋白高表达于多种恶性肿瘤组织[12-13]。研究表明,HMGA1高表达可促进乳腺癌MCF7和T47D细胞增殖[4],HMGA1参与调控肾透明细胞癌转移[11],其可作为一种靶基因在细胞侵袭和迁移中发挥重要作用[14]。本研究结果显示,UM组织中HMGA1蛋白阳性表达率高于正常葡萄膜组织,说明HMGA1蛋白在UM组织中呈高表达,可能与该肿瘤的发生有关。同时,本研究发现HMGA1蛋白阳性表达率与巩膜浸润、累及睫状体和眼外生长相关,表明HMGA1蛋白可能参与了UM侵袭和转移过程。
本研究利用基因干扰技术特异性沉默M23细胞中HMGA1表达,结果显示,HMGA1 mRNA在HMGA1下调组细胞中相对表达量低于阴性对照组和空白组,表明HMGA1下调组细胞中HMGA1 mRNA表达被成功抑制。有研究指出,miR-424可靶向调控HMGA1阻滞细胞周期G1期进而影响宫颈癌细胞的增殖[15]。本研究结果显示,与阴性对照组和空白组相比,HMGA1下调组细胞培养24、48、72、96h时吸光度OD值降低,说明下调HMGA1表达可有效抑制M23细胞增殖,提示HMGA1可能参与了细胞增殖过程。另有研究指出,HMGA1可加速子宫颈癌的迁移和侵袭[16]。本研究结果显示,HMGA1下调组迁移细胞数和侵袭细胞数均明显少于阴性对照组和空白组,说明HMGA1可能参与了M23细胞迁移和侵袭过程,可能是调控细胞迁移和侵袭的重要基因之一,但具体调控机制尚待进一步研究明确。
综上所述,UM组织中HMGA1蛋白阳性表达率升高,且与肿瘤恶性进展指标有关,下调M23细胞中HMGA1表达可减少细胞增殖,抑制细胞迁移和侵袭,有望为UM机制研究及临床诊疗提供新的潜在靶基因。

