局部亚低温联合阿替普酶静脉溶栓治疗急性大面积脑梗死的效果分析
赵新侠
(太康县人民医院 神经内科,河南 周口 461400)
脑梗死是临床常见的脑血管疾病,其中急性大面积脑梗死(acute massive cerebral infarction,AMCI)是较严重的类型,病情进展快,预后差[1]。于AMCI早期解除梗死灶,改善脑神经组织血氧代谢是确保治疗效果,改善预后的关键。阿替普酶(recombinant tissue plasminogen activator,rt-PA)静脉溶栓是脑梗死一线治疗方案,有效率达70%以上,但有部分AMCI患者未达到预期治疗效果[2]。近年有研究者提出,局部亚低温可通过改善脑组织血氧代谢缓解急性脑梗死症状,但确切效果尚需进一步探究[3]。本研究选取93例AMCI患者作为研究对象,探讨局部亚低温联合rt-PA静脉溶栓治疗AMCI的效果。
1 资料与方法
1.1 一般资料选取2018年1月至2020年8月太康县人民医院收治的93例AMCI患者作为研究对象,按治疗方案分联合组(n=48)和静脉溶栓组(n=45)。联合组男31例,女17例;年龄49~65岁,平均(56.38±3.02)岁;发病至溶栓时间1.5~3.8 h,平均(2.29±0.36)h;体质量指数18~26 kg·m-2,平均(21.06±1.03)kg·m-2。静脉溶栓组男26例,女19例;年龄45~63岁,平均(54.43±2.56)岁;发病至溶栓时间1~4 h,平均(2.39±0.33)h;体质量指数18~26 kg·m-2,平均(21.13±1.01)kg·m-2。两组一般资料均衡可比(P>0.05)。本研究经太康县人民医院医学伦理委员会审批通过。
1.2 选取标准(1)纳入标准:①经脑CT、磁共振成像等影像学检查确诊为AMCI,颈动脉主干、大脑中动脉主干或皮质支完全梗死,排除脑出血;②首次发病,且发病至溶栓时间不超过4.5 h。(2)排除标准:①合并其他脑神经损害;②合并短暂性脑缺血发作;③合并凝血功能障碍;④合并肝、肾、心功能障碍。
1.3 治疗方法
1.3.1静脉溶栓组 接受rt-PA(Boehringer Ingelheim Pharma GmbH & Co.KG,注册证号S20160055)治疗。rt-PA总量0.9 mg·kg-1,取总量的10%静脉推注,余1 h内静滴完成;接受抗血小板聚集、营养神经、预防感染、降颅压等对症治疗。持续治疗30 d。
1.3.2联合组 在静脉溶栓组的基础上接受局部亚低温治疗。采用日成RC-2000Ⅲ型亚低温治疗仪,用降温帽包裹头部,启动治疗仪,维持6~12 ℃水温,鼓膜温度维持34 ℃左右,治疗中注意监测病情、生命体征,若病情稳定,维持24 h可停止治疗,复温时每4~6 h升温1 ℃。
1.4 观察指标
1.4.1疗效 评价标准[4]:(1)脑梗死症状明显或完全缓解,神经缺损程度经美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)分值下降≥90%为显著改善。(2)脑梗死症状缓解,NIHSS分值降低18%~89%为进步。(3)脑梗死症状未缓解,NIHSS分值降低不足18%为无效。将进步、显著改善计入总有效并计算总有效率。
1.4.2氧化应激水平 采集患者晨起空腹肘静脉血2 mL,离心(半径10 cm,转速3 500 r·min-1)15 min,收集上清液,通过南京信帆生物技术有限公司的丙二醛(malondialdehyde,MDA)选牙色法试剂盒检测MDA水平;通过上海酶联生物科技有限公司的超氧化物歧化酶(superoxide dismutase,SOD)酶联免疫试剂盒检测SOD水平。
1.4.3血清相关神经损伤因子水平 标本采集方法同上,取上清液,通过北京杰辉博高生物技术有限公司的视锥蛋白样蛋白1(visinin-like protein-1,VILIP-1)酶联免疫试剂盒检测VILIP-1水平,通过北京凯弘达科技有限公司的特异性神经元烯醇化酶(neuron-specifice nolase,NSE)电化学发光试剂盒检测NSE水平。
1.4.4不良反应 主要观察患者出血情况。

2 结果
2.1 疗效联合组治疗总有效率高于静脉溶栓组(P<0.05)。见表1。
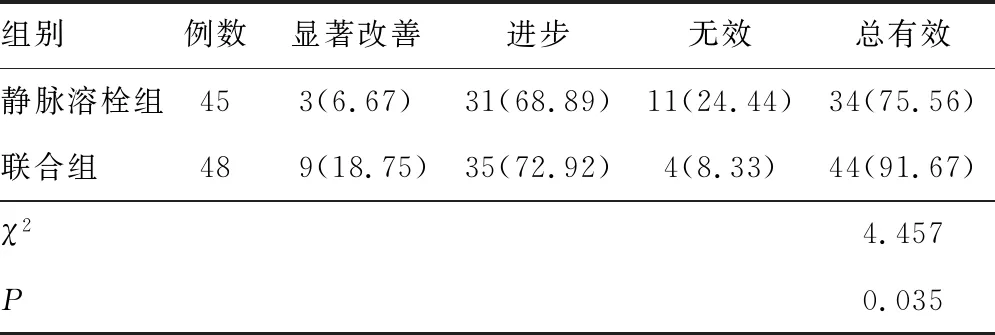
表1 两组疗效比较[n(%)]
2.2 氧化应激水平治疗后,两组血清MDA水平均降低,联合组下降幅度优于静脉溶栓组;治疗后,两组血清SOD水平均升高,且联合组升高幅度优于静脉溶栓组(P<0.05)。见表2。
表2 两组治疗前后氧化应激水平比较
2.3 血清相关神经损伤因子水平治疗后,两组血清VILIP-1、NSE水平均降低,且联合组下降幅度优于静脉溶栓组(P<0.05)。见表3。

表3 两组治疗前后血清相关神经损伤因子水平比较
2.4 不良反应发生情况治疗期间,联合组出现1例鼻出血;静脉溶栓组出现2例鼻出血,脑1例出血。联合组不良反应发生率[2.08%(1/48)]与静脉溶栓组[6.67%(3/45)]比较,差异无统计学意义(χ2=0.333,P=0.564)。
3 讨论
AMCI发病突然、病情危重,急性期病死率可达5%以上,患者即便被抢救成功,但生活质量降低[5]。目前AMCI治疗以尽快恢复脑神经组织血氧供给、抑制病情进展为主。
rt-PA静脉溶栓是目前治疗急性脑梗死主要方法[6],其已被多项指南认可、推荐。但本研究静脉溶栓组患者接受rt-PA静脉溶栓治疗的总有效率与现有研究结果相近,说明AMCI治疗仍有较大提升空间。局部亚低温治疗技术是近年提出的一种治疗急性脑梗死的技术。有学者提出,rt-PA静脉溶栓联合局部亚低温可提高治疗效果,且与单独接受全身亚低温比较,可避免全身基础代谢处低温状态而诱发的各系统并发症,安全性较高[7]。本研究结果发现,联合组总有效率高于静脉溶栓组,且两组无不良反应发生率差异无统计学意义,说明此方案效果显著,安全可靠。
此外,氧化应激是机体抗氧化防御体系和活性氧族间出现的一种失衡现象,可致机体组织损害。活性氧族能氧化细胞膜内不饱和脂肪酸最终生成MDA,而SOD是机体重要抗氧化酶。有研究证实,在AMCI发生发展过程中始终伴随MDA/SOD失衡,外周血MDA水平持续升高加剧脑神经组织氧化损害,同时SOD消耗性降低[8]。本研究结果发现,治疗后,联合组血清MDA水平低于静脉溶栓组,血清SOD水平高于静脉溶栓组。分析原因为局部亚低温可降低脑耗氧量及乳酸堆积,维持脑组织正常脑血流量及能力代谢,抑制氧自由基生成,以减轻氧化反应,保护脑神经细胞不被氧化损害,说明加用局部亚低温治疗有助于缓解AMCI患者机体氧化应激反应。但AMCI发生发展及病情转归机制复杂,单纯从氧化应激层面入手可能仍不足以评价加用局部亚低温治疗AMCI的价值。血清VILIP-1、NSE是反应脑神经细胞损害程度的敏感性、特异性生化指标。当脑神经细胞损害时二者在外周血中水平显著升高[9]。本研究结果发现,治疗后联合组血清VILIP-1、NSE水平低于静脉溶栓组,证实经局部亚低温联合rt-PA静脉溶栓治疗AMCI能通过调节VILIP-1、NSE水平,保护脑神经细胞。但本研究不足之处在于作为临床观察研究,尚未探明加用局部亚低后调节VILIP-1、NSE水平的具体机制,需后期基础研究继续探究。
综上所述,局部亚低温联合rt-PA静脉溶栓治疗AMCI效果显著,能减轻患者氧化应激反应,改善神经功能,且安全可靠。

