松江鲈热休克同源蛋白70(HSC70)的基因克隆与表达分析
贾昌锋,高海霞,祝 茜,张 雷,2
(1.山东大学海洋学院,山东威海 264209;2.威海长青海洋科技股份有限公司,山东荣成 264200)
热休克蛋白(heat shock proteins,HSP)是一个高度保守的细胞蛋白超家族,存在于包括鱼类在内的所有生物中[1-2]。近年来,在应激刺激和正常生理条件下,其转录调控、生态、进化和先天免疫反应等方面受到了广泛关注[3-4]。传统意义上,HSP可按分子量分为HSP110、HSP90、HSP70、HSP60、HSP47和sHSP[5]。其中,由于HSP70在呈递抗原、自身免疫和肿瘤免疫中发挥着重要作用[6-7],成为研究最为广泛的家族[8]。目前学术界普遍将HSP70家族分为:组成型的热休克同源蛋白70(heat shock cognate protein 70,HSC70)和诱导型HSP70[9-12]。前者以组成方式表达,主要在细胞分裂、增殖和发育等生理条件下发挥作用[13-14];后者则在环境和生物胁迫下表达,如热休克和微生物感染等[15-16]。但研究表明,两者在鱼类中发挥的作用几乎相同。
尽管HSP70家族在硬骨鱼类中的研究越来越广泛,但也局限于少数鱼类HSP70的识别,如虹鳟(Oncorhynchus mykiss)[17]、斑马 鱼(Danio rerio)[18]和美洲鲥(Alosa sapidissima)[19]等,以及从少部分鱼类分离出来HSC70基因,如斑马鱼[20]、鳜(Siniperca chuatsi)[21]、大 菱 鲆(Scophthalmus maximus)[22]、草鱼(Ctenopharyngodon idella)[9]和纹鳢(Channa striatus)[23]等。然而,在松江 鲈(Trachidermus fasciatus)中,还未见有关HSP70家族的研究报道。
松江鲈被发现于东北亚的东海岸[24],被收录到国家重点保护野生动物名录和《中国红皮书》第二类严重濒危物种[25],具有极高的生物、生态和经济价值[26]。然而,在过去的几十年里,松江鲈的野生种群数量急剧下降[25],在我国许多水域甚至已绝迹[26]。因此,通过水产养殖等替代方法以恢复松江鲈的资源量已迫在眉睫。深入了解松江鲈在应对病原体时的免疫应答,有助于制定有效的疾病控制措施,促进种群的长期可持续性发展。然而,目前对松江鲈的免疫研究尚较少[27]。本研究从松江鲈体内克隆并鉴定一个HSC70基因(即TfHsc70),并检测了TfHsc70 mRNA在松江鲈组织中的分布,以及脂多糖(LPS)刺激后TfHsc70的时间表达规律,以期为鱼类免疫应答中的HSC70蛋白功能研究奠定基础。
1 材料与方法
1.1 实验材料预处理
实验材料选用取自山东省威海市文登区埠口港的9~10月龄、体质量(19±4)g的松江鲈。实验前,将100尾松江鲈放在流通海水系统(1.2 m×0.45 m×0.5 m)中驯化一周左右,期间持续通气并保持温度为(13±1)℃(其他条件与自然海水相同)。在此过程中,有任何皮肤损伤或疾病迹象均不得进入驯化环境。
将松江鲈分为试验组和对照组,每组各50尾鱼。试验组腹腔注射来源于大肠杆菌的0.04 μg·g-1LPS(Sigma,St.Louis,MO,USA)(约50μL);对照组注射0.01 mol·L-1磷酸盐溶液(PBS)50μL。完成注射后将鱼放回流通海水系统,并在注射2、6、12、24、48、72、96 h后各时间点随机抽取6尾鱼。
在保证无菌条件的前提下,分别采集松江鲈的血液、心脏、肝脏、皮肤、胃、肠、脾脏、肾脏、大脑、鳃等组织,并将这些组织立即冷冻在液氮中,-80℃冰箱冻存备用,用于后续RNA的提取。
1.2 总RNA提取和cDNA合成
使用EZNATMMicroEluteⓇTotal RNA Kit II(QMEGA,USA)从松江鲈的各种组织中提取总RNA,采用OD260/280法检测RNA提取质量,并用1.5%琼脂糖凝胶电泳检测。第一链cDNA的合成采用SMART cDNA(BD Biosciences Clontech)方法,使用oligo-anchor R和Smart F引物,如表1所示。
1.3 克隆松江鲈TfHsc70基因cDNA全长
根据松江鲈肝脏cDNA文库随机测序得到的表达序列标签(EST),设计一对基因特异性引物(TfHsc70F,TfHsc70R),其将用于后续的聚合酶链反应(polymerase chain reaction,PCR)。PCR反应体积为25μL,包括PCR mix kit(Fermentas)12.5μL,引物各1μL(10μmol·L-1),Taq聚合酶0.25μL(TaKaRa),cDNA 1μL,Milli-Q水9.25μL。PCR反应的最佳条件为:94℃预变性5 min;94℃50 s,50℃45 s,72℃30 s,运行30个循环;72℃延伸10 min。PCR产物选用PCR纯化试剂盒(BioFlux)纯化,将纯化产物与pMD18-T载体(TaKaRa)连接,并将连接产物转化至大肠杆菌的感受态细胞。阳性克隆由上海生工生物工程技术服务有限公司选择并测序。所得序列通过在线BLAST程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)比对,从而确认为Hsc70序列。利用cDNA末端(RACE)快速扩增得到TfHsc70的cDNA全长序列。5′-RACE使用5′引物与基因特异性引物TfHsc70R配对,3′-RACE使用3′anchor R与TfHsc70F引物配对(表1)。PCR程序为:94℃预变性5 min;94℃50 s,55℃45 s,72℃30 s,运行30个循环;72℃延伸10 min。对获得的PCR序列进行克隆测序。
1.4 序列和系统发育分析
利用NCBI(http://blast.ncbi.nlm.nih.gov/Blast.cgi)和蛋白分析数据库(http://www.expasy.org/)对TfHsc70的cDNA和氨基酸序列进行分 析。使 用SMART service(http://smart.embl-heidelberg.de/)预测特定保守区域。用SignalP 3.0预测信号肽(http://www.cbs.dtu.dk/services/SignalP/)。利用DNAStar 5.0软件包中的EditSeq预测分子质量和等电点。使用SWISS-MODEL(http://swissmodel.expasy.org/)预测三维结构。利用Clustal W和DNAman软件进行序列比对,然后采用MEGA X实现的邻接方法构建系统发育树[28]。通过1 000次bootstrap抽样来评估系统发育树的可靠行。
1.5 LPS刺激后TfHsc70的组织分布和时间表达
采用实时荧光定量PCR(quantitative realtime PCR,qRT-PCR)技术分析松江鲈TfHsc70 mRNA的组织特异性表达,同时测定使用LPS刺激后的时间表达谱系。
设计引物QTfHsc70F和QTfHsc70R(表1)扩增TfHsc70片段。β-肌动蛋白为内参,引物为Actin F和Actin R(表1)。qRT-PCR使用SYBR Premix Ex TaqTM(Takara,日本),使用ABI 7300实时检测系统(Applied Biosystems,美国)进行,总容量为20μL,包含10μL的2×SYBR Premix Ex TaqTM,2μL的1∶100稀释的cDNA,每种引物各4μL(1μmol·L-1)。扩增程序为94℃预变性3 min,94℃15 s,56℃20 s,运行40个循环,然后进行最后的裂解阶段。利用解离曲线分析验证PCR产物的特异性。所得数据归一化至肌动蛋白,且所有样本重复3次。通过2-ΔΔCT方法对所得实验数据进行量化处理,采用未配对、双尾t检验来评价对照组和试验组之间的显著性差异。P<0.05为差异显著,P<0.01为差异极显著。

表1 TfHsc70基因扩增和表达所用引物Tab.1 Primer of TfHsc70 used for cloning and expression
2 结果与分析
2.1 TfHsc70的分子克隆和序列分析
通过5′-RACE和3′-RACE技术,得到全长2 138 bp的TfHsc70 cDNA(图1)。TfHsc70的cDNA包括1个1 947 bp的开放阅读框(ORF),1个78 bp的5′端未翻译区(UTR)和1个95 bp的3′端带有终止密码子(TAA)的UTR。在poly A序列上游87 bp处发现一个典型的聚腺苷酸化信号序列(AATAAA)。该蛋白具有649个氨基酸,理论分子量为71.1 kDa,等电点为5.27。
序列比对显示,TfHsc70含有3个保守标记序列(GIDLGTTY、DLGGGTFD和VLVGGSTRIPKIQK)和1个ATP-GTP结合位点基序(AEAYLGKT),且在羧基区,TfHsc70有两个GGXP基序四肽,且在末端有保守的细胞质特异性基序EEVD。此外,在该序列中还发现了偶联核定位信号和经典的多聚腺苷酸化信号(图1)。

图1 TfHsc70的mRNA和预测氨基酸序列Fig.1 The mRNA and predicted amino acid sequence of TfHsc70
通过SWISS-MODEL生成三维结构模型可以发现,TfHsc70蛋白包括两个主要结构域,包括在氨基末端区域发现的ATP酶结构域和在羧基末端发现与肽结合的结构域(图2)。

图2 TfHsc70的三级结构Fig.2 Tertiary structure of TfHsc70
氨基酸序列比对结果显示,松江鲈HSC70(TfHsc70)与 五条鰤(Seriola quinqueradiata)HSC70的一致性最高,达到97.09%[29]。而它与包括两栖类、爬行类、鸟类和哺乳动物在内的其他物种具有85.36%~93.98%的相似性。基于鱼类、两栖类、哺乳动物等25个物种氨基酸序列构建的系统发育树显示,硬骨鱼与其他脊椎动物存在差异(图3)。

图3 Tf Hsc70系统发育树Fig.3 Phylogenetic tree of TfHsc70
2.2 TfHsc70 mRNA的组织分布
为了检测TfHsc70在松江鲈组织中的表达,以β-肌动蛋白为对照,采用qRT-PCR分析。如图4所示,TfHsc70转录在10个检测组织中普遍表达。TfHsc70在大脑中的表达量最高,在血液、心脏、肝脏、胃、肠、脾脏、肾脏和鳃中表达量较低,而在皮肤中只检测到微量。结果表明,松江鲈TfHsc70在各器官中均以组成型表达,组织间存在一定的表达差异性。
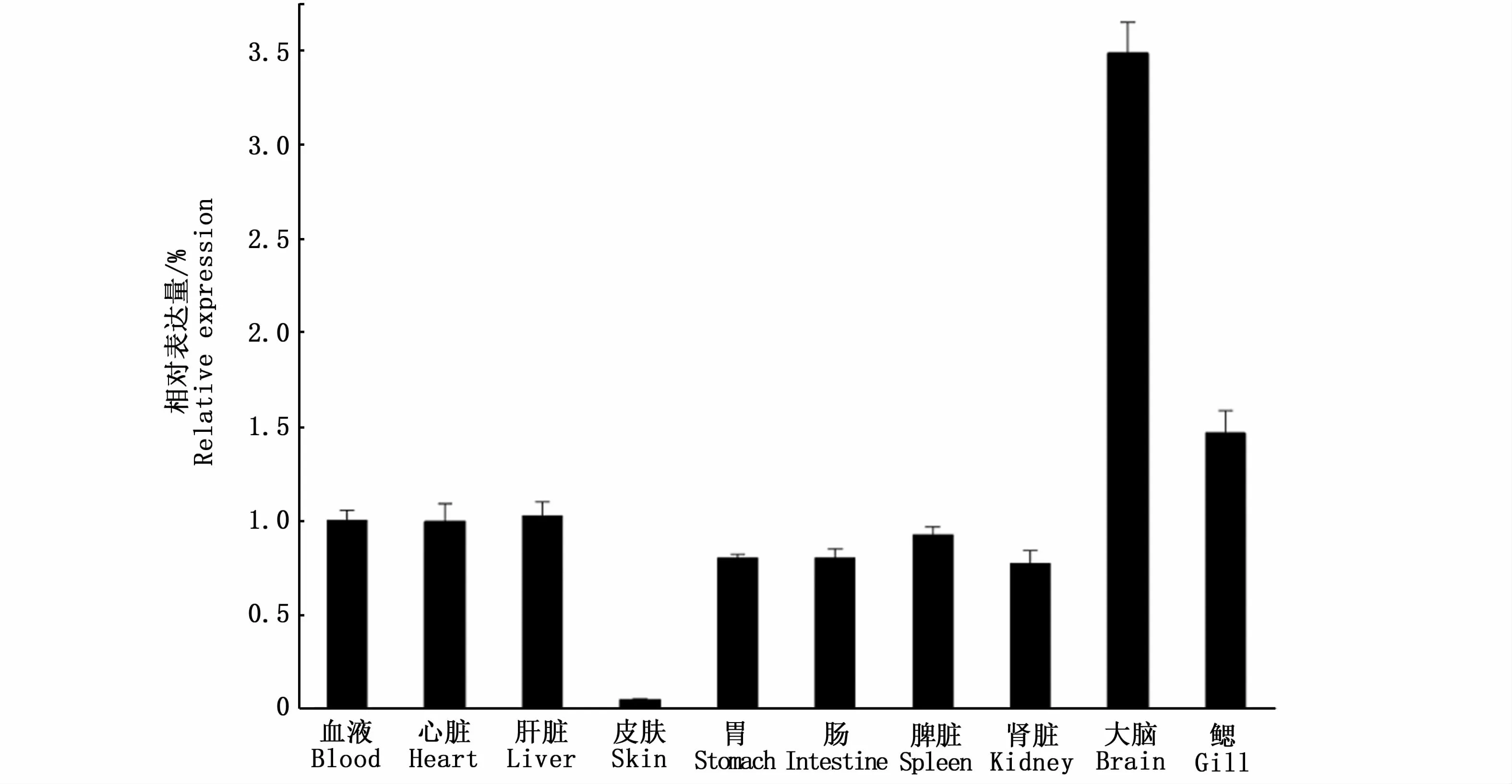
图4 松江鲈不同组织中TfHsc70 mRNA的表达Fig.4 TfHsc70 mRNA expression in different tissues of Trachidermus fasciatus
2.3 LPS刺激后各组织的TfHsc70 mRNA表达变化
与对照组相比,肝脏、皮肤、血液、脾脏、鳃、大脑中的TfHsc70均在LPS刺激后出现不同程度的上调(P<0.05)(图5)。其中肝脏TfHsc70表达量在LPS刺激2 h后显著上调(P<0.05),但在6 h时急剧下降(P<0.05),48 h时下降到对照组的0.1倍(P<0.05),在96 h时又略有上升(图5-A);皮肤TfHsc70在LPS刺激2 h后表达量明显增加(P<0.05),尽管随后TfHsc70的表达量有所下降,但96 h时,TfHsc70在皮肤中的表达量远高于对照组(图5-B);血液TfHsc70在刺激2 h后表达量达到最大,达到原有的15倍(P<0.05),但在6 h时表达量有所下调,并在6~24 h基本保持不变,48 h后TfHsc70表达量恢复到正常水平,72 h后出现第二个高表达(P<0.05);脾脏(图5-D)和鳃(图5-E)中TfHsc70的表达均呈现随时间延长而逐渐上调的趋势,并在感染后的96 h达到峰值,分别上调到对照组的2.0倍和1.8倍(P<0.05);大脑TfHsc70最初在2~6 h内略有下调,然后在12 h时迅速恢复至原有水平,并在刺激72 h后呈上升趋势(图5-F)。
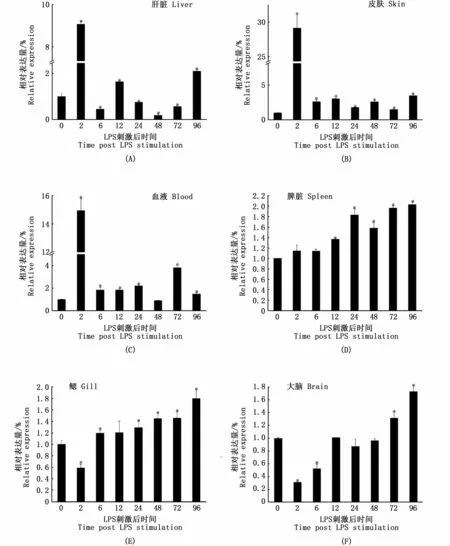
图5 LPS刺激后不同时间主要免疫组织TfHsc70 mRNA表达Fig.5 TfHsc70 mRNA expression in main immune tissues at different time after LPSstimulation
3 讨论
本研究成功克隆松江鲈HSC70基因的cDNA全长,并命名为TfHsc70。TfHsc70全长2 138 bp,其含有3个HSP70家族的保守标记序列(GIDLGTTY、DLGGGTFD和VLVGGSTRIPKIQK)和 1个 ATP-GTP结合位点基序(AEAYLGKT)[30],前者表明该序列属于HSP70家族,后者在HSP伴侣蛋白复合物的形成中起主要作用,可调节蛋白质底物的正确折叠[31]。而TfHsc70羧基区的两个GGXP基序四肽,表明它是HSC70蛋白亚家族的成员。其中一些重复肽已被证明具有抗原性[32]。序列中的偶联核定位信号可能参与了TfHsc70的选择性转位。而羧基末端的EEVD提示TfHsc70存在于细胞质中,可能在肽结合活性中发挥重要作用[33-34]。此外,氨基酸序列比对结果显示TfHsc70高度保守。
qRT-PCR结果显示,TfHsc70广泛分布在松江鲈的血液、心脏、肝脏等组织中,但表达量有所不同,特别是在大脑中的表达量明显高于其他组织,类似结果在草鱼[9]、斑马鱼[20]、真鲷(Pagrus major)和黑鲷(Acanthopagrus schlegelii)[35]上也有所体现。在草鱼和鳜的主要免疫组织中,HSC70均有所表达,但表达量不同[9,21]。前者在鳃、肾脏、头肾及外周血淋巴细胞中高水平表达,后者ScHSC70-1和ScHSC70-2分别在卵巢和心脏中高水平表达。而当斑马鱼胚胎发育到原肠期后期时,HSC70表达在中枢神经系统和一些体节中出现组织特异性[20]。此外,研究表明,在硬骨鱼大脑中HSC70的高水平表达是很常见的[16,36-37]。究其原因是大脑作为机体最重要的器官,需要大量的分子伴侣(如HSC70蛋白)将蛋白质的储存和释放维持一种动态平衡。而且由于血脑屏障的存在,HSC70蛋白可在大脑中的某一区域局部合成,这解释了为什么在松江鲈大脑中发现了HSC70的高水平表达。然而,要进一步了解HSC70组织特异性表达的机制,还需进行更加详细的研究。
LPS作为革兰氏阴性细菌细胞壁的重要组成部分,可在哺乳动物和鱼类中引起炎症反应[38]。而HSC70蛋白为组成型表达[12],其在受到外来刺激时会被诱导表达,且在LPS刺激后HSC70的增加呈现时间依赖性[9],本研究也证明了这点。肝脏、皮肤和血液在LPS刺激2 h后,TfHsc70表达量均会迅速达到峰值,这是由于肝脏、皮肤和血液是机体参与免疫反应的组织或器官,起到产生或承载相关免疫基因的作用[39-41]。但在草鱼的研究中发现,LPS刺激外周血淋巴细胞后HSC70 mRNA未出现上述变化[9],这表明HSC70 mRNA在LPS刺激后血液中的表达具有物种特异性。所以还需进一步研究来了解硬骨鱼的血液为什么会出现不同的调节模式。与大菱鲆和鳜相似,脾脏和鳃的TfHsc70表达量出现了时间上的滞后[21-22]。这说明生物体内不同组织根据不同的调控模式,参与调节宿主先天对微生物的防御。由于血脑屏障可以维持大脑的相对平衡[42],所以在大脑中TfHsc70的表达量呈现先下降再上升的趋势。这表明TfHsc70参与了宿主对微生物的防御机制。综上所述,LPS刺激后TfHsc70表达具有时间依赖性和物种特异性,也表明TfHsc70在松江鲈对抗微生物感染的先天免疫应答中发挥重要作用。
本文利用EST和RACE技术从松江鲈中克隆并鉴定TfHsc70。通过分析其氨基酸序列、构建系统发育树以及TfHsc70 mRNA的表达情况,最终得到TfHsc70蛋白属于热休克蛋白HSC70亚家族的结论。此外,在LPS刺激后发现,TfHsc70 mRNA在松江鲈的主要免疫组织中显著上调,这表明松江鲈HSC70(即TfHsc70)作为一种功能蛋白,是参与先天免疫应答的重要免疫相关分子。但其在松江鲈中的潜在生物学功能和防御机制需要进一步研究,从而为HSC70在鱼类免疫应答中的功能作用奠定基础。

