失血性休克患者血清HMGB1及凝血蛋白酶水平变化与创伤性凝血发生风险的相关性分析
杨秋林 吴锋 吴彬彬 张小文 吴湘军
失血性休克(HS)是临床常见的危重综合征之一,若得不到及时救治会严重威胁生命安全。患者在大量失血的状态下,易引起体内的凝血功能紊乱,是创伤性凝血(TIC)的诱因和发病基础。TIC由组织损伤和休克共同驱动,进一步发展可能会引起患者出血不止、多器官功能受损和其他不良后果[1]。因此尽早识别TIC,并及时针对早期凝血障碍的适当治疗至关重要。有研究发现,高迁移率族蛋白1(HMGB1)作为新发现的炎症因子,在严重失血后会从不同类型的细胞中大量释放,HMGB1引起的无菌性炎症可以导致凝血级联反应的启动和扩散,与凝血功能紊乱有密切联系[2]。本文探讨HS患者血清HMGB1及凝血蛋白酶水平变化与TIC发生风险的相关性,分析其对TIC的预测价值。
1 资料与方法
1.1 临床资料 选取2017年2月至2019年11月本院失血性休克患者82例。纳入标准:(1)符合失血性休克的诊断标准;(2)在伤后1 h内入院接受治疗。排除标准:(1)在心肝肾等器官方面患有重大疾病的患者;(2)患者既往有血液疾病和凝血功能障碍病史;(3)近期服用过抗炎类药物。选取82例患者根据入院后是否发生创伤性凝血病分为观察组(TIC组38例)和对照组(非TIC组44例)。
1.2 方法 收集患者的相关临床资料,包括一般情况、既往疾病史、生命体征、实验室检查及相关物理检查等,并使用急性生理学和慢性健康状况评分Ⅱ(APACHE Ⅱ)和序贯器官衰竭评分(SOFA)对患者身体状况进行评价。患者入院时立即采集外周静脉血,经过离心机处理后分离血清,采用ELISA法对患者血清HMGB1及凝血蛋白酶水平进行检测。试剂盒购自上海谷研实业有限公司,实际操作严格按照试剂盒说明书进行。
1.3 统计学方法 采用SPSS 20.0统计软件。计量资料以(±s)表示,组间比较采用独立样本t检验。计数资料以n(%)表示,用χ2检验。多因素分析采用Logistic回归分析,采用受试者工作曲线(ROC)评估HMGB1及凝血蛋白酶水平在HS患者中发生TIC风险的预测价值。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者基本资料比较 见表1。
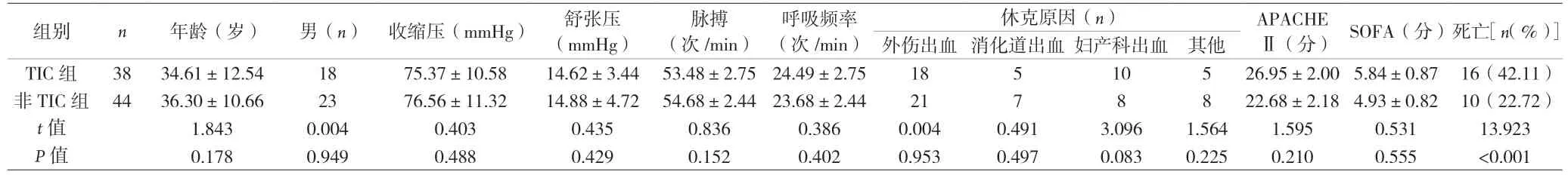
表1 两组患者基本资料比较
2.2 两组血清HMGB1及凝血蛋白酶水平比较 见表2。
表2 两组血清HMGB1及凝血蛋白酶水平比较(±s)

表2 两组血清HMGB1及凝血蛋白酶水平比较(±s)
组别 n HMGB1(ng/mL) 凝血酶(IU/mL)TIC组 38 30.05±11.72 6.48±1.22非TIC组 44 18.18±4.03 10.33±1.77 t值 27.52 5.28 P值 <0.001 0.024
2.3 血清HMGB1及凝血蛋白酶水平与HS患者发生TIC的Logistic回归分析 HMGB1和凝血蛋白酶是影响HS患者发生TIC的危险因素(P<0.01)。见表3。

表3 血清HMGB1及凝血蛋白酶水平与HS患者发生TIC的Logistic回归分析
2.4 HMGB1及凝血蛋白酶预测HS患者发生TIC价值分析 HMGB1预测HS患者发生TIC风险的AUC值为0.844(95%CI:0.750~0.939),最佳截断值为0.649,敏感度76.3%,特异性88.6%。凝血蛋白酶预测HS患者发生TIC风险的AUC值为0.898(95%CI:0.832~0.964),最佳截断值为0.69,敏感度79.5%,特异性89.5%。见图1、2。
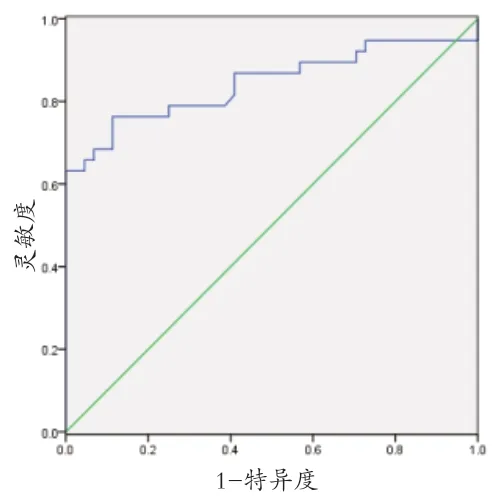
图1 HMGB1预测HS发生TIC风险的ROC曲线
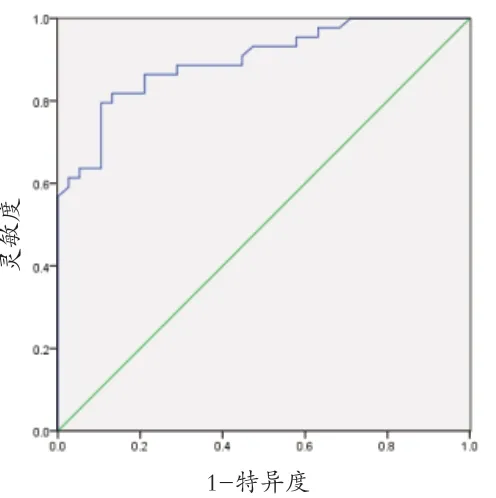
图2 凝血酶预测HS发生TIC风险的ROC曲线
3 讨论
引起休克的出血原因有多种,其中,严重的创伤、妇产科疾病、消化道、围术期出血和动脉瘤破裂等是引起失控性出血的高风险因素[3]。TIC是HS患者较为常见的一种并发症,致死率高且存活患者预后较差。患者在大量失血状态下会引起其体内的多种器官或多个系统受到损伤,特别是对凝血功能造成严重影响。创伤性凝血障碍发展迅速,在休克后1~4 h内可见,在出血相关的凝血因子和血小板丢失后,对患者进行治疗措施,包括液体复苏、输血和局部激活凝血均会进一步加剧凝血障碍[4]。因此,对HS患者发生创伤性凝血的早期识别和风险分层非常重要,在凝血障碍进一步发展前及时采取干预措施,对逆转患者的不良结局具有重要意义。
患者在发生HS后会出现“细胞因子风暴”,研究发现HS患者体内存在促炎因子和趋化因子的高度表达,表现出早期的高炎症反应,并伴有持续性炎症和免疫抑制[5]。HMGB1是高迁移率族蛋白超家族中的一员,目前已有研究显示,其在多种炎性疾病患者的血清中存在过度表达,且在炎症驱动状态中起关键作用[6-7]。炎症可激活凝血级联反应促进血液凝固,但凝血功能异常激活的同时会导致血栓产生和凝血因子大量消耗。炎症持续激活凝血反应,从而影响凝血系统的功能,因此炎症被认为是加重凝血障碍的重要机制[8]。HMGB1通过介导炎症影响凝血外,也可直接影响凝血系统。LEVI等[9]发现在脓毒症所致凝血障碍患者中血小板HMGB1的分泌上调,高度表达的HMGB1可通过调节血小板活化促进血栓的形成,血小板在过度消耗后增加凝血障碍的风险[10]。本资料结果显示,血清中HMGB1含量明显高于对照组,提示HS患者HMGB1升高可能参与创伤性凝血的发生,进一步分析发现HMGB1是影响失血性休克患者发生创伤性凝血的危险因素。HMGB1同时引起的炎症反应和凝血系统过度激活增加HS患者发生创伤性凝血的风险。
凝血酶作为凝血级联反应的中心蛋白酶,在凝血过程中起核心作用。在正常生理条件下,人体内的凝血因子是酶原,只有通过接触激活(内在途径)或组织因子刺激(外源性途径)才会转化为凝血蛋白酶,并以级联方式促进纤维蛋白凝块的形成,因此凝血酶的生成速率和凝血酶形成的总量可以较好反映潜在的凝血活性[11]。正常凝血系统以凝血、抗凝和纤溶三种作用形式共同维持生理平衡,但失血性休克在组织损伤、大量失血和低灌注等多因素影响下易引起凝血系统失衡。机体组织发生损伤后,组织因子过度激活和凝血因子的大量消耗会使生成的凝血酶含量持续减少,凝血活性下降[12]。此外,大量血液稀释后,抗纤维蛋白溶解酶减少也使得纤维蛋白凝块更易发生溶解,进一步加重凝血障碍,机体处于低凝状态,表现为明显的出血倾向[13]。本资料中,发生TIC的HS患者凝血酶明显下降,提示凝血酶的降低是HS患者发生TIC的重要原因。因此临床治疗过程中应及时检测患者的凝血蛋白酶水平,及时纠正患者的低凝状态,减少TIC的发生率。

