应用CRISPR/Cas9基因编辑系统对HEK293细胞系TSC1基因稳定敲除效果的实验鉴定
王 晶,高 倩,陈健康,刘家云
(空军军医大学第一附属医院临床检验研究所,西安 710032)
TSC1 基因位于染色体9q34,包含23 个外显子,转录本mRNA 长8.6kb,是结节性硬化症(tuberous sclerosis, TSC)的主要致病基因。TSC 是一种罕见的常染色体显性多系统遗传疾病[1],可发病于全身各个组织,可累及脑、皮肤、视网膜、肾脏和心脏,以癫痫、智力缺陷,头面部血管纤维瘤最为常见,称为“TSC 三联征”[2]。TSC1 基因编码错构瘤蛋白(hamartin)和TSC2 基因编码的马铃薯球蛋白(tuberin) 共同构成复合体TSC1/TSC2,该复合体抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)信号通路。当TSC1 或TSC2 基因发生突变,导致TSC1/TSC2 复合体功能异常,进一步降低其对mTOR 信号通路的抑制作用,引起细胞的异常增殖,从而发生机体的病理变化[3]。
成簇规律间隔短回文重复序列/成簇规律间隔短回文重复序列相关蛋白 (clustered regularly interspaced short palindromic repeat / CRISPRassociated protein,CRISPR/Cas) 系统是细菌降解入侵的噬菌体或外源性遗传物质形成的获得性免疫防御机制[4]。当入侵的噬菌体将其DNA 片段整合到细菌CRISPR 序列中,细菌利用相应的CRISPR RNAs(crRNAs)来指导同源序列的降解,从而提供细菌的免疫防御功能。张峰团队据此开发出基因编辑工具CRISPR/Cas9 系统[5],该系统主要由单链引导RNA (single guide RNA, sgRNA),Cas9 核酸酶和前间隔序列邻近基序(protospacer adjacent motif,PAM)构成,即在PAM 序列的引导下,sgRNA 准确定位到目的片段,并与之互补配对结合,同时PAM 序列激活Cas9 核酸酶,使之完成对DNA 的剪切[6],从而实现基因敲除的功能,该方法以其快速高效、操作便捷的特点现已成为首选的基因编辑工具。因此,我们拟利用CRISPR/Cas9 基因编辑系统在HEK293 细胞中对TSC1 基因进行敲除,从而为研究TSC1 基因的生物学功能奠定基础。
1 材料与方法
1.1 细胞来源 人胚肾细胞HEK293 细胞系(本实验室传代培养)。
1.2 仪器与试剂 lentiCRISPRv2 空载质粒(本实验室保存);sgRNA(生工合成);限制性内切酶BsmB Ⅰ,碱性磷酸酶、T4 多聚核苷酸激酶(ThermoFish Scientific);DNA 胶回收试剂盒、基因组提取试剂盒(生工生物);DMEM 培养基(Hyclone);Opti-MEM 减血清培养基、胎牛血清(GIBCO);兔抗TSC1 抗体、兔抗β-tubulin 抗体(Cell Signaling Technology),HRP 偶联山羊抗兔二抗(Jackson Immuno Research)。
1.3 方法
1.3.1 设计并合成靶向TSC1 基因的sgRNA:在NCBI 中找到TSC1 的基因序列(Gene ID:7248),根据TSC1 的基因序列,使用CRISPR 的sgRNA 在线设计网站http://crispr.mit.edu/,选取分值高(score>95)且脱靶少的序列,网站分析结果为5’→3’端的正义链(20N),以原则:正义链序列为5’-GACC-G-20N-3’;反义链序列为5’-AAAC-(20N 的互补序列)-C-3’合成两条部分互补的寡核苷酸链见表1。设计的sg-TSC1-1 位于6 号外显子上游,sg-TSC1-2 位于6 号外显子下游,若该系统正确切割,TSC1 基因的6 号外显子则被整体删除。
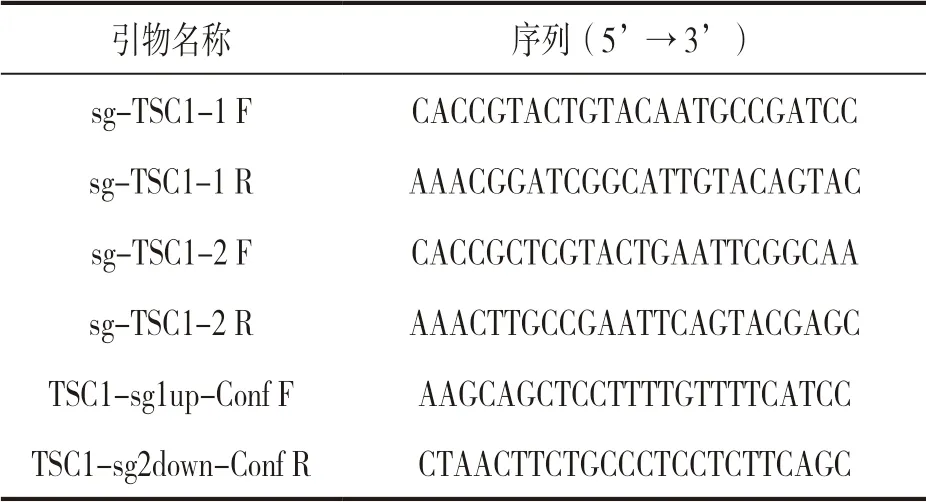
表1 合成的寡核苷酸序列
1.3.2 构建重组质粒lentilCRISPRv2-sgTSC1:将合成的针对目的基因TSC1 的寡核苷酸进行退火,形成双链sgRNA。用限制性内切酶BsmB I 对空载质粒lentiCRISPRv2 进行酶切,将酶切产物进行琼脂糖凝胶电泳,对目的片段进行切胶回收。将回收的BsmBI 消化后载体和双链sgRNA 进行连接,将连接体系转化入Stbl3 感受态细胞中,次日挑取单克隆菌落进行扩大培养,待菌液浑浊后将其送测序。
1.3.3 细胞培养与转染:将HEK293 细胞接种于培养皿,当细胞密度约为70%时,更换无血清培养基,进行转染。对照组转染4μg lentilCRISPRv2 空载体,实验组共转染lentilCRISPRv2-sgTSC1-1 和lentilCRISPRv2-sgTSC1-2 各2μg。
1.3.4 嘌呤霉素加压筛选:转染后48h 进行换液并加入1μg/ml 嘌呤霉素,每2 天进行一次换液,7天后将筛选的细胞消化收集,PBS 清洗三遍,制成单细胞悬液,重新铺板于15cm 培养皿中,用于挑取单克隆细胞。
1.3.5 PCR 鉴定TSC1 基因敲除:培养5~7 天后,挑取单克隆细胞于48 孔板继续培养。设计位于TCS1 基因的两个切割位点的上游和下游各一个确认引物TSC1-sg1up-Conf F 和TSC1-sg2down-Conf R(表1),PCR 产物的片段大小等于两引物之间的碱基数(1 218bp)减去两切割位点间的碱基数(832bp)之差(386bp)时(图1),初步判定为sgTSC1 双切割成功。收集48 孔板每个孔中一半的细胞,提取基因组进行PCR 鉴定,另一半细胞继续培养。
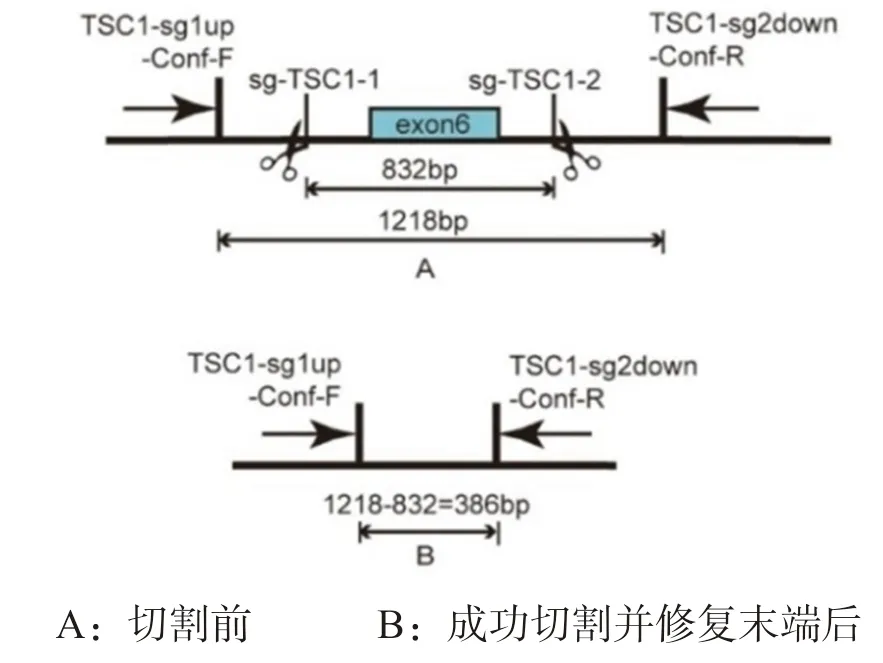
图1 PCR 鉴定原理示意图
1.3.6 Western blot 鉴定TSC1 基因敲除效果:选取PCR 阳性的结果进行扩大培养,收取细胞进行Western blot 鉴定。收集待测细胞进行裂解,离心取上清进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。凝胶电泳分离蛋白后,用PVDF 膜进行转印,封闭后用缓冲液洗膜后孵育一抗:内源抗体anti-TSC1 和内参抗体anti-β-tubulin。次日室温孵育二抗2h 后显影。
2 结果
2.1 重组质粒lentilCRISPRv2-sgTSC1 的构建 挑取单克隆菌落lentilCRISPRv2-sgTSC1-1 和lentilCRISPRv2-sgTSC1-2 送生工公司进行测序,测序结果见图2,两条目的sgTSC1序列分别已经正确插入载体,证明用于TSC1 基因敲除的两个重组质粒构建成功。
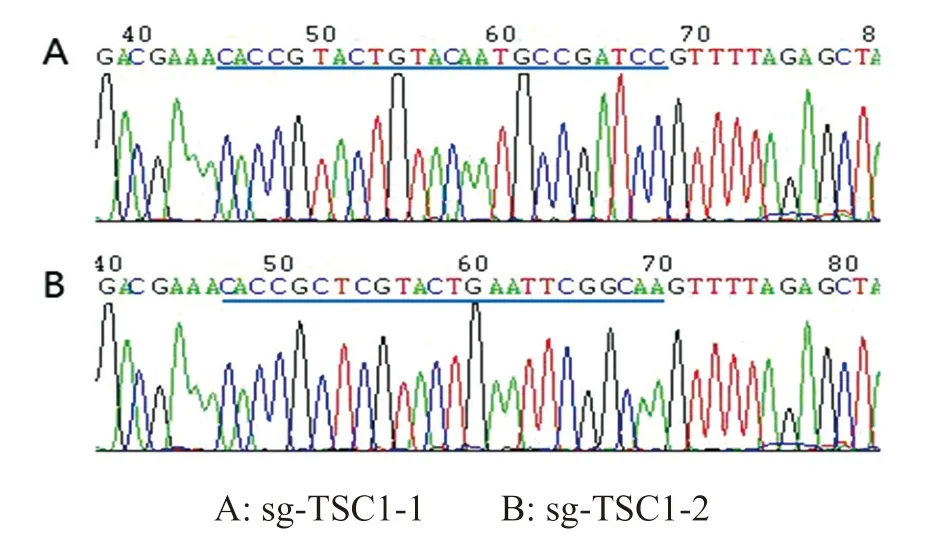
图2 插入sgTSC1 的测序结果
2.2 PCR 鉴定lentilCRISPRv2-sgTSC1 成功转染并对TSC1 基因进行有效切割 对48 孔板中的单克隆细胞进行PCR 鉴定,以转染筛选后的混合细胞所提基因组为阳性对照,空转的细胞为阴性对照,结果显示2F6 和4C8 两孔细胞出现386bp 的正确条带(见图3)。且条带单一,无其他大小的杂带,即初步鉴定TSC1 基因敲除成功。

图3 琼脂糖凝胶电泳检测单克隆细胞基因敲除的DNA 片段
2.3 Western blot 鉴定HEK293 细胞TSC1 基因敲除 Western blot 显影结果显示2F6 细胞的140KD处仍有明显条带(见图4),说明TSC1 没有敲除,4C8 细胞的140KD 处无条带,说明TSC1 基因无表达,提示成功敲除,即4C8 细胞为TSC1 敲除的稳定细胞株,命名为HEK293-TSC1-KO,扩大培养后及时冻存。
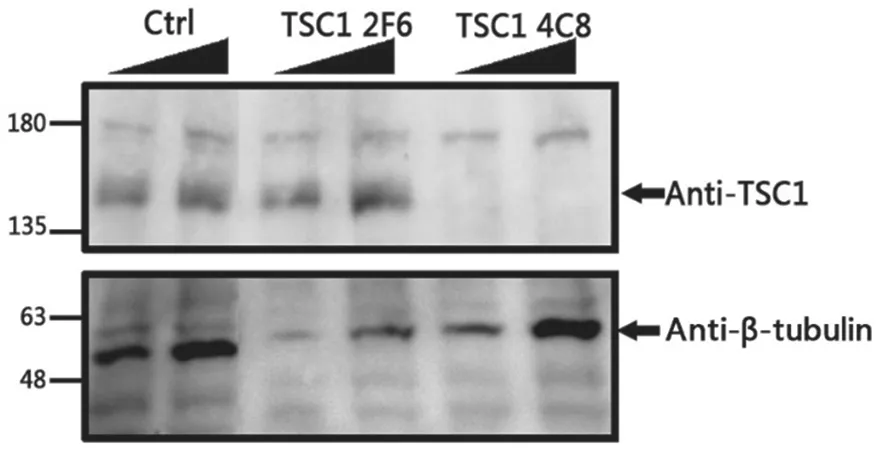
图4 Western blot 检测TSC1 的敲除效果
3 讨论
TSC 几乎累及所有器官,其中肾脏病变、癫痫及新生儿心脏横纹肌瘤是TSC 患者常见的死因[7-8]。近年来有研究报道,TSC1 可调节骨髓造血干细胞及间充质干细胞的自我更新和分化;TSC1 通过不同信号通路促进巨噬细胞M2 极化减弱M1 极化而抑制炎症反应,在动物实验中发现,TSC1 的失活能促进糖尿病小鼠肾小管上皮发生上皮-间质转化(epithelial-tomesenchymal transition,EMT),mTOR 抑制剂在控制糖尿病肾纤维化有潜在意义[9-12]。因此,构建TCS1基因敲除的稳定细胞系能在细胞水平上模拟TSC1相关的分子机制。故本文利用CRISPR/Cas9 基因编辑系统,采用双位点切割的方法进行敲除[13],单个位点切割在一定程度上会发生脱靶效应,而双sgRNA 进行双位点切割,能够显著降低脱靶效应[14-15]。本研究设计了针对TSC1 基因的两条sgRNA,分别位于6 号外显子的上游和下游。对6号外显子进行整体敲除,高效引发移码突变,从而实现对TSC1 基因的编辑。
我们利用HEK293 细胞转染lentilCRISPRv2-sgTSC1 的两个切割质粒后,对单克隆细胞进行PCR 鉴定,结果挑取单一明亮的386bp 目的条带,即2F6 和4C8 两株细胞。部分泳道电泳结果有多条杂带,可能是在挑取或培养单克隆细胞的过程中有携带污染。最后我们选取2F6 和4C8 两株细胞进行Western blot 鉴定,并进行不同浓度的检测。结果2F6 细胞中TSC1 蛋白并无明显表达差异,可能是在培养过程中发生污染,应注意移液枪吸取液体后不应在样品上方移动,实验操作应轻柔,避免液滴飞溅污染其他细胞。4C8 细胞在上样量为梯度的情况下,均无表达,说明该蛋白已被完全敲除,可用于后续细胞水平的研究。
本文利用分子克隆方法构建了含有不同sgRNA 的重组质粒lentilCRISPRv2-sgTSC1-1 和lentilCRISPRv2-sgTSC1-2,并测序验证了质粒构建的正确性。利用CRISPR/Cas9 系统构建TSC1 基因敲除的HEK293 稳定细胞株,经PCR鉴定和Western blot 鉴定,TSC1基因被完全敲除。该敲除的细胞株为后续进一步研究TSC1 在结节性硬化症以及炎症、肿瘤中的生物学功能奠定了实验基础。

