非小细胞肺癌放化疗联合靶向治疗对血清肿瘤标志物、免疫功能及Cyclin D3水平影响的相关研究
王 旋,崔立春,党升强
(长安医院肿瘤科,西安 710016)
非小细胞肺癌(non-small cell lung cancer, NSCLC)是鳞状肺癌、肺腺癌等大细胞肺癌的统称,约占所有肺癌的80%,与小细胞癌相比,具有肿瘤细胞生长较慢的特点[1]。目前非小细胞肺癌临床治疗研究进展缓慢,非小细胞肺癌手术患者五年生存率仅为20%以内[2]。靶向治疗是随着基因学发展而发展起来的,如针对非小细胞肺癌表皮生长因子受体突变的表皮生长因子受体-转氨酶抑制剂(如吉非替尼、厄洛替尼、奥希替尼等)被广泛应用于非小细胞肺癌治疗,再如针对变性淋巴瘤激酶(denatured lymphoma kinase,DLK)融合基因重排的阿来替尼、布加替尼等也被广泛应用于非小细胞肺癌治疗,另外对于无基因突变的抑制血管生成药物(如贝伐珠单抗、安罗替尼等),这些靶向治疗药物应用均可获取到较高的应答率,可显著提升非小细胞肺癌患者的无疾病进展生存期[3-5]。本项研究带着非小细胞肺癌临床工作实践中的实际问题,观察放化疗联合靶向治疗在非小细胞肺癌中的应用,并分析其对病情相关因子的影响,以期为临床提供参考。
1 材料与方法
1.1 研究对象 项目获得医院伦理委员会的批准。以2014年6月~2017年1月长安医院收治的136例非小细胞肺癌病例为前瞻性研究对象。病例纳入标准:①接受培美曲塞+卡铂化疗和放射治疗;②年龄不低于18 岁,且至少有一处可测量的转移病灶;③无任何(或有效控制)的严重全身系统性基础疾病,如心脏系统疾病、肝脏细胞疾病、免疫系统疾病等;④接受实验化疗方案前,肿瘤患者体力状态评分低于2 分,且预计生存时间不低于3 个月;⑤自愿接受临床医师推荐本研究治疗方案,签署化疗知情书。病例排除标准:①妊娠期妇女和哺乳期妇女;②有任何严重的(或未能有效控制的)全身性系统疾病。③接受实验方案前,肿瘤患者体力状态功能评分高于2 分者,且预计生存时间低于3 个月者。病例脱失标准:①因任何原因失访者和转院者;②中途要求终止实验方案的依从性不佳者;③中途改变临床实验方案者。根据患者就诊先后顺序从1~136 编号,采用巢式对照研究法分组:以确诊为非小细胞肺癌为研究起点,将接受化疗、放射联合靶向治疗的病例纳入放化疗联合靶向组,放化疗联合靶向组每入组1 例病例,选择最近时间基线资料(包括人口学资料:年龄、性别;病情情况:病理分型、转移部位、肿瘤患者体力状态评分;实验室指标:白细胞计数、中性粒细胞、血小板、血红蛋白)相匹配的接受单纯化疗、放射的病例纳入单纯放化疗组,最终研究时限内放化疗联合靶向组和单纯放化疗组均分别纳入病例68 例。放化疗联合靶向组和单纯放化疗组在人口学资料(年龄、性别)、病情情况(病理分型、转移部位、肿瘤患者体力状态评分)、实验室指标(白细胞计数、中性粒细胞、血小板、血红蛋白)等基线资料上比较差异无统计学意义(均P>0.05)。
1.2 仪器与试剂 贝克曼CytoFLEX 流式细胞仪购自美国贝克曼库尔特公司;荧光免疫分析仪购自北京科思佳科技有限责任公司;糖类抗原125(caccharide antigen 125,CA125),糖类抗原153(caccharide antigen 153,CA153),端粒酶(telomerase59,TRIM59),环氧化酶(cycloxygenase,COX),癌胚抗原(Carcinoembryonic,CEA),细胞角蛋白21-1(cytokeratin 21-1,cyfra21-1),鳞癌抗原(squamouse cell carcinoma antigen,SCC),细胞周期蛋白D3(D3 of cyclin,Cyclin D3),分化簇3( cluster differentiation 3,CD3),分化簇4(cluster differentiation 4,CD4),分化簇 8( Cluster Differentiation 8,CD8),免疫球蛋白A(immunoglobulin A IgA),免疫球蛋白G(immunoglobulin G, IgG),免疫球蛋白M(immunoglobulin M,IgM)等试剂盒购自上海心语生物科技。
1.3 方法 单纯放化疗组予以培美曲塞+卡铂化疗(每周1 次)联合和放射治疗(每周1 次)。放化疗联合靶向组在化疗和放射治疗基础上予以靶向药物(吉非替尼、或克唑替尼、或贝伐珠单抗)治疗。以疗效评价指标、血清相关指标及不良反应作为疗效和安全性评价指标。①疗效评价指标包括无疾病进展生存时间和总生存时间。②血清相关指标包括肿瘤标志物、免疫相关指标和Cyclin D3,均于治疗前和治疗3 个月时抽血检测,肿瘤标志物和Cyclin D3 采用FIA-102 荧光免疫分析仪以荧光免疫分析法检测,免疫相关指标采用贝克曼CytoFLEX流式细胞仪检测。③安全性评价。以NCI-CTCAE version 4.0[6]为评估标准,统计白细胞减少、中性粒细胞减少、血小板减少等不良事件发生情况。
1.4 统计学分析 以SPSS17.0数据统计分析工具,以P<0.05 为差异具有统计学意义。年龄、总生存时间、血小板计数等资料采用均数±标准差(±s)描述,不良反应率等资料用频数描述,采用t检验、χ2检验、秩和检验等进行组间差异分析;绘制生存时间Kaplan-Meier 曲线,并采用log-rank 检验分析生存期差异。
2 结果
2.1 疗效综合评价分析 截止2019年10月31日,放化疗联合靶向组和单纯放化疗组患者除死亡病例(放化疗联合靶向组4 例,单纯放化疗组8 例)外,均未因严重药物不良反应而终止治疗或转院等情况,未出现研究病例脱落。Kaplan–Meier曲线见图1。放化疗联合靶向组的无疾病进展生存时间(6.1±1.2月)长于单纯放化疗组 (4.8±0.9月),经log-rank检验差异具有统计学意义(95% CI:3.880~8.781,t=6.563,P=0.003<0.05)。放化疗联合靶向组平均总生存时间(13.6±1.8月)长于单纯放化疗组(11.3±1.4月),经log-rank 检验差异具有统计学意义(95%CI:2.674~12.429,t=7.639,P=0.019<0.05)。
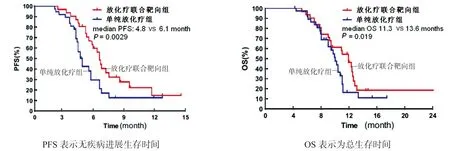
图1 放化疗联合靶向组和单纯放化疗组生存期的Kaplan–Meier 曲线
2.2 肿瘤标志物及Cyclin D3 表达分析 见表1。非小细胞肺癌标志物(CA125,CA153,TRIM59,COX,CEA,cyfra21-1,SCC) 及Cyclin D3 表达数据显示。治疗前,放化疗联合靶向组和单纯放化疗组的标志物比较,差异均无统计学意义(t=0.108~0.617,均P>0.05);与治疗前比较,治疗后放化疗联合靶向组和单纯放化疗组肿瘤标志物均下降,但放化疗联合靶向组标志物下降幅度高于单纯放化疗组,差异具有统计学意义(t=8.615~21.816,均P<0.05)。
表1 放化疗联合靶向组和单纯放化疗组肿瘤标志物情况分析(±s,U/ml)
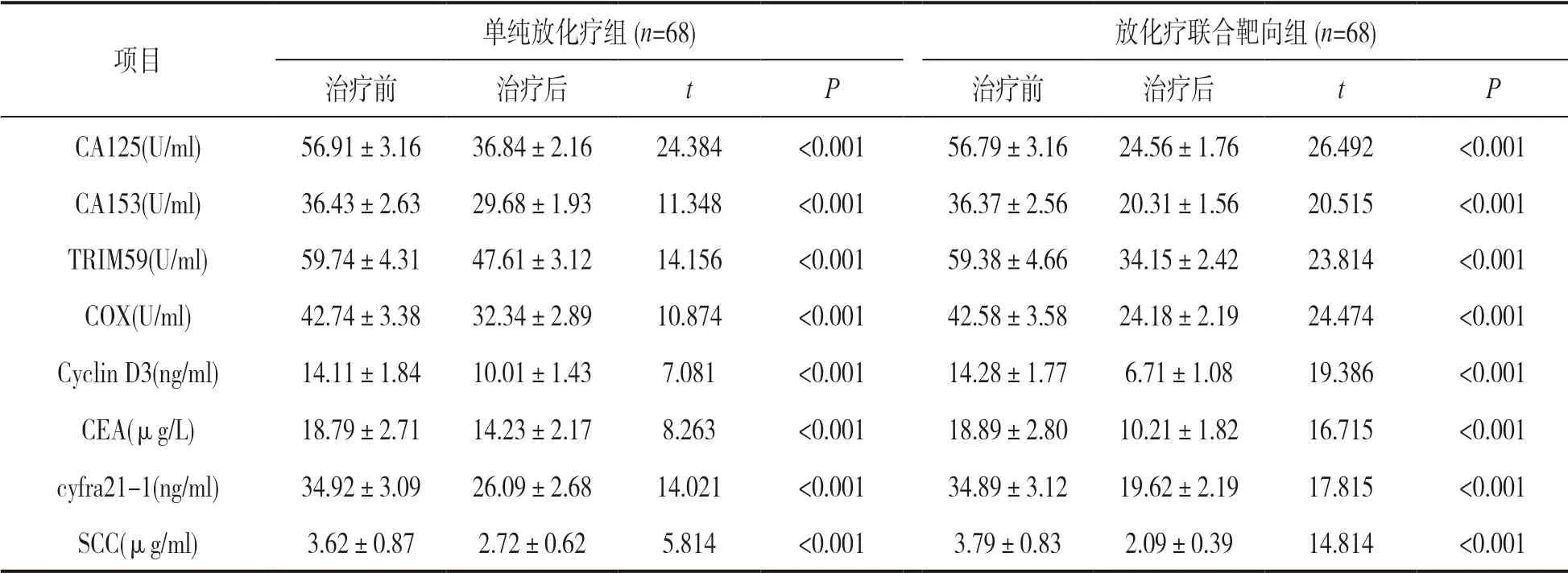
表1 放化疗联合靶向组和单纯放化疗组肿瘤标志物情况分析(±s,U/ml)
项目单纯放化疗组(n=68)放化疗联合靶向组(n=68)治疗前治疗后tP治疗前治疗后tP CA125(U/ml)56.91±3.1636.84±2.1624.384<0.00156.79±3.1624.56±1.7626.492<0.001 CA153(U/ml)36.43±2.6329.68±1.9311.348<0.00136.37±2.5620.31±1.5620.515<0.001 TRIM59(U/ml)59.74±4.3147.61±3.1214.156<0.00159.38±4.6634.15±2.4223.814<0.001 COX(U/ml)42.74±3.3832.34±2.8910.874<0.00142.58±3.5824.18±2.1924.474<0.001 Cyclin D3(ng/ml)14.11±1.8410.01±1.437.081<0.00114.28±1.776.71±1.0819.386<0.001 CEA(μg/L)18.79±2.7114.23±2.178.263<0.00118.89±2.8010.21±1.8216.715<0.001 cyfra21-1(ng/ml)34.92±3.0926.09±2.6814.021<0.00134.89±3.1219.62±2.1917.815<0.001 SCC(μg/ml)3.62±0.872.72±0.625.814<0.0013.79±0.832.09±0.3914.814<0.001
2.3 免疫功能指标分析 见表2。T 细胞亚群指标(CD3+,CD4+,CD4+/CD8+)和免疫球蛋白指标(Ig G,Ig A,Ig M)数据显示:治疗前,放化疗联合靶向组和单纯放化疗组的T 细胞亚群指标和免疫球蛋白指标比较,差异无统计学意义(P>0.05) ;与治疗前比较,治疗后放化疗联合靶向组和单纯放化疗组的T细胞亚群指标和免疫球蛋白指标均提升,但放化疗联合靶向组标志物提升幅度高于单纯放化疗组,差异具有统计学意义(t=11.617~26.384,均P<0.05)。
表2 放化联合靶向组和单纯放化疗组的免疫功能指标分析分析(±s)
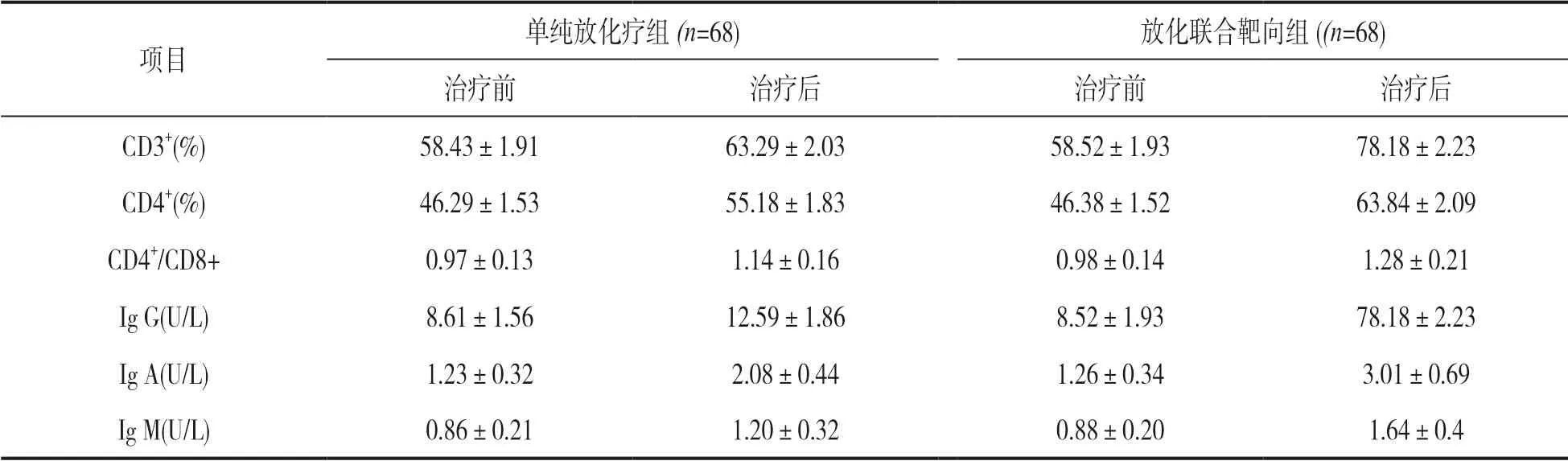
表2 放化联合靶向组和单纯放化疗组的免疫功能指标分析分析(±s)
项目单纯放化疗组(n=68)放化联合靶向组((n=68)治疗前治疗后治疗前治疗后CD3+(%)58.43±1.9163.29±2.0358.52±1.9378.18±2.23 CD4+(%)46.29±1.5355.18±1.8346.38±1.5263.84±2.09 CD4+/CD8+0.97±0.131.14±0.160.98±0.141.28±0.21 Ig G(U/L)8.61±1.5612.59±1.868.52±1.9378.18±2.23 Ig A(U/L)1.23±0.322.08±0.441.26±0.343.01±0.69 Ig M(U/L)0.86±0.211.20±0.320.88±0.201.64±0.4
2.4 安全性分析 放化疗联合靶向组和单纯放化疗组全部患者均接受血液毒性评估,统计3 级、4 级等强血液毒性不良反应情况(见表3)。放化疗联合靶向组和单纯放化疗组在白细胞减少率、中性粒细胞减少率、血小板减少率、恶心率、呕吐率等不良药物反应上比较,差异无统计学意义(χ2=0.000~0.697,均P≥0.05)。

表3 放化联合靶向组和单纯放化疗组的化疗药物3~4 级不良反应比较[n(%)]
3 讨论
高发病率、高病死率使肺癌成为全球医学界临床研究的热点。最新2018年数据显示:2018年全球累计新发肺癌病例380 万,相比2017年的340万,增长了11.7 %[7],同时肺癌患者5年生存率很低,约在20%左右,远远低于其余三大恶性肿瘤(乳腺癌为67.8%,胃癌为71.2 %、结肠癌为64.3%)[8-9]。非小细胞肺癌是鳞状肺癌、肺腺癌等大细胞肺癌的统称,是肺癌中最常见类型,放化疗是治疗的主要方案。近年靶向治疗在非小细胞肺癌治疗中也得到广泛应用,主要包括三个方面:①对于表皮生长因子受体EGFR 突变非小细胞癌,可使用吉非替尼、厄洛替尼、阿法替尼、奥希替尼等靶向治疗[10],70%以上的NSCLC 患者能够获得临床病情控制[11];②对于间变性淋巴瘤激酶(ALK)融合基因重排的非小细胞肺癌,主要采用克唑替尼、阿来替尼、布加替尼等药物靶向治疗[12],具有临床疗效较佳,副作用小的优势、在非小细胞肺癌的临床治疗中取得了瞩目疗效[13-14];③对于无明显基因突变的非小细胞癌,可采用抑制血管生成药物,如贝伐珠单抗、安罗替尼等靶向治疗[15],可使非小细胞肺癌患者近期(9 个月)的病情客观缓解率(客观控制率)达70%左右[16]。本研究将放化疗联合靶向治疗方案应用于非小细胞肺癌,结果显示:与单纯放化疗方案相比,放化疗联合靶向治疗非小细胞肺癌并未出现更多临床不良反应,但可获得更长的无疾病进展生存时间、总生存时间的临床收益。到目前为止,放化疗联合靶向治疗方案治疗非小细胞肺癌可获得较高的临床收益这已经得到研究证实,国外学者FOSSELLA 等[17]的研究显示,放化疗辅助以靶向治疗方案,可改善非小细胞肺癌的总生存期。
放化疗联合靶向治疗非小细胞肺癌可取得较佳临床疗效的机制研究涉及较少,从本研究结果来看其机制可能有两个方面:其一,与单纯放化疗方案相比,放化疗联合靶向治疗方面可改善非小细胞肺癌患者的癌标志物表达水平。本研究中与治疗前比较,治疗后放化疗联合靶向组和单纯放化疗组的标志物及Cyclin D3 均下降,但放化疗联合靶向组标志物及Cyclin D3 下降幅度高于单纯放化疗组(P<0.05)。CA125,CA153 均为糖类抗原,其高表达可激活蛋白激酶的活性,促进肿瘤细胞分裂、增殖和转化,是包括非小细胞肺癌在内的多种癌症的重要标志物[18]。TRIM59 是由RNA 和蛋白质组成的核糖端粒酶,TRIM59 的激活或高表达可导致细胞无限增殖,是体细胞向肿瘤转化中的关键因子,近年已经成为非小细胞肺癌的标志物之一[19]。环氧化酶(COX)是一种双功能酶,不仅是具有过氧化氢活性酶,也是体细胞向肿瘤转化的催化物质,COX 也可促进乳腺癌细胞增殖和抑制细胞凋亡。癌胚抗原(CEA)最初发现于结肠癌和胎儿肠组织中,故名癌胚抗原,CEA 升高常见于大肠癌、胃癌、肺癌等[20]。cyfra21-1 目前被认为是一种主要用于检测肺癌的肿瘤标记物,尤其对非小细胞肺癌的诊断具有重要价值,若肺部存在不清晰的环形阴影,同时血清人细胞角质片断21-1(CYFRA21-1)浓度>30ng/ml,非小细胞肺癌的可能性非常高[21]。SCC异常高表达常见于鳞癌,同时异常高表达也见于宫颈癌、肺癌、卵巢癌等[22],目前均为临床常用非小细胞癌标志物。近年来,Cyclin D3 异常表达在多种肿瘤发病过程中的作用颇受临床关注,报道中显示Cyclin D3高表达可促进非小细胞肺癌病情进展,使Cyclin D3 成为非小细胞肺癌病因学研究中的热点[23-24]。综合既往研究结果及本研究结果来看,放化疗联合靶向治疗非小细胞肺癌,可抑制非小细胞癌肿瘤标志物及Cyclin D3 的高表达,这可能为放化疗联合靶向治疗方案可取得较佳临床收益的一个作用机制。其二,与单纯放化疗方案相比,放化疗联合靶向治疗方面可改善非小细胞肺癌患者的免疫功能。
本研究中,与治疗前比较,治疗后放化疗联合靶向组和单纯放化疗组的T 细胞亚群指标和免疫球蛋白指标均提升,但放化疗联合靶向组标志物提升幅度高于单纯放化疗组(P<0.05)。Th1 淋巴细胞可分泌出CD4,CD3 等免疫应答产物,均是重要的免疫相关因子;而Th2 主要分泌CD8,其高度分泌可促进炎性因子分泌,对T 淋巴细胞的免疫功能产生影响[25]。另外免疫球蛋白是机体黏膜防御系统的重要组成部分,可有效抑制肿瘤细胞在黏膜组织中的复制,对于大部分肿瘤细胞均具有抗体活性。如IgM 是机体免疫防御体系中不可或缺的组成部分,也是增强机体免疫力抵抗肿瘤细胞侵袭的重要物质[26],同时Ig G 和Ig A 也具有相似的功能[27]。可见,免疫功能在非小细胞肺癌临床治疗效果提升中的作用不言而喻,结合本研究结论来看,与单纯放化疗方案相比,放化疗联合靶向治疗非小细胞肺癌,可显著改善非小细胞肺癌患者免疫功能,这也有可能是放化疗联合靶向治疗方案可取得较佳临床收益的另一个作用机制。
综上所述,与单纯放化疗方案相比,放化疗联合靶向治疗非小细胞肺癌并未出现更多临床不良反应,同时也可改善肿瘤标志物、免疫功能及Cyclin D3 等病情相关指标表达,使其获得更长的无疾病进展生存时间、总生存时间的临床收益,故值得临床推广。但是,本研究也存在一定的局限性,如在临床随机分组设计中,虽然尽可能排除了研究结果干扰因素,但由于临床病例收集困难,可能使研究结果存在有一定的偏倚,这个局限性希望后续研究能进一步证实。

