老年糖尿病肾病患者血清SP-D水平表达及其基因多态性与并发肺部感染的相关性研究
闫海燕,杨云秀,杨云华,宋晓伟,缑 剑
(1.咸阳市第一人民医院呼吸与危重症医学科 陕西咸阳 712000;2.陕西唐华四棉医院呼吸科,西安 710038;3.西安北车医院内科,西安 710085)
糖尿病肾病(diabetic nephropathy,DN)是因糖尿病进展累及肾脏微血管引起的肾小球硬化症,DN 也成为终末期肾病的主要原因[1]。目前认为,肺部感染是DN 常见并发症。糖脂代谢紊乱是DN 的重要机制,DN 患者长期处于高血糖状态,自身免疫防御能力降低,尤其是老年患者,全身机体功能衰退,更易发生肺部感染[2-3]。而肺部感染可进一步加重肾损伤。因而,长期以来,肺部感染一直是老年DN 患者防治重点。表面活性蛋白D(surfactant protein D,SP-D)是由Ⅱ型肺泡细胞和呼吸性细支气管clara 细胞分泌的蛋白,既往研究证实SP-D 与慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)发病和病理进展密切相关,SP-D 与肺功能水平具有显著相关性[4-5]。但有关SP-D 与DN 患者并发肺部感染的关系,国内却少有报道。本研究纳入108 例老年DN患者作为研究对象,探讨SP-D 在DN 并发肺部感染中的作用和临床应用价值。报道如下。
1 材料与方法
1.1 研究对象 收集2018年4月~2020年10月咸阳市第一人民医院108 例老年DN 患者作为研究对象,纳入标准:①DN 诊断参照中华医学会内分泌学会推荐共识标准[6];②患者临床病例资料完整。排除标准:①并发原发性肾小球肾炎、肾盂肾炎及肾病综合征患者;②并发有恶性肿瘤者;③并发有肺结核、支气管炎及肺间质性疾病者。根据是否并发肺部感染,将108 例DN 患者分为感染组(n=26,并发肺部感染)和对照组(n=82,未并发肺部感染)。感染组26 例患者中男性17 例,女性9例;年龄70.21±4.75 岁;体重指数20.29±1.81kg/m2;病程3.58±1.09年。对照组82 例患者中男性64 例,女性18 例;年龄69.53±4.47 岁;体重指数20.34±2.01kg/m2;病程3.60±0.84年。两组患者基本资料比较,差异均无统计学意义(P>0.05)。根据肺炎严重指数(pneumonia severity index,PSI)评分[7],将感染患者分为轻度组(PSI 评分<91 分),中度组(91≤PSI评分≤130分)及重度组(PSI评分>130分)。
1.2 仪器和试剂 博科BIOBASE TGL-18M 型离心机,ELISA 试剂盒(上海赛默科技生物发展有限公司),磷酸盐缓冲液(phosphate buffer saline,PBS)(上海纯优生物科技有限公司),细胞裂解液(南京信帆生物技术有限公司),蛋白酶K(洛阳惠尔纳米科技有限公司),酚氯仿异戊醇、醋酸钠(北京普博欣生物科技有限责任公司)。
1.3 方法 血清SP-D 检测:在DN 确诊后3 天内取108 例患者清晨空腹肘静脉血5ml,3 000r/min 离心10min后取上清液,采用ELISA法检测血清SP-D水平。
DNA 提取:取确诊后3 天内空腹肘静脉血3ml作为检测标本,将静脉血置于含有EDTA 的抗凝管中,冷冻备用。提取DNA 步骤:①先将标本解冻,以等量PBS 与之混匀,3 000r/min 离心10min,弃上清液,加入细胞裂解液300μl,混匀后37℃下水浴60min,再依次加入20g/dl 的SDS 液25μl 和蛋白酶K 20μl,水浴过夜。②取水浴后的细胞液,按3:1比例与酚氯仿异戊醇混匀,离心后取上清液,再次重复上述操作1 次。③取上清液400μl,再加入无水乙醇和醋酸钠800μl 和15μl,沉淀DNA,再以8 000r/min 离心,弃上清液。④以70ml/dl 乙醇洗涤沉淀,再加入Tris-EDTA 液20μl,溶解后冷冻保存。
PCR-RFLP 检测:采用PCR-RFLP 法检测SP-D基因多态性,记录SP-D 基因Metll Thr (rs721917 T/C)位点频率分布情况,PCR 扩增条件:PCR 扩增引物:上游:5’-TCACCTCTCAGGCCATGCTGCTCTT CCTCC-3’,下游:5’-GAGCTACACATGACCAG GGTGCAAGCACTG-3’。反应体系:15μl 2×PCR PLUS MIX,1.5μl DNA 模板,上下游引物各0.5μl,10×PCR 缓冲液2.5μl。反应条件:95 ℃预变性5min,94℃ 变性0.5min,58℃退火 1min,72℃延迟0.5min,40 个循环。72℃延迟5min。
1.4 统计学分析 选用SPSS 24.0 软件对数据进行统计学分析,计量资料以均数±标准差(±s)表示,组间行t检验,计数资料以[n(%)]表示,组间行χ2检验,预测价值采用受试者工作曲线(receiver operator characteristic,ROC)分析,P<0.05 为差异有统计学意义。
2 结果
2.1 两组SP-D 和基因位点分布 感染组血清SP-D水平为24.18±5.39ng/L,对照组血清SP-D 水平为20.02±4.54ng/L,两组间差异有统计学意义(t=3.888,P<0.001)。SP-D 基因型位点率分布差异均有统计学意义(P<0.05)。见表1。
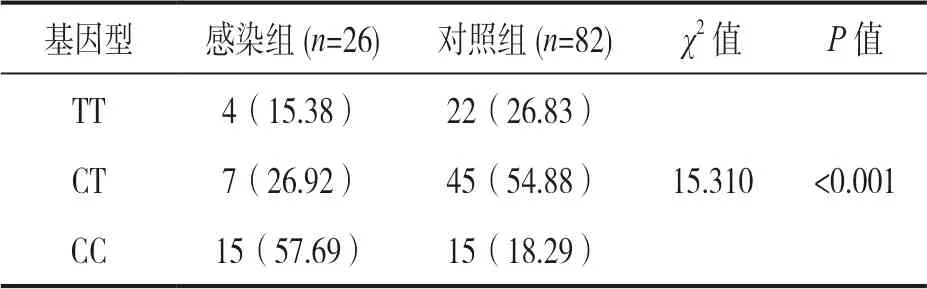
表1 两组基因位点分布[n(%)]
2.2 不同肺炎程度患者SP-D 水平比较 26 例肺部感染患者中轻度14 例,中度8 例,重度4 例。轻度组患者血清SP-D 为 17.24±3.77 ng/L,中度组23.17±3.82 ng/L,重度组25.29±2.18 ng/L。三组患者血清SP-D水平比较,差异有统计学意义(F=11.325,P<0.001)。
2.3 不同肺炎程度患者SP-D基因多态性分布 见表2。不同程度肺部感染患者SP-D基因型频率分布比较,差异有统计学意义(χ2=4.288,P<0.001)。
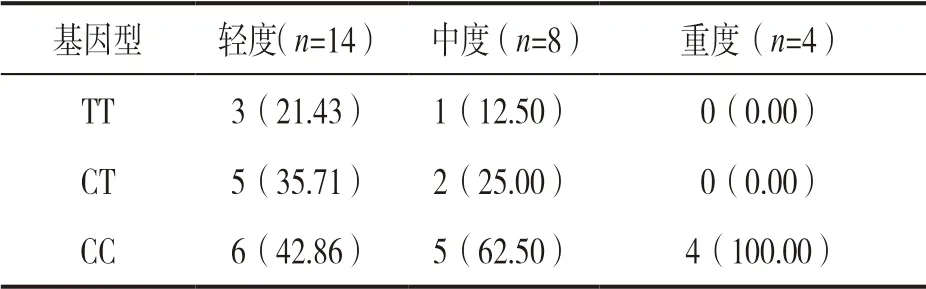
表2 不同肺炎程度患者SP-D 基因多态性分布
2.4 SP-D 判断DN 伴发肺部感染的价值分析 见图1。ROC 分析显示血清SP-D 判断DN 并发肺部感染的AUC 为0.779(SE=0.056,95%CI=0.669~0.890,P=0.000),敏感度为0.769,特异度为0.598。
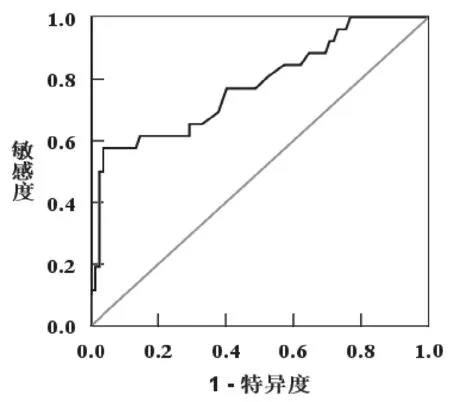
图1 SP-D 判断DN 伴发肺部感染的ROC 分析
3 讨论
DN 伴发肺部感染的病理机制较为复杂。长期的高血糖不仅可形成酸性环境,直接破坏机体抵抗力,还可导致和加重肺组织缺氧,增加肺部感染的易感性[8]。另外,随着DN 患者体液免疫失调,白细胞粘附作用减弱,为致病菌的滋生繁殖创造了条件[9]。SP-D 是具有维持肺泡表面活性物质稳定和保护肺组织局部免疫功能的亲水性蛋白,基础实验显示SP-D对中性粒细胞、单核-巨噬细胞具有趋化作用,还可通过抑制炎性因子合成,缓解肺部炎症,而对于肺炎链球菌、金黄色葡萄球菌等肺部常见病原菌,则具有与IgG 相近的作用,增强吞噬细胞活性,促进病原菌的吞噬[10-12]。本研究对比DN 并发肺部感染与未感染者血清SP-D 水平,也发现两组间血清SP-D 差异有统计学意义,提示监测SP-D 有助于判断肺部感染风险。而ROC 分析显示血清SP-D 判断DN 并发肺部感染的AUC 为0.779,这进一步证实SP-D 水平对预测肺部感染具有一定应用价值,但血清SP-D 敏感度和特异度均有限。这可能与SP-D 基因多态性有关。
SP-D基因多态性与肺疾病的关系已被临床报道。SP-D Metll Thr(rs721917 T/C)的多态性是目前临床关注较多的SP-D 基因,徐丽等[13]认为rs721917 等位基因与间质性肺炎相关,而ISHII 等[14]的一项研究发现rs721917C 可能增加COPD 易感性。rs721917位点不同基因型表达可影响其正常结构和功能[15],本研究发现感染组与对照组rs721917 位点基因型分布差异有统计学意义,提示SP-D 基因rs721719 位点多态性与DN 患者并发肺部感染的易感性有关。对于血清SP-D 升高的CC 基因型DN 患者,并发肺部感染的机率更高。另外,本研究还发现不同肺炎程度患者血清SP-D 及其基因型表达也存在显著性差异,提示SP-D 可能参与肺部感染的病理进展。随着肺部感染的发生发展,肺泡毛细血管屏障功能受损,使SP-D 进入血液循环,进而使血清SP-D 水平升高[16]。因而,血清SP-D 可作为判断肺部感染严重程度的判断依据。而对于rs721917 位点CC 基因型患者,较其他位点,肺功能损伤程度更重[17]。本研究也显示CC 基因型肺部感染病情更为严重,与上述报道结果一致。
综上,血清SP-D 水平有助于判断DN 并发肺部感染风险,CC 基因型患者较其他基因型患者更易发生肺部感染,且病情较重。

