人绒毛膜促性腺激素对男性低促性性腺功能减退所致不育症患者疗效观察
张 刚
(徐州市妇幼保健院男性科,江苏徐州 221009)
男性低促性性腺功能减退是由促性腺激素合成或分泌不足而导致的少见疾病,多数患者因性腺睾丸功能受损而出现精子生成不足,最终诱发不育症[1]。目前,雄激素代替治疗与脉冲式促性腺激素释放素(GnRH)为临床治疗男性低促性性腺功能减退所致不育症的常用方案,其能在一定程度上调节性激素水平,但长期使用雄激素治疗会对睾丸生精功能产生不良影响。人绒毛膜促性腺激素(hCG)作为糖蛋白的一种,为胎盘滋养层细胞分泌,在男性生殖系统疾病的治疗中已取得较好的应用效果[2]。本研究旨在探讨hCG对男性低促性性腺功能减退所致不育症患者第二性征发育与性激素水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2018年2月至2020年4月徐州市妇幼保健院收治的86例男性低促性性腺功能减退所致不育症患者,按随机数字表法分为43例对照组和43例观察组。对照组患者年龄22~29岁,平均(25.74±1.90)岁。观察组患者年龄22~30岁,平均(24.80±1.96)岁。两组患者一般资料比较,差异无统计学意义(P>0.05),组间具有对比性。纳入标准:符合《男性低促性腺激素性性腺功能减退症的诊治》[3]中关于男性低促性性腺功能减退与不育症的诊断标准者;第二性征发育部分或全部丢失者;生殖系统发育结构正常者。排除标准:肝肾功能异常者;合并其他影响性腺轴的疾病者;合并慢性消耗性疾病者。所有患者均已签署知情同意书,且本研究经徐州市妇幼保健院院内医学伦理委员会批准。
1.2 方法 对照组患者行常规对症治疗,雄激素替代治疗,肌内注射十一酸睾酮注射液(浙江仙琚制药股份有限公司,国药准字H10900063,规格:2 mL∶0.25 g),0.25 g/次,1次/月;脉冲式GnRH治疗:使用激素脉冲输注泵,皮下输注注射用戈那瑞林(马鞍山丰原制药有限公司,国药准字 H10960064,规格:100 μg/支),每个脉冲输注10 μg,16个脉冲/d。观察组患者在对照组的基础上联合hCG治疗,肌内注射用绒促性素(北京赛升药业股份有限公司,国药准字H11021262,规格:500单位),2 000 IU/次,3次/周。两组患者均连续治疗6个月。
1.3 观察指标 ①使用直尺与睾丸体积测量器测量并比较两组患者治疗前、治疗6个月后阴茎静息长度与睾丸体积。②比较两组患者治疗前与治疗6个月后性激素水平,采集两组患者空腹静脉血5 mL,离心分离血清(转速设置为3 000 r/min,离心时间设置为10 min),采用全自动化学发光免疫分析法检测血清促黄体生成素(LH)、睾酮(T)、卵泡刺激素(FSH)水平。③比较两组患者痤疮、恶心、腹部不适不良反应发生情况。
1.4 统计学分析 采用SPSS 24.0统计软件分析数据,计量资料包含第二性征发育情况、性激素水平以()表示,行t检验,计数资料包含不良反应,以[ 例(%)]表示,行χ2检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 第二性征发育情况 与治疗前比,治疗6个月后两组患者睾丸体积均显著扩大,且观察组较对照组显著扩大,阴茎静息长度均显著变长,且观察组较对照组显著变长,差异均有统计学意义(均P<0.05),见表1。
表1 两组患者第二性征发育情况比较()
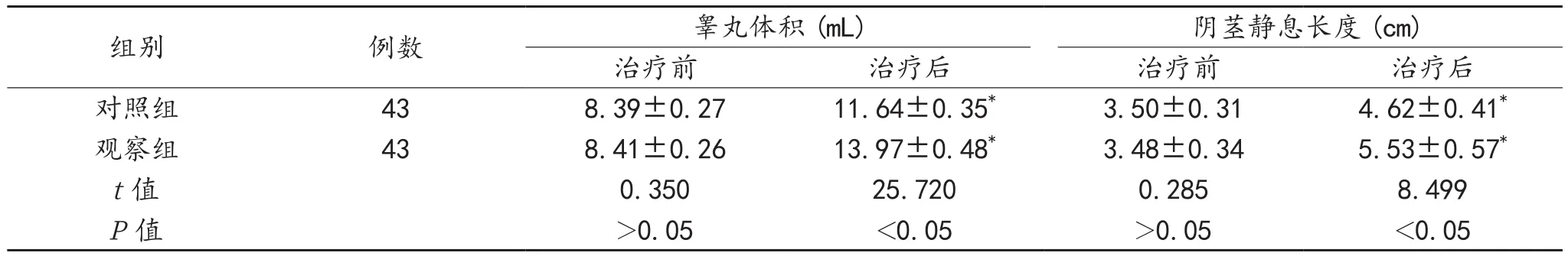
表1 两组患者第二性征发育情况比较()
注:与治疗前比,*P<0.05。
组别 例数 睾丸体积(mL) 阴茎静息长度(cm)治疗前 治疗后 治疗前 治疗后对照组 43 8.39±0.27 11.64±0.35* 3.50±0.31 4.62±0.41*观察组 43 8.41±0.26 13.97±0.48* 3.48±0.34 5.53±0.57*t值 0.350 25.720 0.285 8.499 P值 >0.05 <0.05 >0.05 <0.05
2.2 性激素水平 与治疗前比,治疗6个月后两组患者血清LH、T、FSH水平均显著升高,且观察组较对照组显著升高,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者性激素水平比较()
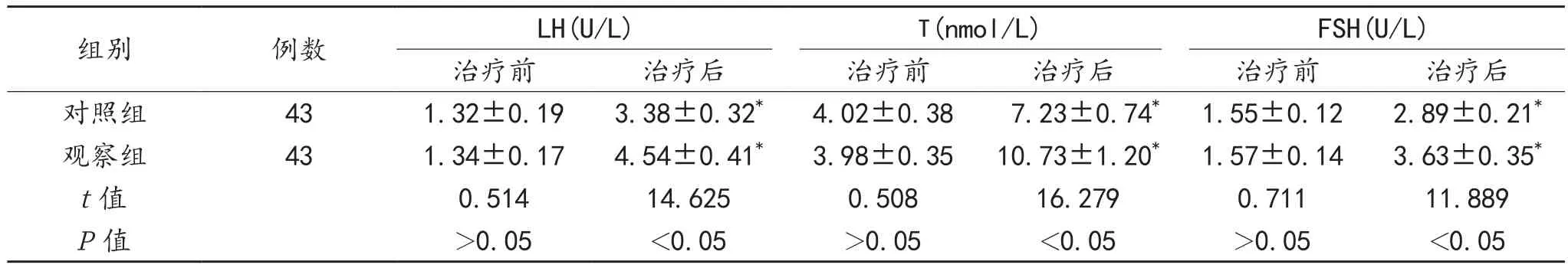
表2 两组患者性激素水平比较()
注:与治疗前比,*P<0.05。LH:促黄体生成素;T:睾酮;FSH:卵泡刺激素。
组别 例数 LH(U/L) T(nmol/L) FSH(U/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 43 1.32±0.19 3.38±0.32* 4.02±0.38 7.23±0.74* 1.55±0.12 2.89±0.21*观察组 43 1.34±0.17 4.54±0.41* 3.98±0.35 10.73±1.20* 1.57±0.14 3.63±0.35*t值 0.514 14.625 0.508 16.279 0.711 11.889 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 不良反应 治疗期间,两组患者不良反应总发生率比较,差异无统计学意义(P>0.05),见表3。
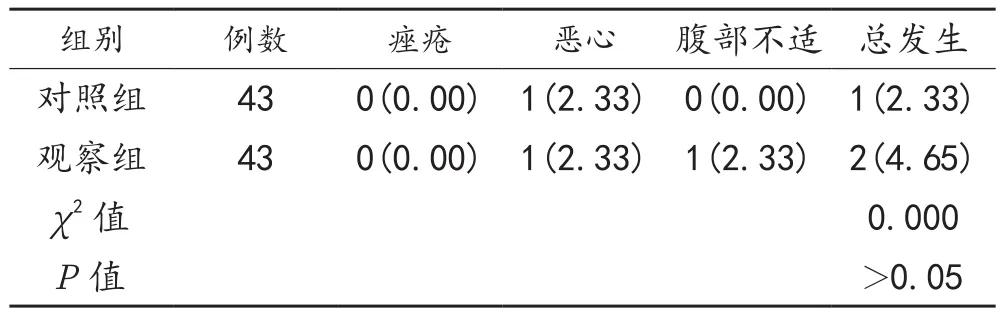
表3 两组患者不良反应发生率比较[例(%)]
3 讨论
男性低促性性腺功能减退多由遗传基因、下丘脑外伤等因素导致,患者发病后促性腺激素分泌不足,继而引起继发性睾丸功能损害,睾丸生精功能下降,最终出现不育症状。目前,临床治疗低性腺功能低下所致不育症患者多以雄激素替代或GnRH脉冲泵治疗为主,但外源性雄激素替代往往不能促进睾丸增长与精子生成,且长期使用具有一定的并发症发生风险;而GnRH脉冲泵可促进垂体分泌促性腺激素生成与睾丸的发育,但联合雄激素替代治疗的优势不明显,需积极探究更合理的用药方案[4]。
hCG可增强患者睾丸曲细精管功能,尤其在睾丸间质细胞活动中产生积极地促进作用,可加快雄激素的生成,而雄性激素水平的提高能够直接促进雄性器官生长与精子的产生[5]。同时,外源性补给hCG可促进睾丸内胰岛素样生长因子Ⅰ ( IGF- Ⅰ )的分泌,提高精子活力,增大睾丸体积,这对于改善患者不育症状具有重要意义[6]。据上述研究结果显示,治疗后观察组患者睾丸体积均较对照组显著增大,阴茎静息长度显均较对照组显著延长,提示hCG能够促进男性低促性性腺功能减退所致不育症患者第二性征发育,治疗效果显著。
FSH可作用于睾丸Sertoli细胞,为精子的发育提供营养场所;而LH可作用于睾丸间质Leydig细胞,为生殖细胞发育提供良好环境;而T可改善生育功能,提高精液质量,因此,LH、T、FSH可作为评估男性低促性性腺功能减退不育疗效的有效指标。hCG在结构与功能上与LH相似是一种是由胎盘滋养层细胞分泌促性腺激素;在类固醇激素生物合成过程中可启动类固醇合成,其主要机制在于甾体生长急性调节蛋白通过促进胆固醇从线粒体外模转运至内膜;而hCG能够作用于睾丸Leydig细胞,对甾体生长因子的生成产生影响,并依赖于Ⅰ型类固醇生成因子诱导急性调节蛋白表达,最终促进类固醇激素生成[7]。此外,hCG还可通过激活Leydig细胞膜上跨膜钙通道,提高细胞内钙离子含量,而作为第二信使的细胞内部钙离子,能够增强Ⅰ型类固醇生成因子介导的类固醇物质合成效应,进而提高T、LH、FSH等激素水平[8-9]。据上述研究结果显示,观察组患者治疗6个月后血清LH、T、FSH水平均显著高于对照组,提示hCG治疗男性低性腺功能低下所致不育症可有效提高性激素水平。但hCG治疗男性低促性性腺功能减退所致不育症安全性效果不理想,在治疗时应注意不良反应的发生,及时治疗。
综上,hCG治疗男性低促性性腺功能减退所致不育症效果较好,能够促进第二性征发育,提高性激素水平,但安全性有待提高。

