不同剂量阿托伐他汀对心肌梗死患者MMP-9、COX-2及CD40L水平的影响
王欢 熊辉 曾莉娜 姚松 程丽清
心肌梗死是指心肌缺氧缺血而发生的坏死,属于急性冠状动脉综合征范畴[1]。冠状动脉粥样硬化是引起本症的病理基础,临床经验指出,在急性心肌梗死的治疗中应重视调脂治疗[2]。阿托伐他汀是临床常用的他汀类调脂药物,可有效减轻动脉粥样斑块炎症,防止斑块破裂。
基质金属蛋白酶9(matrix metalloprotein-9,MMP-9)能够对粥样硬化斑块内细胞外不同类型的胶原与明胶进行降解,近年来其在心肌梗死中的应用价值引起热议[3]。研究表明,血管内皮细胞表达的环氧化酶-2(Cyclooxygenase-2,COX-2)在炎性反应中被大量诱导表达,导致炎性反应的放大和增强[4]。细胞黏附因子40L 型(cell adhesion factor 40L,CD40L)作为一种跨膜蛋白,可与B 淋巴细胞、巨噬细胞、内皮细胞、血管平滑细胞相结合而产生一系列炎症反应[5-6]。目前关于COX-2、CD40L 与心肌梗死临床过程的关系研究甚少。本研究就MMP-9、COX-2 及CD40L 在心肌梗死患者治疗中的变化进行分析,探讨其临床意义。
1 资料与方法
1.1 基线资料
选取2018年11月至2020年11月于本院接受治疗的急性心肌梗死90 例,纳入标准:①患者均满足急性心肌梗死诊断标准[7];②患者发病到入院时间小于12 h、血清心肌酶学标记物升高至2 倍以上、心电图显示至少2 个相邻的ST 段抬高,胸前导联≥2 min,肢体导联ST 段≥1 min,均持续胸痛≥30 min[8];③入组前未接受过溶栓药物、调脂药或雌激素治疗;④临床资料完整,所有患者均签署知情同意书。排除标准:①合并全身免疫性疾病;②对本研究所用药物过敏者;③合并其他类型心脏疾病者;④损伤性心肌梗死。
在治疗期间患者可耐受完成所有治疗及本研究所用阿托伐他汀药物一天使用最大剂量不超过80 mg 的基础上,根据阿托伐他汀的使用剂量分为大剂量组(40 mg)(n=49)和小剂量组(20 mg)(n=41),其中大剂量组男26 例,女23 例;平均年龄(58.54±1.40)岁;小剂量组男23 例,女18 例,平均年龄(58.63±1.52)岁;两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究已获得伦理委员会批准。
表1 两组一般资料比较[(n(%),(±s)]Table 1 Comparison of general data between 2 groups[(n(%),(±s)]
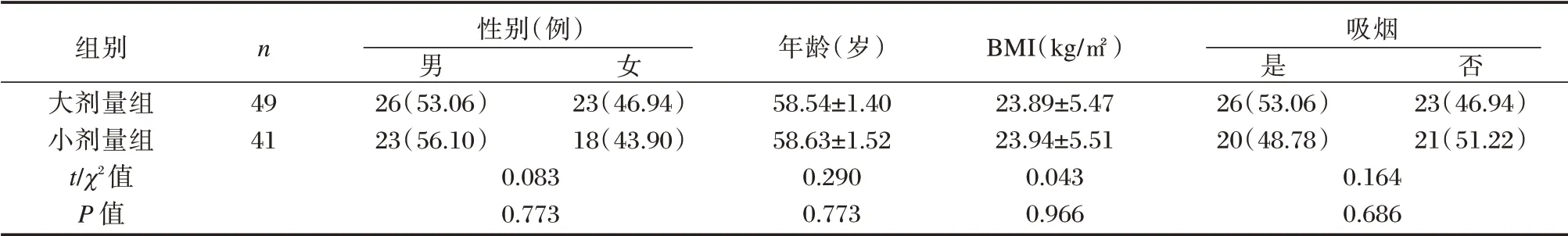
表1 两组一般资料比较[(n(%),(±s)]Table 1 Comparison of general data between 2 groups[(n(%),(±s)]
组别大剂量组小剂量组t/χ2值P 值n 性别(例)男26(53.06)23(56.10)0.083 0.773女否49 41 23(46.94)18(43.90)年龄(岁)58.54±1.40 58.63±1.52 0.290 0.773 BMI(kg/)23.89±5.47 23.94±5.51 0.043 0.966吸烟是26(53.06)20(48.78)0.164 0.686 23(46.94)21(51.22)
1.2 方法
所有研究对象在住院治疗期间均应用拜阿司匹林、低分子肝素、转换酶抑制剂、硝酸酯类及β 受体阻滞剂等常规治疗,同时给予经皮冠状动脉介入治疗。术后,小剂量组给予阿托伐他汀(北京嘉林药业股份有限公司,国药准字H20093819)20 mg/d,大剂量组给予阿托伐他汀40 mg/d,治疗2 w。
1.3 MMP-9、COX-2 及CD40L 检测方法
分别采集所有患者入组次日及治疗7 d 后空腹静脉血3 mL,常温下以3 000 r/min 离心5 min 后分离血清,并将其置于-70℃冰箱中贮存以待检测。采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测MMP-9、COX-2 及CD40L 水平,试剂盒购自美国ADL 公司,所有操作步骤均严格按照试剂盒上说明书进行。
1.4 观察指标
1.4.1 临床疗效
评定标准[8],显效:症状及体征基本消失,各项指标恢复正常;有效:症状和体征部分消失,各项指标明显改善;无效:症状和体征未见好转甚至加重,各项指标均未见改善。总有效率=(显效+有效)/总例数×100%。
1.4.2 血脂和炎性因子
血脂指标包括甘油三酯(Triglyceride,TG)、总胆固醇(cholesterol,CHOL)及低密度脂蛋白胆固醇(Low density lipoprotein cholesterin,LDL-C),于入组次日及治疗7 d 后抽取所有研究对象空腹静脉血,实验室静置30 min 后离心去上清液,然后使用东芝TBA 120 型全自动生化分析仪进行测定。炎性因子包括C 反应蛋白(C-reactive protein,CRP)、白细胞介素6(interleukin-6,IL-6)以及肿瘤坏死因子α(Tumor necrosis factora,TNF-α),于入组次日及治疗7 d 后抽取所有研究对象空腹静脉血,抗凝、离心后取血浆,使用美国Biosource 公司生产的试剂,采用酶联免疫吸附法进行测定。
1.4.3 不良反应
包括胃肠道不适、头痛、头晕、皮疹、关节痛、失眠等。
1.5 统计学方法
采用SPSS 22.0 软件进行统计分析,计量资料采用()表示,行t检验;计数资料采用n(%)表示,行χ2检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 临床疗效
大剂量组有效率高于小剂量组,差异具有统计学意义(P<0.05)。见表2。
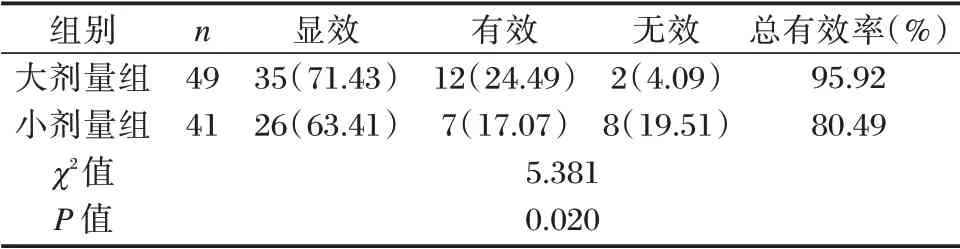
表2 两组临床疗效比较[n(%)]Table 2 Comparison of clinical efficacy between 2 groups[n(%)]
2.2 MMP-9、COX-2 及CD40L
两组治疗前MMP-9、COX-2 及CD40L 水平比较差异无统计学意义(P>0.05)。治疗后大剂量组MMP-9、COX-2 及CD40L 水平均低于小剂量组,差异具有统计学意义(P<0.05)。见表3。
表3 两组治疗前后MMP-9、COX-2 及CD40L 比较(±s)Table 3 Comparison of MMP-9,COX-2 and CD40L between the two groups before and after treatment(±s)
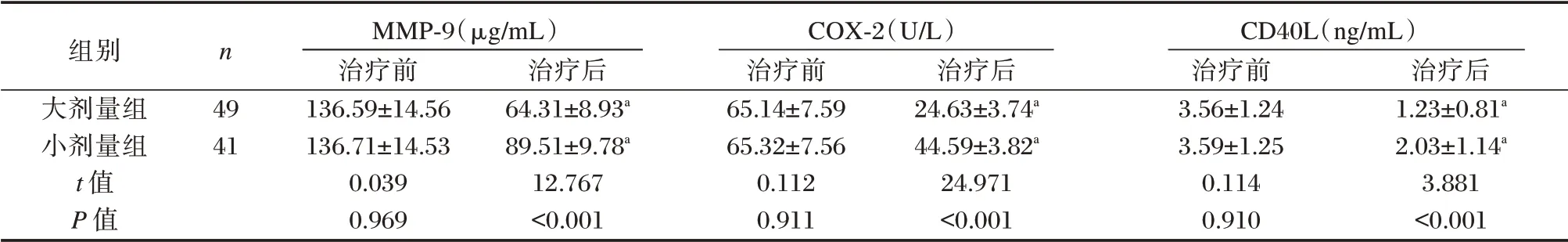
表3 两组治疗前后MMP-9、COX-2 及CD40L 比较(±s)Table 3 Comparison of MMP-9,COX-2 and CD40L between the two groups before and after treatment(±s)
注:与同组治疗前比较,aP<0.05。
组别大剂量组小剂量组t 值P 值n 49 41 MMP-9(μg/mL)治疗前136.59±14.56 136.71±14.53 0.039 0.969治疗后64.31±8.93a 89.51±9.78a 12.767<0.001 COX-2(U/L)治疗前65.14±7.59 65.32±7.56 0.112 0.911治疗后24.63±3.74a 44.59±3.82a 24.971<0.001 CD40L(ng/mL)治疗前3.56±1.24 3.59±1.25 0.114 0.910治疗后1.23±0.81a 2.03±1.14a 3.881<0.001
2.3 血脂水平
治疗前两组TG、CHOL 及LDL-C 水平比较差异无统计学意义(P>0.05)。治疗后大剂量组及小剂量组的TG、CHOL 及LDL-C 均得到改善,且治疗后大剂量组TG、CHOL 及LDL-C 水平均低于对组,差异具有统计学意义(P<0.05)。见表4。
表4 两组治疗前后血脂水平比较(±s)Table 4 Comparison of blood lipid levels between the two groups before and after treatment(±s)
注:与治疗前比,aP<0.05。
组别大剂量组小剂量组t 值P 值n 49 41 TG(mmol/L)治疗前2.41±0.56 2.49±0.53 0.692 0.491治疗后1.16±0.35a 1.87±0.49a 7.997<0.001 CHOL(mmol/L)治疗前5.39±0.63 5.41±0.69 0.144 0.886治疗后3.52±0.46a 4.61±0.42a 11.644<0.001 LDL-C(mmol/L)治疗前3.76±0.35 3.81±0.39 0.641 0.523治疗后2.13±0.15a 2.96±0.24a 19.997<0.001
2.4 炎性因子水平
治疗前2 组间炎症因子水平比较差异无统计学意义(P>0.05)。治疗后大剂量组IL-6、CRP 及TNF-α 水平均低于小剂量组,差异具有统计学意义(P<0.05)。见表5。
表5 两组治疗前后炎性因子水平比较(±s)Table 5 Comparison of inflammatory factor levels between the two groups before and after treatment(±s)

表5 两组治疗前后炎性因子水平比较(±s)Table 5 Comparison of inflammatory factor levels between the two groups before and after treatment(±s)
注:与治疗前比,aP<0.05。
组别大剂量组小剂量组t 值P 值n 49 49 CRP(mg/L)治疗前14.79±3.61 14.85±3.63 0.078 0.938治疗后6.85±1.35a 8.24±1.56a 4.532<0.001 IL-6(ng/L)治疗前17.35±4.15 17.33±4.19 0.023 0.982治疗后9.65±1.36a 11.52±1.45a 6.303<0.001 TNF-α(mg/L)治疗前138.74±44.63 139.12±44.56 0.040 0.968治疗后70.36±21.59a 87.49±22.53a 3.675<0.001
2.5 不良反应
研究组1 例轻度胃肠不适,继续给药并对症处理后得到改善;两组不良反应发生率比较差异无统计学意义(P>0.05)。
3 讨论
心肌梗死的发生与动脉粥样硬化斑块的不稳定性及继发性的血栓密切相关,近年来动脉粥样硬化的炎症学说比较受重视,因此与心肌梗死相关的炎症标志物目前已成为国内外学者的研究热点[9-10]。
基质金属蛋白酶在细胞外基质的合成与降解中占有重要位置,研究发现,MMP-9 能够对粥样硬化斑块内细胞外不同类型的胶原与明胶进行降解[11]。Fabiana 等[12]研究显示,急性心肌梗死患者MMP-9 水平明显升高,认为急性冠状动脉综合征早期炎症活动较显著。CD40L 作为肿瘤坏死因子超基因家族的一种,可刺激巨噬细胞、血管平滑肌细胞、血管内皮细胞产生基质金属蛋白酶及与动脉粥样硬化有关的生物活性物质[13]。COX-2 是环氧化酶存在的同工酶之一,主要存在于单核-巨噬细胞、滑膜细胞及内皮细胞中[14]。正常生理状态下,COX-2 仅微量表达,当细胞受到细菌内毒素、致炎因子的活化作用时,其才开始大量表达。因此,有学者认为COX-2 活化与急性冠脉综合征(Acute coronary syndrome,ACS)炎症反应关系密切,不仅参与动脉粥样硬化的形成,而且可能在其发生、发展和转归过程中均具有重要的影响[15]。
他汀类药物是目前最有效的降脂药物。本研究结果显示,治疗后大剂量组及小剂量组的TG、CHOL 及LDL-C 均得到改善。主要原因为阿托伐他汀可通过抑制肝细胞合成胆固醇的限速酶羟甲基戊二酰辅酶A 还原酶的活性,使CHOL 合成受阻,降低血浆中CHOL 浓度;并通过负反馈调节使肝细胞表面LDL-C 受体数量增加、活性增强,从而能与更多LDL-C 结合,并将其转运至外周组织,以此降低血浆中LDL-C 浓度[16]。此外,他汀类药物除具有降脂作用外,还具有直接的抗炎作用[17]。本研究中,经治疗后所有患者炎性因子水平均显著降低,这主要与阿托伐他汀可通过抑制树突状细胞成熟,在动脉粥样硬化病变中发挥作用,以及增加患者免疫调节细胞,导致白细胞介素-10、转化生长因子β 分泌增加,进而抑制免疫炎症有关。临床实践证实,采用他汀类药物进行强化治疗,可有效减少急性缺血心肌再灌注后无复流面积,改善患者预后[18]。本研究结果中,治疗后大剂量组MMP-9、COX-2、CD40L 及血脂指标、炎性因子水平均低于小剂量组,且大剂量组临床疗效高于小剂量组,表明阿托伐他汀40 mg/d 在调节血脂、改善炎症反应的作用优于阿托伐他汀20 mg/d,这与大剂量应用阿托伐他汀后可快速降低MMP-9、COX-2、CD40L 活性,提高易损斑块稳定性有关。此外,大剂量阿托伐他汀使用并未增加患者不良反应,由此提示,在患者可耐受基础上,大剂量阿托伐他汀可能为急性心肌梗死临床治疗的更好选择。
综上所述,经阿托伐他汀40 mg/d 治疗的心肌梗死患者MMP-9、COX-2 及CD40L 水平显著降低,且血脂水平及炎症反应得到较大改善,具有一定安全性,对于可耐受的急性心肌梗死患者在阿托伐他汀治疗上大剂量可能为较好的选择。

