豇豆中噁唑酰草胺及其代谢物残留量的超高效液相色谱-串联质谱法测定
邵辉 李娜 李辉 刘磊 林宏芳 杨丽静 闫琳 程禹 刘春艳 张玉婷 郭永泽

摘 要:本研究建立了豇豆中噁唑酰草胺及其代谢物HPFMPA、HFMPA、6-CBO残留量的超高效液相色谱-串联质谱(UPLC-MS/MS)测定方法。采用乙腈提取,PSA净化,UPLC-MS/MS在多反应离子监测模式(MRM)下测定,外标-标准曲线法定量方法。结果表明,豇豆中添加噁唑酰草胺、HPFMPA、HFMPA、6-CBO浓度水平为0.005 ~1.000 mg·kg-1,平均回收率在75%~97%,相对标准偏差在5%~13%,定量限在0.005~0.010 mg·kg-1。方法可同时测定噁唑酰草胺及其代谢物,准确度高,灵敏度好,特异性强,前处理操作简单,适用于豇豆中噁唑酰草胺及其代谢物残留量测定。
关键词:豇豆;噁唑酰草胺;代谢物;超高效液相色谱-串联质谱法;测定
中图分类号:S643.4; O657.63 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2021.05.016
Abstract: An accurate UPLC-MS/MS method for the determination of metamifop and its metabolites HPFMPA,HFMPA,6-CBO in cowpea was developed. Cowpea samples were extracted with acetonitrile, cleaned up by PSA ,and finally determinated by UPLC-MS/MS under multiple reaction monitoring (MRM) mode. The results showed that the concentration levels of metamifop, HPFMPA, HFMPA and 6-CBO added to cowpea were 0.005-1.000 mg·kg-1, the average recoveries of metamifop and its metabolites were between 75% and 97% with the RSDs between 5% and 13%, the limits of quantitation were between 0.005 mg·kg-1 and 0.010 mg·kg-1. The method is qualitative, quantitative, sensitive, specific, simple, suitable for determination of metamifop and its metabolites in cowpea.
Key words: cowpea; metamifop; metabolites; UPLC-MS/MS; determination
噁唑酰草胺,英文名称为metamifop,化学名称为(R)-2-{ (4-氯-1,3-苯并噁唑-2-基氧)苯氧基}-2′-氟-N-甲基丙酰替苯胺,是由韓国化工技术研究院开发的芳氧苯氧丙酸酯类除草剂,属ACC酶抑制剂,能抑制植物脂肪酸的合成,主要用于移栽和直播稻田防除一年生禾本科杂草,有广泛的可混性,并有望用于其他作物,是一个很有发展前景的除草剂[1-3]。噁唑酰草胺在田间施用以后,会降解为有毒理学意义的代谢物N-(2-氟苯基)-2-(4-羟基苯氧基)-N-甲基丙酰胺(HPFMPA)、N-(2-氟苯基)-2-羟基-N-甲基丙酰胺(HFMPA)以及6-氯-2-苯噁唑啉酮(6-CBO)。目前国内外对于噁唑酰草胺及其代谢物残留量的测定方法研究已有报道,如大米中噁唑酰草胺及其代谢物残留量的高效液相色谱测定法(HPLC)[4-6],水和粮谷中噁唑酰草胺残留量的液相色谱-串联质谱测定法(LC/MS/MS)[7-9],大米和水中噁唑酰草胺残留量的液相色谱测定法[10-14],如水稻、水和土中噁唑酰草胺及其代谢物残留量的液相色谱-串联质谱法[15-16]等。但是,尚未有豇豆中噁唑酰草胺及其代谢物残留量的超高效液相色谱-串联质谱(UPLC-MS/MS)测定法报道。
基于此,本研究建立了这一方法,为测定豇豆中噁唑酰草胺及其代谢物残留量和噁唑酰草胺在豇豆上登记使用提供技术参考。
1 材料和方法
1.1 试验材料
1.1.1 仪器设备 Acquity UPLC/Xevo TQS micro超高效液相色谱-串联质谱仪(美国Waters公司)、T50匀浆机(德国IKA公司)、0.01 g电子天平(天津天马衡基仪器有限公司)、CK2000垂直振荡器(托摩根生物科技有限公司)、3-18KS高速离心机(德国Sigma公司)、QL-901涡旋振荡器(江苏海门其林贝尔仪器制造有限公司)、Milli-Q纯水仪(美国Millipore公司)、100 μL移液枪(德国eppendorf公司)。
1.1.2 试剂 乙腈(分析纯,天津市康科德科技有限公司)、盐酸(分析纯,天津市风船化学试剂科技有限公司)、氯化钠(分析纯,天津市风船化学试剂科技有限公司)、乙腈(色谱纯,德国默克公司)、甲酸(色谱纯,德国默克公司)、超纯水(Milli-Q纯水仪制备)、PSA(颗粒直径为60 μm,上海安谱实验科技股份有限公司)。
噁唑酰草胺(100 mg·L-1,天津阿尔塔科技有限公司)、噁唑酰草胺代谢物HPFMPA(99.1%,杭州宇昊化工科技有限公司)、噁唑酰草胺代谢物HFMPA(98.9%,国家农药质量监督检验测试中心(沈阳))、噁唑酰草胺代谢物6-CBO(99.5%,美国Dr.Ehrenstorfer GmbH公司)。
1.2 测定方法
1.2.1 样品前处理 称取5.00 g样品(精确至0.01 g)于50 mL离心管中,加入5 mL 1 mol·L-1盐酸,摇匀,再加25 mL乙腈、3.00 g氯化钠,垂直振荡5 min,4 000 r·min-1离心5 min。取上清液1.5 mL,加入25 mg PSA,涡旋振荡1 min,4 000 r·min-1离心5 min,取上清液,过0.22 μm滤膜于进样小瓶中,待测。
1.2.2 仪器条件 色谱柱:Acquity UPLC BEH C18柱 (50×2.1 mm,1.8 μm);流动相:A为乙腈,B为0.1%甲酸水溶液,体积比:A/B=85/15,等度洗脱;流速:0.3 mL·min-1;洗脱时间:3 min;柱温:33 ℃;进样量:5 μL。
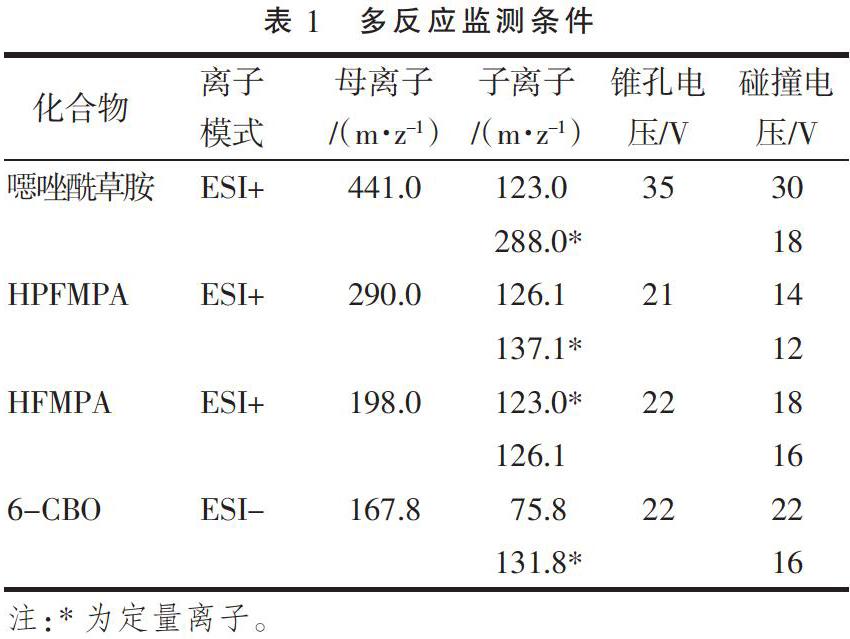
离子源:电子喷雾离子源;毛细管电压:3.0 KV;脱溶剂温度:450 ℃;离子源温度:150 ℃;锥孔气流速:900 L·h-1;脱溶剂气流速:50 L·h-1。扫描方式:多反应监测(MRM),条件见表1。
1.2.3 定性 在相同仪器条件下进行样品测定,如果检出的色谱峰的保留时间与标准样品相同,并且在扣除背景后的样品质谱图中,目标化合物选择的离子均出现,而且同一检测批次,对同一化合物,样品中目标化合物的离子丰度比与质量浓度相当的基质标准溶液相比一致,则可判断样品中存在目标农药。
1.2.4 定量 外标-基质匹配标准曲线法定量残留量计算公式如下:
式中,R为样品中农药残留量(mg·kg-1);C为根据标准曲线计算的检测样品中的农药残留浓度(mg·L-1);V为定容体积(mL);W为代表检测样品的样品质量(g)。
残留量之和计算公式如下:
R噁唑酰草胺残留量之和=R噁唑酰草胺 + RHPFMPA ×440.9/289.3+ RHFMPA ×440.9/197.2+ R6-CBO×440.9/169.6(2)
式中,R噁唑酰草胺残留量之和为噁唑酰草胺残留量之和(mg·kg-1);R噁唑酰草胺为噁唑酰草胺残留量(mg·kg-1);RHPFMPA为HPFMPA残留量(mg·kg-1);RHFMPA-HFMPA残留量(mg·kg-1);R6-CBO-6-CBO残留量(mg·kg-1)。
2 结果与分析
2.1 质谱条件的确定
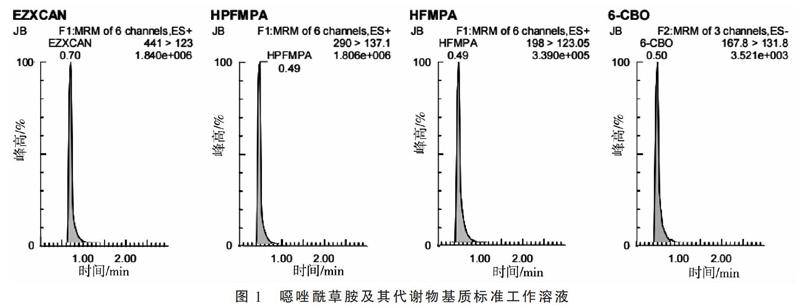
配制噁唑酰草胺及其代谢物溶剂标准工作溶液,根据其理化性质,在合适的离子模式(正离子模式或负离子模式)下对进行母离子扫描,结合其分子量,确定母离子大小,然后对锥孔电压进行优化,确定母离子响应最大时的锥孔电压。接下来对母离子施加碰撞电压进行子离子扫描,找到响应较大且稳定的2个作为定性子离子,再分别对两个子离子进行碰撞电压的优化,找到子离子响应最大时的碰撞电压,最后选择响应较高的子离子作为定量子离子,使仪器灵敏度达到最佳。同样的方法,得到噁唑酰草胺、HPFMPA、HFMPA、6-CBO的母离子、锥孔电压、子离子、碰撞电压,见表1,基质标准工作溶液谱图(图1)。
2.2 前处理方法的确定
本研究采用乙腈提取,乙腈可有效提取大多数样品中大多数农药及其代謝物残留,且提取出来的影响定性定量的脂类物质较少,更为重要的是,通过加入氯化钠,乙腈相可与水相分层,达到去除水溶性杂质的目的。再加入PSA作为净化吸附剂,可有效去除样品中影响农残测定的色素、酸类、糖类等物质,降低了基质对信号响应的抑制,净化效果良好,提高了方法灵敏度,保护液相色谱-串联质谱仪免受污染和堵塞,可延长仪器寿命并提高稳定性,而且噁唑酰草胺及其代谢物的回收率均可以达到要求。
2.3 标准曲线线性关系分析
用豇豆基质空白溶液稀释,配制噁唑酰草胺/HPFMPA/HFMPA/6-CBO混合标准工作溶液系列浓度0.001/0.0005/0.001/0.001 mg·L-1,0.002/0.001/0.002/0.002 mg·L-1,0.01/0.01/0.01/0.01 mg·L-1,0.05/0.05/0.05/0.05 mg·L-1,0.2/0.2/0.2/0.2 mg·L-1。在上述液相色谱-串联质谱条件下进样,以化合物浓度为横坐标,以对应的峰面积为纵坐标作标准曲线,得噁唑酰草胺线性方程为y=1 431 219.2x-181.5,r = 0.999 7;HPFMPA线性方程为y=1 329 521.9x+ 306.1,r=0.999 9;HFMPA线性方程为y=344 752.0x -167.7,r=0.999 7;6-CBO线性方程为y=103 942.3x-107.0,r=0.999 8。线性关系均良好,标准曲线见图2。
2.4 方法的特异性
本方法采用多反应监测(MRM)扫描模式,先对母离子进行扫描,再对母离子产生的子离子进行扫描,而且选择两对母离子-子离子反应扫描来定性定量,保证了基本只对目标化合物有响应,对杂质有良好的区分能力,可有效地排除假阳性结果。
2.5 方法的灵敏度
方法的灵敏度以定量限(LOQ)表示。根据实测,本方法噁唑酰草胺、HPFMPA、HFMPA、6-CBO的定量限分别为0.01,0.005,0.01,0.01 mg·kg-1,国内外均未制定噁唑酰草胺在豇豆中的最大残留限量(MRL)值,定量限足以达到农药残留量测定的要求。
2.6 方法的准确度和精密度
添加噁唑酰草胺0.01,0.05,1.00 mg·kg-1,平均回收率分别为75%,84%,77%,相对标准偏差分别为6%,8%,5%。添加HPFMPA 0.005,0.050,1.000 mg·kg-1,平均回收率分别为90%,83%,91%,相对标准偏差分别为12%,12%,10%。添加HFMPA 0.01,
0.05,1.00 mg·kg-1,平均回收率分别为90%,90%,82%,相对标准偏差分别为13%,7%,12%。添加6-CBO 0.01,0.05,1.00 mg·kg-1,平均回收率分别为84%,97%,85%,相对标准偏差分别为7%,13%,8%。平均回收率和相对标准偏差均满足农药残留量测定的要求,具体见表2。
3 结 论
不同类型的样品所含成分不同,样品中成分可影响待测物的提取效率和仪器响应,在一类样品上建立了检测方法,在其他类样品上不一定适用,因此还需要验证、改进才能使用。已有文献报道的液相色谱-串联质谱仪测定噁唑酰草胺及其代谢物残留量的方法,涉及到的样品有水、土壤、糙米、稻壳、秸秆。豇豆含水量高、叶绿素含量高、极性杂质较多,和前人研究过的样品大有不同,本研究采用乙腈提取、PSA净化、超高效液相色谱-串联质谱仪测定、外标法定量,建立了豇豆中噁唑酰草胺及其代謝物残留量的超高效液相色谱-串联质谱仪测定方法,拓宽了样品检测类型范围。方法可同时测定噁唑酰草胺及其代谢物,准确度高,灵敏度好,特异性强,在实际样品测定中准确高效,可为豇豆中噁唑酰草胺及其代谢物残留量测定提供技术支撑。
参考文献:
[1] 马国兰, 刘都才, 刘雪源, 等. 五氟磺草胺等6种除草剂对直播稻田高龄稗草的生物活性及田间控制效果[J]. 植物保护, 2014, 40(3): 204-208, 214.
[2] 黄谊. 噁唑酰草胺10%EC防除直播稻田禾本科杂草研究[J]. 农业灾害研究, 2015, 5(1): 11-13, 41.
[3] LEICHTER C A, THOMPSON N, JOHNSON B R, et al. The high potency of ME-5343 to aphids is due to a unique mechanism of action[J]. Pesticide Biochemistry and Physiology, 2013, 107(2): 169-176.
[4] 罗婧, 施海燕, 彭文涛, 等. 噁唑酰草胺及其代谢物的残留分析方法[J]. 江苏农业学报, 2010, 26(1): 187-191.
[5] 孔德洋, 石利利, 单正军, 等. 恶唑酰草胺及其代谢物残留的加速溶剂萃取-凝胶渗透色谱净化-液相色谱测定[J]. 环境化学, 2010, 29(4): 734-738.
[6] 王点点, 陈源, 宋宁慧, 等. 10%噁唑酰草胺可湿性粉剂在稻田环境中的残留动态[J]. 农药, 2012, 51(11): 818-821.
[7] 刘雁雨, 魏京华, 张燕, 等. 超高效液相色谱—串联质谱法同时检测水中五氟磺草胺和噁唑酰草胺[J]. 农药科学与管理, 2018, 39(5): 51-55.
[8] 唐俗, 袁定帅, 孙林, 等. 液相色谱-串联质谱法测定粮谷中的噁唑酰草胺[J]. 食品工业, 2019, 40(3): 319-321.
[9] 张月. 超高效液相色谱-串联质谱法测定水稻中噁唑酰草胺残留量[J]. 中国农学通报, 2020, 36(9): 127-131.
[10] 孔德洋, 石利利, 单正军, 等. 噁唑酰草胺在稻田中的残留及消解动态[J]. 生态与农村环境学报, 2011, 27(5): 104-107.
[11] 罗婧, 彭文涛, 金雅慧, 等. 噁唑酰草胺的高效液相色谱分析[J]. 农药, 2009, 48(3): 191-192.
[12] 王雪, 侯志广, 郭刚, 等. 噁唑酰草胺的光解动力学研究[J]. 中国农学通报, 2014, 30(1): 312-315.
[13] 杨丽莉, 王雪, 崔强, 等. 300W高压汞灯下恶唑酰草胺在不同表面活性剂水溶液中的光解动态[J]. 吉林农业, 2015(23): 66-66.
[14] 王雪, 杨丽莉, 崔强, 等. 不同表面活性剂溶液下恶唑酰草胺的水解动态[J]. 吉林农业, 2015(23): 69.
[15] 陈国峰, 尤红梅, 滕瑶, 等. UPLC-MS/MS法测定水稻中噁唑酰草胺和氰氟草酯及其代谢物的残留及膳食风险评估[J]. 中国稻米, 2021, 27(2): 57-62.
[16] 豆叶枝, 李菊颖, 何健, 等. 分散固相萃取-液相色谱质谱法测定水稻和多环境介质中的噁唑酰草胺及其代谢产物[J]. 环境化学, 2020, 39(10): 2693-2701.

