lncRNA HOXA⁃AS2在胰腺癌组织中的表达及对细胞增殖和侵袭力的影响
陈升阳 陈艳军 胡水全 程冰冰 仝昊 周百中 李晓勇
郑州大学第五附属医院(郑州450052)
胰腺癌作为消化系统恶性程度极高的肿瘤类型,发病率呈逐年升高的趋势[1],临床上目前治疗该肿瘤主要以手术切除为主,但由于患者发病隐匿,早期尚无有效的诊断手段,多数患者确诊时已出现浸润或转移,手术根除困难,病死率高,预后差[2]。因此,深入研究胰腺癌发生机制,寻找与其发病和转移相关靶基因,对其早期诊疗及改善预后具有重要意义。长链非编码RNA(long non⁃coding RNA,lncRNA)作为一种广泛存在于机体细胞内的长度在200 nt 以上的RNA 分子,虽本身不具备编码蛋白功能,但可通过调控表观遗传基因、转录或转录后翻译等而参与诸多生物学功能[3],越来越多的研究发现,其在肿瘤组织中出现表达异常[4-5],参与了肿瘤细胞增殖、侵袭和转移[6]。HOXA 簇反义RNA 2(HOXA cluster antisense RNA 2,HOXA⁃AS2)作为一种与癌症相关的lncRNA,已发现其在多种恶性肿瘤中异常表达[7],且与肿瘤恶性进展有关[8]。本研究通过分析胰腺癌组织中HOXA⁃AS2 表达,探讨其与临床指标的相关性,并利用小干扰RNA(small interfering RNA,siRNA)技术沉默该基因在人胰腺癌PANC⁃1 和AsPC⁃1 细胞中表达,观察其对细胞增殖、迁移和侵袭的影响,以期为胰腺癌机制研究提供参考资料。
1 资料与方法
1.1 资料
1.1.1 临床资料选取2015年8月至2020年8月在我院行根治性手术治疗的胰腺癌患者,纳入标准:(1)术前未接受任何治疗;(2)术后病理示胰腺导管癌;(3)临床病历资料完整。排除标准:(1)心肝肾等脏器严重功能障碍者;(2)合并有其他系统恶性肿瘤者;(3)患有免疫系统疾病或在使用免疫抑制剂治疗者。共入选97例,其中,男58例,女39例;年龄41~76 岁,平均(60.62±10.13)岁,肿瘤部位:胰头55 例,胰体尾42 例;根据第七版TNM 分期标准:Ⅰ-Ⅱ期53 例,Ⅲ-Ⅳ期44 例;分化程度:高分化43 例,中低分化54 例;发生淋巴结转移46 例。留取胰腺癌和癌旁组织(距离肿瘤组织边缘在2 cm 以上)组织,迅速置于液氮中,-70 ℃保存。本研究通过医院伦理委员会批准,所有患者均签署知情同意书。
1.1.2 主要试剂和设备PANC⁃1 和AsPC⁃1 细胞购自上海通派生物科技有限公司,RPMI⁃1640 培养液、胎牛血清和胰蛋白酶购自美国Hyclone 公司,总RNA 提取试剂(Trizol 法)和Lipofectamine 2000转染试剂购自美国Invitrogen 公司,逆转录和PCR试剂盒购自日本TaKaRa 公司,HOXA⁃AS2 和内参引物由上海生工生物工程公司设计合成,HOXA⁃AS2 干扰序列和阴性对照序列由上海捷兰生物技术有限公司设计合成,CCK⁃8 试剂购自北京鼎盛伟业生物科技有限公司,Transwell 小室购自美国Corning 公司,基质胶购自美国BD 公司,CFX96 实时荧光定量PCR 仪购自美国Bio⁃Rad 公司。
1.2 方法
1.2.1 RT⁃PCR 检测胰腺癌和癌旁组织中HOXA⁃AS2 表达将胰腺癌和癌旁组织取出,剪碎,研磨,加入细胞裂解液,使用总RNA 提取试剂(Trizol法)提取总RNA,利用紫外分光光度计检测其纯度和浓度。按逆转录试剂盒说明对总RNA 逆转录获得cDNA,并按照PCR 试剂盒试剂盒说明使用实时荧光定量PCR 仪对目的基因扩增。序列:HOXA⁃AS2:上游:5′⁃CTGTCTGCGAAGGCCTAAAG⁃3′,下游:5′⁃CTAGGTAAGCGCTGCTCCAA⁃3′;GAPDH:上游:5′⁃GAAGAGAGAGACCCTCACGCTG⁃3′下游:5′⁃ACTGTGAGGAGGGGAGATTCAGT⁃3′。反应条件:95 ℃2 min,94 ℃30 s,59 ℃20 s,70 ℃40 s,38次循环。使用2-△△Ct法计算组织中HOXA⁃AS2表达量。
1.2.2 细胞培养和处理将PANC⁃1 和AsPC⁃1 细胞用含10%胎牛血清的RPMI⁃1640 培养液培养,条件:5%CO2、37 ℃,培养液每隔24 h 更换1 次,待细胞融合度在80%以上时,胰酶消化,传代培养。将对数生长的细胞分为三组:(1)干扰序列(si⁃HOXA⁃AS2)组:按照Lipofectamine 2000 转染试剂说明转染siRNA 序 列5′⁃CAAGCUUGACAAGUUCAGCU⁃CAA⁃3′:(2)阴性对照(si⁃Con)组:按照Lipofectamine 2000 转染试剂说明转染对照序列5′⁃GAUUCCCC⁃GGACUUCUCACAG⁃3′;(3)空白组:不作任何处理。处理后继续培养48 h。
1.2.3 RT⁃PCR 检测细胞中HOXA⁃AS2 表达取各组培养48 h 的细胞,用细胞裂解液裂解后,其他操作步骤同1.2.1。
1.2.4 CCK⁃8 检测细胞增殖活性将各组细胞消化后,制备成2.5×104/mL 细胞悬液,分别取200 μL接种在96 孔板,每个样本设复孔5 个,分别在培养12、24、48、72 和96 h 时,将CCK⁃8 液10 μL 加入各孔,培养120 min,使用酶标仪在450 nm 波长处检测各孔吸光度(OD)值。
1.2.5 Transwell 法检测细胞侵袭力用培养液对基质胶进行稀释后平铺在Transwell 小室上室,过夜风干。取各组培养48 h 的细胞,消化、用无血清培养液制备成密度为2.5×105/mL的悬液,取200 μL 接种于小室上室,下室则加入含20%胎牛血清培养液600 μL,培养24 h,取出小室,PBS 冲洗3 次,甲醛固定,去除边缘散落的细胞,0.1%结晶紫染色,倒置显微镜观察,计数穿膜细胞数。重复实验3 次。
1.3 统计学方法使用SPSS 21.0 软件分析,计量资料采用均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05 差异有统计学意义。
2 结果
2.1 胰腺癌和癌旁组织中HOXA⁃AS2表达HOXA⁃AS2 在胰腺癌组织中表达量为(2.21 ± 0.20),高于癌旁组织的(1.03 ± 0.14),差异有统计学意义(t=48.030,P<0.001)。
2.2 胰腺癌组织中HOXA⁃AS2 表达与临床指标的相关性胰腺癌组织中HOXA⁃AS2 表达量与年龄、性别和肿瘤大小无关(P>0.05),而在不同TNM分期、分化程度和是否发生淋巴结转移差异有统计学意义(P<0.05),见表1。
2.3 细胞中HOXA⁃AS2 表达PANC⁃1 细胞中,与si⁃Con 组和空白组比较,si⁃HOXA⁃AS2 组HOXA⁃AS2表达量明显降低,差异有统计学意义(P<0.05),同样,AsPC⁃1 细胞中si⁃HOXA⁃AS2 组HOXA⁃AS2表达量比si⁃Con 组和空白组显著降低,差异有统计学意义(P<0.05),见表2。
2.4 细胞增殖活性PANC⁃1 和AsPC⁃1 细胞中,si⁃HOXA⁃AS2 组24、48、72 和96 h 时吸光度OD值均低于si⁃Con 组和空白组,差异有统计学意义(P<0.05),见表3、4。
2.5 细胞侵袭力PANC⁃1 和AsPC⁃1 细胞中,si⁃HOXA⁃AS2组侵袭细胞数均低于si⁃Con 组和空白组,差异有统计学意义(P<0.05),见表5 和图1、2。
3 讨论
胰腺癌作为恶性程度高、病死率高的消化道肿瘤,早期症状不典型,且病情进展快,易发生淋巴结和远处转移[9],尽管现有的治疗手段不断进步,但患者总体预后改善有限,5年生存率较低[10]。研究表明[11],高侵袭转移性是影响胰腺癌患者预后的独立风险因素。因此,进一步明确与胰腺癌侵袭转移相关分子机制,寻找敏感基因对指导患者早期诊疗具有重要意义。lncRNA 作为近年来研究热点,已发现其参与了恶性肿瘤发生进展过程[12],且与肿瘤侵袭转移关系密切[13]。有研究指出[14],lncRNA 对胰腺癌发生发展及预后影响显著,有望为胰腺癌的靶向治疗及预后评估提供新的治疗靶点和分子标志物。HOXA⁃AS2作为一种lncRNA,定位于人染色体7p15.2,属于HOXA 簇成员,与急性髓系白血病发病关系密切[15],在细胞增殖过程发挥重要作用[16],参与了非小细胞肺癌恶性进展[17],且参与了骨肉瘤细胞迁移及侵袭过程[18]。本研究结果显示,HOXA⁃AS2 在胰腺癌组织中表达量高于癌旁组织,说明胰腺癌组织中HOXA⁃AS2 呈高表达,可能与胰腺癌发生相关。TNM 分期Ⅲ-Ⅳ期、中低分化和发生淋巴结转移胰腺癌患者组织中HOXA⁃AS2 表达量明显升高,说明HOXA⁃AS2 表达量与胰腺癌恶性程度有关,可能是判定患者恶性程度的潜在生物学标志物。
表1 不同临床指标胰腺癌组织中HOXA⁃AS2 表达量比较Tab.1 Comparison on the expression of HOXA⁃AS2 in pancreatic cancer tissues with different clinical indexes±s

表1 不同临床指标胰腺癌组织中HOXA⁃AS2 表达量比较Tab.1 Comparison on the expression of HOXA⁃AS2 in pancreatic cancer tissues with different clinical indexes±s
指标年龄≥61 岁<61 岁性别男性女性肿瘤部位胰头胰体尾肿瘤大小≥2 cm<2 cm TNM 分期Ⅰ-Ⅱ期Ⅲ-Ⅳ期分化程度高分化中低分化淋巴结转移是 否例数57 40 58 39 55 42 41 56 53 44 43 54 46 51 HOXA⁃AS2 表达量2.23±0.20 2.17±0.19 2.19±0.21 2.22±0.19 2.18±0.19 2.24±0.21 2.22±0.19 2.19±0.20 2.15±0.18 2.27±0.20 2.12±0.17 2.27±0.19 2.28±0.21 2.14±0.17 t 值1.487 0.775 1.443 0.684 2.941 3.855 3.628 P 值0.140 0.440 0.152 0.496 0.004<0.001<0.001

表2 不同组PANC⁃1 和AsPC⁃1 细胞中HOXA⁃AS2 表达量比较Tab.2 Comparison on the expression levels of HOXA⁃AS2 in PANC⁃1 and AsPC⁃1 cells in different groups x±s
表3 不同组PANC⁃1 细胞不同时点增殖活性Tab.3 The proliferation activities of PANC⁃1 cells in different groups at different time points ±s

表3 不同组PANC⁃1 细胞不同时点增殖活性Tab.3 The proliferation activities of PANC⁃1 cells in different groups at different time points ±s
注:与空白组比较,*P <0.05;与si⁃Con 组比较,#P <0.05
组别si⁃HOXA⁃AS2 组si⁃Con 组空白组F 值P 值12 h 0.52±0.04 0.48±0.06 0.47±0.06 1.199 0.329 24 h 0.81±0.12*#0.96±0.09 0.94±0.10 3.874 0.044 48 h 1.20±0.03*#1.37±0.12 1.42±0.07 12.620 0.001 72 h 1.33±0.10*#1.68±0.07 1.64±0.06 33.661<0.001 96 h 1.65±0.11*#1.91±0.07 1.98±0.09 21.403<0.001
表4 不同组AsPC⁃1 细胞不同时点增殖活性Tab.4 The proliferation activities of AsPC⁃1 cells in different groups at different time points ±s

表4 不同组AsPC⁃1 细胞不同时点增殖活性Tab.4 The proliferation activities of AsPC⁃1 cells in different groups at different time points ±s
注:与空白组比较,*P <0.05;与si⁃Con 组比较,#P <0.05
组别si⁃HOXA⁃AS2 组si⁃Con 组空白组F 值P 值12 h 0.37±0.07 0.39±0.08 0.43±0.07 0.864 0.441 24 h 0.62±0.09*#0.81±0.03 0.78±0.08 11.880 0.001 48 h 0.81±0.12*#0.95±0.05 0.97±0.06 6.795 0.008 72 h 1.02±0.10*#1.27±0.16 1.32±0.09 10.768 0.001 96 h 1.25±0.04*#1.61±0.09 1.66±0.13 31.626<0.001
表5 不同组PANC⁃1 和AsPC⁃1 细胞侵袭力比较Tab.5 Comparison on the invasion abilities of PANC⁃1 and AsPC⁃1 cells in different groups ±s
表5 不同组PANC⁃1 和AsPC⁃1 细胞侵袭力比较Tab.5 Comparison on the invasion abilities of PANC⁃1 and AsPC⁃1 cells in different groups ±s
注:与空白组比较,*P <0.05;与si⁃Con 组比较,#P <0.05
组别si⁃HOXA⁃AS2 组si⁃Con 组空白组F 值P 值PANC⁃1 细胞97.83±9.11*#118.50±10.52 123.83±7.03 13.968<0.001 AsPC⁃1 细胞88.00±5.22*#111.67±5.68 113.17±7.47 31.130<0.001
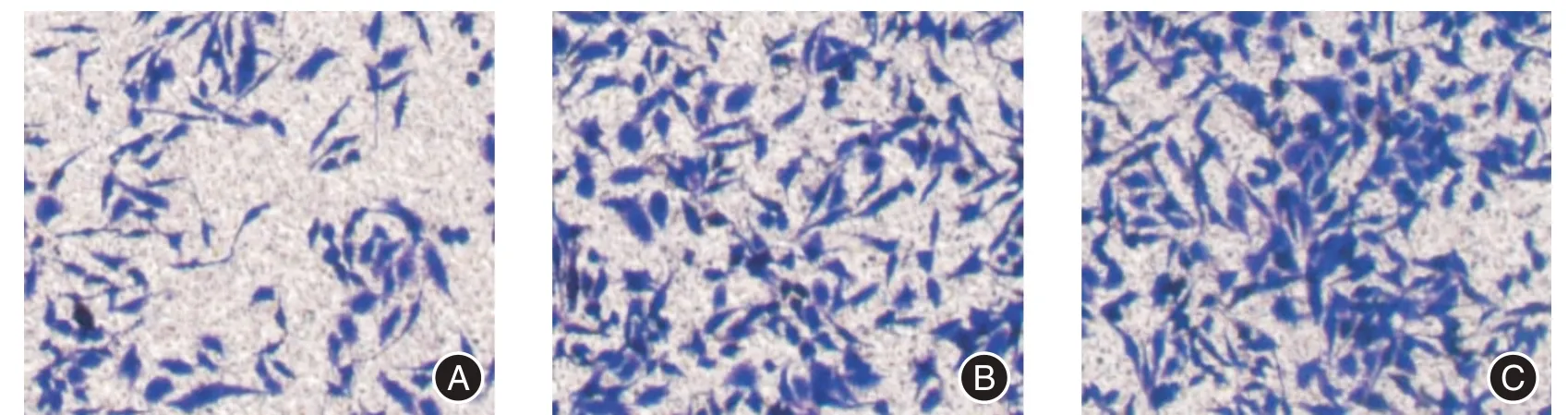
图1 不同组PANC⁃1 细胞侵袭情况(结晶紫染色,×200)Fig.1 Invasion of PANC⁃1 cells in different groups(crystal violet staining,×200)

图2 不同组AsPC⁃1 细胞侵袭情况Fig.2 Invasion of AsPC⁃1 cells in different groups(crystal violet staining,×200)
有研究[19]指出,HOXA⁃AS2 通过调控miR⁃520c⁃3p/GPC3 轴促进肝癌细胞增殖。WANG 等[20]则指出,HOXA⁃AS2 通过调节miR⁃125b/Smad2 轴促进膀胱癌的迁移和侵袭。本研究利用siRNA 技术特异性沉默PANC⁃1 和AsPC⁃1 细胞中HOXA⁃AS2 表达,结果显示,两种细胞中si⁃HOXA⁃AS2 组中HOXA⁃AS2 表达量明显降低,说明细胞中HOXA⁃AS2 表达被成功抑制。本研究结果显示,PANC⁃1 和AsPC⁃1细胞中,si⁃HOXA⁃AS2 组24、48、72 和96 h 时吸光度OD 值均低于si⁃Con 组和空白组,说明沉默细胞中HOXA⁃AS2 表达细胞增殖活性被明显抑制,提示HOXA⁃AS2 可能参与了胰腺癌细胞增殖过程。本研究结果显示,PANC⁃1 和AsPC⁃1 细胞中,si⁃HOXA⁃AS2 组侵袭细胞数均低于si⁃Con 组和空白组,说明沉默细胞中HOXA⁃AS2 表达细胞侵袭能力被抑制,HOXA⁃AS2 可能参与了胰腺癌细胞侵袭过程。
综上所述,HOXA⁃AS2 在胰腺癌组织中表达量升高,且与恶性进展临床指标相关,沉默其表达可减少细胞增殖、抑制细胞侵袭力,但具体机制有待进一步研究明确。

