沉默ERK5对乳腺癌耐阿霉素细胞MCF-7/ADM耐药性的逆转作用及机制*
张瀚文, 张江涛, 庞 森, 陈 俊, 徐钰驹, 吴向华△
1广西医科大学第一附属医院胃肠腺体外科,南宁 530021 2山东菏泽市立医院胃肠外科,菏泽 274000 3广州市番禺区中心医院乳腺甲状腺外科,广州 511400 4广西壮族自治区人民医院移植科,南宁 530021
乳腺癌是女性最常见的恶性肿瘤,术后化疗及新辅助化疗是治疗乳腺癌的重要手段[1]。但乳腺肿瘤耐药现象在临床治疗中有着相当高的比例,易导致肿瘤的复发与转移,严重影响了患者的预后[2]。因此,寻找调控乳腺癌耐药性靶基因具有重要意义。
细胞外信号调节激酶5(extracellular signal regulated kinase 5,ERK5)是丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)信号转导通路家族成员之一[3]。近年来,相关研究表明ERK5在恶性肿瘤中表达活跃且与肿瘤的生长侵袭有关[4]。其中,Clape等[5]研究发现在前列腺癌中ERK5可作为microRNA-143的靶基因介导肿瘤发生。Montero等[6]研究发现,ERK5在早期乳腺癌的发展过程中处于高表达水平,并可作为独立预后指标。此外,Miranda等[7]研究认为MEK5/ERK5通路过表达与乳腺癌全身化疗患者存活率差相关。我们先前的研究也显示:复发转移的乳腺癌中ERK/MAPK通路明显激活[8]。上述研究提示ERK5可能参与乳腺癌化疗耐药,但目前鲜有ERK5与乳腺癌耐药相关性的研究报道。本研究首先检测乳腺癌耐药细胞与正常乳腺细胞及乳腺癌非耐药细胞中ERK5表达水平差异,后应用RNA干扰技术沉默ERK5在乳腺癌耐药细胞MCF-7/ADM中的表达,重点探讨ERK5对乳腺癌耐药性的影响及其潜在机制。我们期望提供关于ERK5调控乳腺癌耐药性作用的新见解。
1 材料与方法
1.1 细胞株与试剂
人乳腺癌耐阿霉素细胞株MCF-7/ADM、人乳腺癌细胞株MCF-7及人正常乳腺细胞株Hs578Bst购自中科院上海生化细胞所;胎牛血清、DMEM培养液购自Gibco公司;嘌呤霉素购自Sigma公司;阿霉素购自上海源叶公司;qRT-PCR相关试剂购自TaKaRa公司;CCK-8试剂盒购自日本同仁公司;Annexin Ⅴ-APC凋亡试剂盒及细胞周期试剂盒购自联科生物公司。
1.2 实验方法
1.2.1 shRNA的合成及慢病毒载体的构建 靶向沉默ERK5基因序列5′-GCTGCCCTGCTCAA-GTCTTTG-3′的短发夹RNA(ERK5-shRNA)的合成、测序与慢病毒载体构建均委托上海吉凯基因公司完成。
1.2.2 细胞培养 乳腺癌细胞MCF-7、MCF-7/ADM及正常乳腺细胞Hs578Bst接种于含10%胎牛血清、100 U/mL青霉素、100 mg/mL链霉素的DMEM培养液中,并置于37 ℃、5% CO2细胞培养箱中培养。MCF-7/ADM细胞培养液中额外加入终浓度为1 μg/mL的阿霉素以维持其耐药性,实验前1周改用无阿霉素培养液。
1.2.3 细胞转染 根据供应商提供的说明书将MCF-7/ADM细胞分为两组接种于6孔板中。ERK5沉默组(shERK5组):使用携带ERK5-shRNA的慢病毒感染细胞用以沉默细胞中ERK5的表达;阴性对照组(shCtrl组):使用携带阴性对照shRNA的慢病毒感染细胞作为对照。连续培养72 h后以嘌呤霉素筛选细胞,荧光倒置显微镜观察慢病毒感染率,实时荧光定量PCR(qRT-PCR)检测ERK5沉默效率。
1.2.4 qRT-PCR检测ERK5 mRNA相对表达水平 Trizol法从细胞中提取总RNA。NanoDrop分光光度计测定样品总RNA的浓度,并使用oligo(dT)引物和逆转录酶将总RNA逆转录为cDNA。使用SYBR Premix Ex Taq试剂盒在ABI 7500 PCR仪中对得到的cDNA样品进行扩增,引物由上海吉凯基因公司合成,GAPDH作为内参基因,引物序列见表1。2-ΔΔCt法分析qRT-PCR实验原始数据,计算各组细胞ERK5 mRNA相对表达水平。
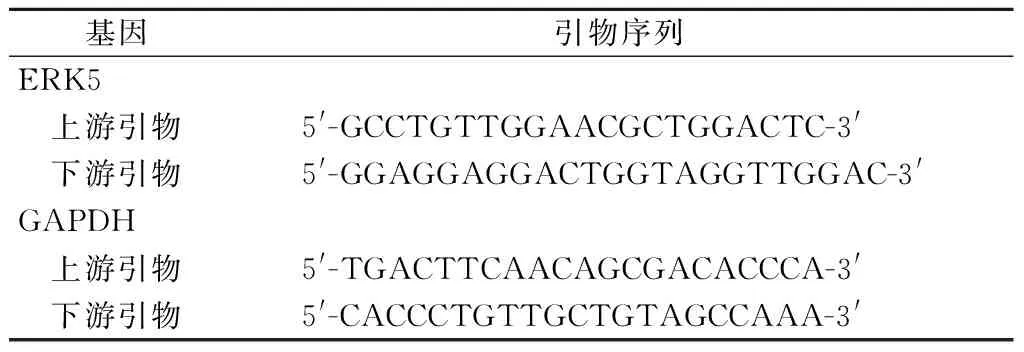
表1 qRT-PCR引物序列Table 1 qRT-PCR primer sequences
1.2.5 CCK-8法检测沉默ERK5对MCF-7/ADM细胞耐药性的影响 胰酶消化,收集转染后MCF-7/ADM细胞,以5000个/孔接种于96孔板中,培养12 h至细胞贴壁。实验细胞分为两组:shERK5组与shCtrl组,并换用含不同浓度阿霉素的培养液培养。阿霉素终浓度为:0、5、10、20、40 μg/mL,每个浓度设5个复孔。培养72 h后,每孔加入10 μL CCK-8试剂继续培养4 h并使用酶标仪测定450 nm波长处吸光度值(A450nm)。计算各药物浓度下细胞抑制率及半数抑制浓度(IC50)。
1.2.6 克隆形成实验检测沉默ERK5对MCF-7/ADM细胞增殖的影响 胰酶消化,收集转染后MCF-7/ADM细胞,以1000个/孔均匀接种于6孔板中,培养12 h至细胞贴壁。实验细胞分为4组:shERK5+阿霉素干预组(15 μg/mL)、shCtrl+阿霉素干预组(15 μg/mL)、shERK5+无阿霉素组、shCtrl+无阿霉素组,每组设3个复孔。细胞常规培养10 d后,4%多聚甲醛固定10 min,0.1%结晶紫溶液染色30 min。将处理后的细胞培养板风干、拍照并进行克隆计数。
1.2.7 流式细胞术检测沉默ERK5对MCF-7/ADM细胞凋亡及周期的影响 胰酶消化,收集转染后的MCF-7/ADM细胞,以5×105个/孔接种于6孔板中。实验细胞分为4组:shERK5+阿霉素干预组(15 μg/mL)、shCtrl+阿霉素干预组(15 μg/mL)、shERK5+无阿霉素组、shCtrl+无阿霉素组,每组3个复孔。细胞连续培养72 h后,用胰酶消化并收集细胞于离心管中。预冷PBS洗涤细胞,离心5 min,重复2次。分别进行①细胞凋亡测定:向每管细胞加入5 μL Annexin Ⅴ-APC试剂混匀,室温下避光孵育20 min,流式细胞仪分析细胞凋亡情况;②细胞周期测定:向每管细胞加入预冷无水乙醇,4℃下固定过夜,次日离心弃上清液,PBS水化细胞,最后向每管细胞中加入100 μL RNA酶(RNase A,100 μg/mL)和1 mL碘化丙啶(PI,50 μg/mL)溶液混匀,常温下避光孵育1 h,流式细胞仪分析细胞周期分布。
1.3 统计学分析
数据以均数±标准差表示,并使用SPSS 22.0软件进行统计分析。两组间均数比较采用独立样本t检验;多组间均数比较采用单因素方差分析(One Way ANOVA)),并使用最小显著性差异法(LSD)进行两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 ERK5 mRNA在MCF-7/ADM细胞中呈显著高表达
qRT-PCR检测各细胞株中ERK5 mRNA表达水平。结果显示:与正常乳腺组织细胞Hs578Bst(0.62±0.10)和乳腺癌非耐药细胞MCF-7(0.54±0.08)相比,乳腺癌耐阿霉素细胞MCF-7/ADM中ERK5 mRNA呈显著高表达[(1.00±0.10),均P<0.05]。这表明ERK5基因可能参与调控MCF-7/ADM细胞耐药。
2.2 ERK5-shRNA慢病毒转染沉默MCF-7/ADM细胞ERK5的表达
MCF-7/ADM细胞经携带ERK5-shRNA或阴性对照shRNA慢病毒转染后,荧光倒置显微镜观察慢病毒感染率:两组细胞慢病毒感染率即绿色荧光蛋白表达率大于80%(图1)。qRT-PCR数据显示,与shCtrl组(1.00±0.06)相比,shERK5组细胞中ERK5 mRNA的表达(0.34±0.06)被显著敲低(P<0.05),沉默效率为65.9%。表明ERK5-shRNA能够有效沉默MCF-7/ADM细胞中ERK5的表达,两组细胞可以作为后续实验模型。
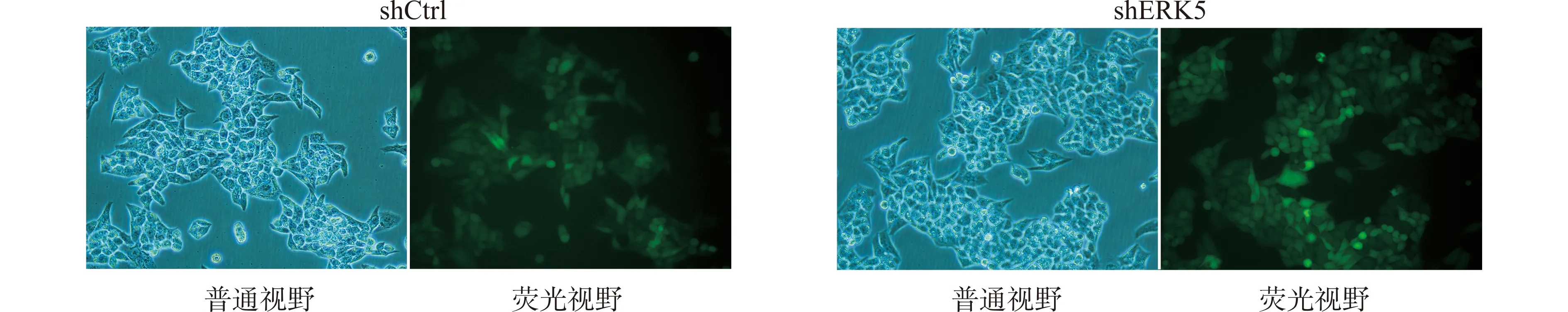
图1 ERK5-shRNA及阴性对照shRNA慢病毒转染细胞后荧光表达图像(×200)Fig.1 The fluorescence expression images of ERK5-shRNA and negative control shRNA lentivirus transfected cells(×200)
2.3 沉默ERK5增强了MCF-7/ADM细胞对阿霉素的药物敏感性
CCK-8法检测shCtrl组与shERK5组细胞对阿霉素的药物敏感性。shERK5组IC50为(15.75±1.01)μg/mL,低于shCtrl组的(27.24±1.85)μg/mL(P<0.05)。同样,与shCtrl组细胞相比,shERK5组细胞在不同浓度阿霉素作用下的72 h细胞抑制率显著增高(均P<0.05,表2)。这些结果表明沉默ERK5可增强乳腺癌耐药细胞MCF-7/ADM对阿霉素的敏感性。
表2 不同浓度阿霉素作用后72 h细胞生长抑制率Table 2 Cell growth inhibition rate after treatment with adriamycin of different concentrations for 72
2.4 沉默ERK5抑制阿霉素作用下MCF-7/ADM细胞的增殖能力
克隆形成实验结果显示:无阿霉素或15 μg/mL阿霉素干预下,shERK5组MCF-7/ADM细胞克隆形成能力均显著低于shCtrl组细胞(均P<0.05),见表3。且在阿霉素干预下这种增殖能力差异更明显。这些数据表明沉默ERK5显著抑制了MCF-7/ADM细胞的增殖能力。
表3 各组MCF-7/ADM细胞克隆数及凋亡率Table 3 Colony-forming units number and apoptosis rate of MCF-7/ADM cells in each
2.5 沉默ERK5促进MCF-7/ADM细胞的凋亡
流式细胞仪检测细胞凋亡结果显示:阿霉素干预前后,shERK5组细胞凋亡率均大于shCtrl组细胞凋亡率(均P<0.05),见图2、表3。这些数据表明沉默ERK5促进MCF-7/ADM细胞凋亡。
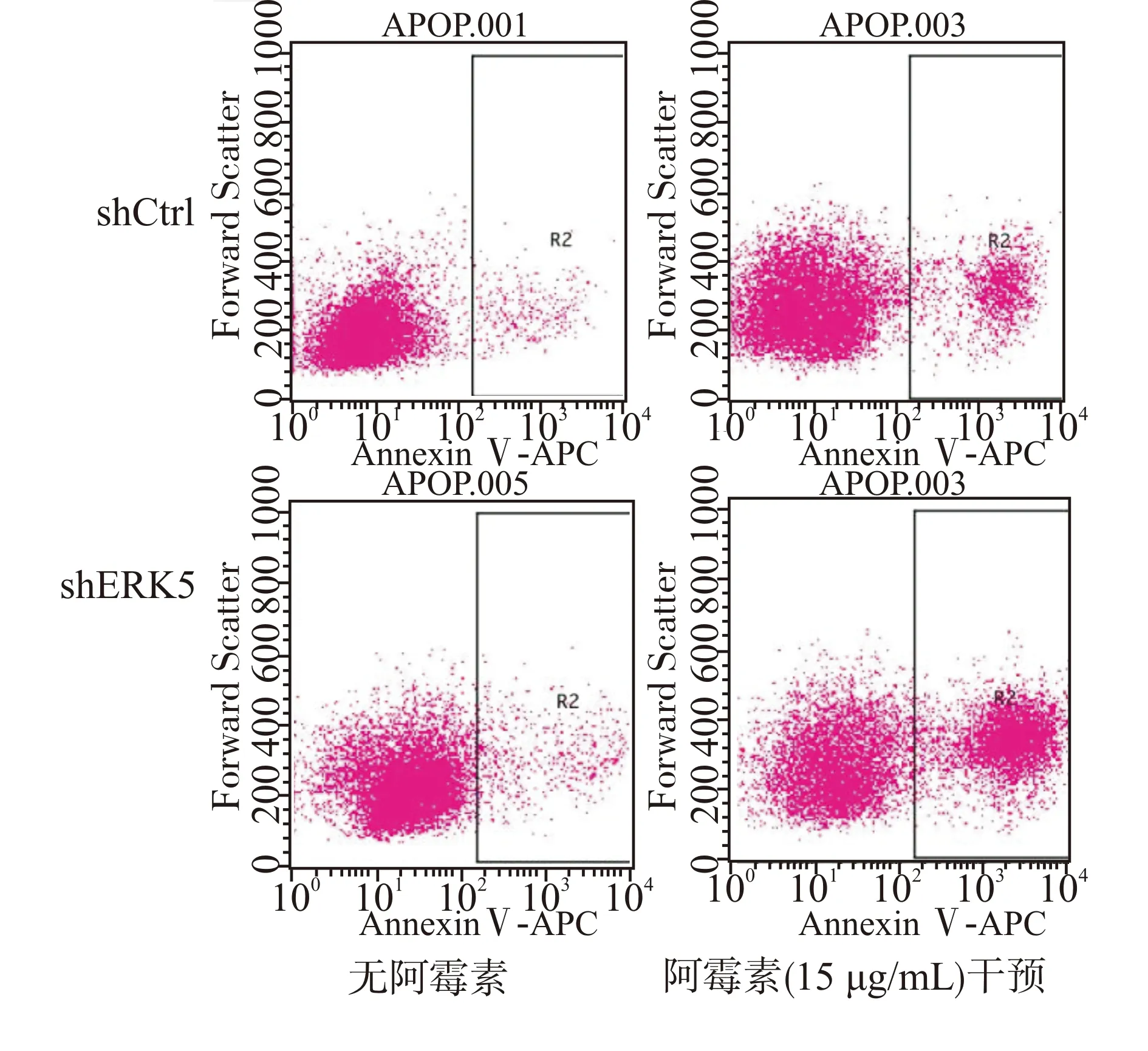
图2 无阿霉素和15 μg/mL阿霉素干预下MCF-7/ADM细胞凋亡情况Fig.2 Apoptosis of MCF-7/ADM cells without adriamycin and with 15 μg/mL adriamycin
2.6 沉默ERK5调控MCF-7/ADM细胞的周期分布
流式细胞仪检测细胞周期分布结果显示:有无阿霉素干预shERK5组处于G0/G1期细胞比例均大于shCrtl组(均P<0.05;图3、表4)。无阿霉素作用下,两组处于S期细胞比例无明显差异(P> 0.05),G2/M期细胞比例shERK5组小于shCtrl组(P<0.05);15 μg/mL阿霉素干预下,两组处于S期、G2/M期细胞比例均无明显差异(均P> 0.05)。这些数据说明沉默ERK5影响MCF-7/ADM细胞周期分布,可能与调控G0/G1期细胞周期阻滞有关。
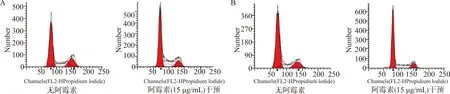
A:shCtrl;B:shERK5图3 无阿霉素和15 μg/mL阿霉素干预下MCF-7/ADM细胞周期分布情况Fig.3 Cell cycle distribution of MCF-7/ADM without adriamycin and with 15 μg/mL adriamycin
表4 各组MCF-7/ADM细胞周期分布比例Table 4 Proportion of cell cycle distribution of MCF-7/ADM in each
3 讨论
乳腺癌患者化疗成功最主要的障碍是肿瘤耐药性的产生[9]。靶向分子治疗作为乳腺癌治疗研究的新热点,为解决乳腺肿瘤耐药提供了新的思路[10]。ERK5在肿瘤细胞的增殖、凋亡及周期进程中发挥着重要作用。Akao等[11]研究发现,ERK5蛋白水平的降低可促进白血病细胞的凋亡。Ye等[12]研究发现阻断ERK5通路会抑制细胞周期蛋白D1、周期蛋白E和CDK4的表达,进而诱导细胞周期停滞于G1期。目前关于ERK5与乳腺癌的研究较少,多数研究认为ERK5在乳腺癌中高表达并与乳腺癌的生长侵袭相关[13-14],也有研究认为ERK5在乳腺癌中表达水平较低,可能负性调节乳腺癌的生长增殖[15]。而我们目前的研究认为,ERK5在乳腺癌耐药细胞MCF-7/ADM中表达水平较高,并与乳腺癌耐药性的形成相关。
ERK5作为MAPK信号转导通路家族最晚被发现的成员,其结构功能与其他家族成员有着诸多相似之处[3]。MAPK通路家族其他3个成员ERK1/2、p38、JUN参与调控肿瘤的耐药性已被相关研究所证实[16-18]。这些研究提示ERK5也可能参与肿瘤耐药性的调控。
基于对目的基因高度特异性的抑制作用,RNA干扰技术被广泛应用于肿瘤基因治疗、靶向药物的研发及肿瘤机制研究中[19]。本研究采用ERK5-shRNA有效沉默了MCF-7/ADM细胞中ERK5 mRNA表达,进而观察沉默ERK5对MCF-7/ADM细胞的增殖、凋亡、周期进程及药物敏感性的影响,以探讨其相关机制。本次研究发现,相较于非耐药细胞MCF-7与正常乳腺细胞Hs578Bst,ERK5在乳腺癌耐药细胞MCF-7/ADM中呈较高的表达水平。CCK-8与克隆形成实验结果提示沉默ERK5可增强MCF-7/ADM细胞对阿霉素药物的敏感性,并有效抑制阿霉素干预前后MCF-7/ADM细胞的克隆形成能力。这表明ERK5可调控MCF-7/ADM细胞的生长增殖及耐药性。流式细胞术分析结果显示,沉默ERK5可促进阿霉素干预前后MCF-7/ADM细胞的凋亡,并一定程度使细胞阻滞于G0/G1期,从而抑制癌细胞的生长。因此,我们认为在乳腺癌中ERK5可能作为一个癌基因,通过减少细胞凋亡和加速细胞周期进程发挥促癌作用,并参与乳腺癌耐药性的调控。目前我们仅验证了ERK5在乳腺癌耐阿霉素细胞株的作用,ERK5在其他乳腺癌耐药株中的作用需要进一步研究。
综上所述,ERK5是调控乳腺癌进展的重要基因。我们的研究提示,ERK5在乳腺癌耐药细胞MCF-7/ADM中高表达,沉默ERK5可逆转MCF-7/ADM细胞的阿霉素耐药性。未来靶向干扰ERK5可能成为干预乳腺肿瘤化疗耐药的新策略。

