可溶性环氧化物水解酶抑制剂TPPU促进低灌注脑白质损伤后髓鞘再生的相关机制*
陈余雪, 刘幸华, 刘 璐
华中科技大学同济医学院附属同济医院 1风湿免疫科 2创伤外科 3药学部,武汉 430030
目前,认知功能障碍相关疾病已成为继心脏疾病及肿瘤后,影响人类健康的第三大杀手,给人类生活及社会带来沉重的负担[1]。慢性低灌注引起的缺血性脑白质损伤(white matter lesions,WMLs)可造成一定的认知功能损害及其它一些神经功能缺损,约占人类缺血性脑卒中的1/4[2]。由其导致的认知功能障碍相关性疾病已经成为我国严重的公共卫生问题之一,给患者、家庭以及社会造成沉重的负担。
寻找对中枢神经系统微环境中多种细胞成分具有保护作用的方法,从整体上促进微环境结构和信号重塑是潜在的发展方向。表氧化二十碳三烯酸(epoxyeicosatrienoic acids,EETs)具有舒张血管、神经保护、抗炎、抗凋亡、抗氧化应激、抗血小板聚集、促进细胞增殖和血管新生等多种生物学功能[3]。而对于EETs在慢性低灌注引起的缺血性脑白质损伤中的作用及机制,尚未见相关报道。EETs在生物体内极不稳定,易被可溶性环氧化物水解酶(soluble epoxide hydrolase,sEH)降解为低活性的二氢二十碳三烯酸(dihydroxyeicosatrienoic acids,DHETs)。TPPU作为新一代sEH抑制剂,具有更好的稳定性及生物学特性,并可通过血脑屏障,抑制中枢神经系统中sEH的表达,从而使体内EETs表达量增加,发挥相应的生物学功能[4]。本研究通过建立C57BL/6J小鼠双侧颈总动脉狭窄模型(bilateral common carotid artery stenosis,BCAS),模拟临床上以高血压、脑血管病变引起的低灌注脑白质损伤,研究TPPU促进小鼠白质低灌注损伤后髓鞘再生的相关机制。
1 材料与方法
1.1 主要实验材料
1.1.1 主要实验试剂 DMSO(武汉谷歌科技有限公司),TPPU(美国加利福利亚大学免费提供),小鼠抗GFAP多克隆抗体(美国Sigma公司),FITC标记的驴抗小鼠IgG(美国Jackson ImmunoResearch公司),兔抗Iba1单克隆抗体(日本Wako公司),FITC标记的驴抗兔IgG(美国Jackson ImmunoResearch公司),BCA蛋白定量试剂盒(武汉博士德生物工程有限公司),RIPA强裂解液(上海碧云天生物技术研究所),小鼠抗β-actin单克隆抗体(武汉博士德生物工程有限公司),蛋白酶抑制剂cocktail(瑞士Roche公司),兔抗ERK1/2多克隆抗体、兔抗磷酸化-ERK1/2多克隆抗体、兔抗p38 MAPK多克隆抗体、兔抗磷酸化-p38 MAPK多克隆抗体、小鼠抗JNK多克隆抗体、兔抗磷酸化-JNK多克隆抗体(美国Cell Signaling公司),IRDye 800-羊抗兔IgG、IRDye 800-羊抗大鼠、Alexa Fluor700-羊抗小鼠IgG、Alexa Fluor700-驴抗羊IgG(美国LI-COR Biosciences公司),LFB染液(武汉谷歌科技有限公司)。
1.1.2 主要设备 手术显微镜(1-FR型,德国Zeiss公司),恒温冰冻切片机(CM1900型,德国LEICA公司)、Microcoil(日本萨密你弹簧有限公司),激光共聚焦荧光显微镜(LSM1200型,日本Olympus公司),普通荧光显微镜(BX51型,日本Olympus公司),Odyssey IR成像仪(美国LI-COR Biosciences公司)。
1.2 实验方法
1.2.1 动物模型建立及分组 8~12周龄雄性C57BL/6J小鼠(体重为22~28 g)称重后经鼻罩吸入2%异氟烷诱导麻醉,分离双侧颈总动脉,并用0.18 mm内径微弹簧夹套双侧颈总动脉。实验小鼠随机分为3组:假手术组(只分离双侧颈总动脉)、vehicle组(BCAS手术+1%DMSO)、TPPU干预组(BCAS手术+TPPU 0.3 mg/kg体重)。造模后第1天至处死前1 d,每日相同时间点根据小鼠体重进行腹腔内药物注射。分别于术后3 d、2周、4周、8周等时间点每组各取4~6只小鼠用于后续实验,实验共计87只小鼠。
1.2.2 激光多普勒监测小鼠BCAS的血流动力学改变 小鼠头部备皮,消毒,手术剪纵行剪开头皮,分离皮下结缔组织,充分暴露顶骨及前囟,以前囟后1 mm、旁开2.5 mm处为监测点,将激光多普勒的探头连接光纤,将光纤尖端对准标记点,垂直插入1~2 mm,根据血流值调整位置,保证基线血流平稳且大于800 PU后,迅速完成小鼠BCAS操作,术中术后连续监测1 h,观察白质区域脑血流变化。
1.2.3 激光散斑衬比成像监测小鼠BCAS的血流动力学改变 雄性C57BL/6J小鼠称重后鼻罩吸入2%异氟烷诱导麻醉,将小鼠头颅颅骨磨薄至硬脑膜,使用激光散斑衬比成像系统观察BCAS术前及术后脑血流10 min,血流平稳后记录血流及影像数据5 min,观察双侧颈总动脉狭窄后血流变化情况。
1.2.4 免疫荧光染色 在术后3 d、2周、4周及8周用10%水合氯醛腹腔注射深度麻醉小鼠,利用提前预冷的4%多聚甲醛慢慢灌注后迅速断头取脑,取脑后行沉糖处理。将小鼠脑组织用OCT胶包裹,在冰冻切片机内进行冠状面连续切片,厚度为12 μm。本部分所用一抗为:Iba1(日本Wako公司,1∶200);GFAP(美国Sigma公司,1∶200)。对应二抗为:Cy3-羊抗兔IgG(美国Jackson ImmunoResearch公司,1∶200);FITC-羊抗小鼠IgG(美国Jackson ImmunoResearch公司,1∶200)。对每张脑片的胼胝体区域进行随机拍照,根据需要调整放大倍数,每张脑片至少采集5张照片,每只小鼠至少选择4张脑片,每组至少4只小鼠。每次均在相同参数条件下观察及采集图像。
1.2.5 LFB染色 从-80℃冰箱将切片取出,梯度降至室温后用乙醇梯度脱水。再将切片放入预热的LFB染液,放入60℃的烤箱孵育8~10 h;切片取出后待其自然冷却至室温,流水冲洗5 min后置于75%乙醇中;在0.05%Li2CO3中分色10 s后再置于75%乙醇中,用显微镜观察着色和分色情况,可见灰质部分颜色变淡,若分色程度不够可再次重复上述步骤;分别用75%、95%及100%的乙醇梯度脱水,通风橱内晾干,置于二甲苯中透明5 min;通风橱内晾干后用中性树胶封片。
1.2.6 Western blot检测 在术后4周用10%水合氯醛腹腔注射深度麻醉小鼠,将预热的30 mL生理盐水从左心室快速灌注后迅速断头取脑,随后分离脑白质,称重后放入玻璃匀浆器中,根据组织重量加入适量的RIPA裂解液(含1%PMSF和cocktail蛋白酶抑制剂),进行碾磨后置于冰上裂解。利用BCA法进行蛋白浓度测定,根据实际测得的各蛋白浓度,加入适量的RIPA裂解液,最后将所有蛋白浓度均调整为20 μg/μL。上样时按每孔40 μg总蛋白量吸取待测蛋白进行电泳及蛋白转移。随后利用Odyssey IR成像仪扫描,以目的蛋白A值/β-actin蛋白A值反映目的蛋白的相对表达量。本部分所用一抗及其稀释比例:β-actin、ERK1/2(1∶1000),磷酸化ERK1/2(1∶1000),p38 MAPK(1∶1000),磷酸化p38 MAPK(1∶1000),JNK(1∶500),磷酸化JNK(1∶500)。对应二抗为:Alexa Fluor700-驴抗羊IgG(1∶5000),Alexa Fluor700-羊抗小鼠IgG(1∶5000),IRDye 800-羊抗大鼠IgG(1∶5000),IRDye 800-羊抗兔IgG(1∶5000)。
1.3 统计学处理
激光散斑衬比成像图像数据利用MAT LAB软件进行处理及分析。统计处理应用PrismPad 6软件包,所得数据用均数±标准差表示,组间数据比较采用单因素方差分析(one-way ANOVA)及独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 BCAS模型的成功构建
采用BCAS手术制备小鼠低灌注性白质损伤模型,利用激光多普勒及激光散斑衬比成像技术监测小鼠BCAS手术过程中脑白质区域血流变化情况。结果显示,激光多普勒监测BCAS术中小鼠白质区域血流值下降至术前水平的50%左右,连续监测未见血流发生明显变化(图1A、1B)。激光散斑衬比成像技术连续监测BCAS造模前后小鼠脑血流,小鼠血流明显下降至术前50%左右,与激光多普勒结果相一致(图1C、1D),判定BCAS小鼠模型构建成功。观察术后小鼠一般生命体征平稳,无视力缺损,无神经系统功能缺损体征,均可正常活动,可纳入后续实验研究。
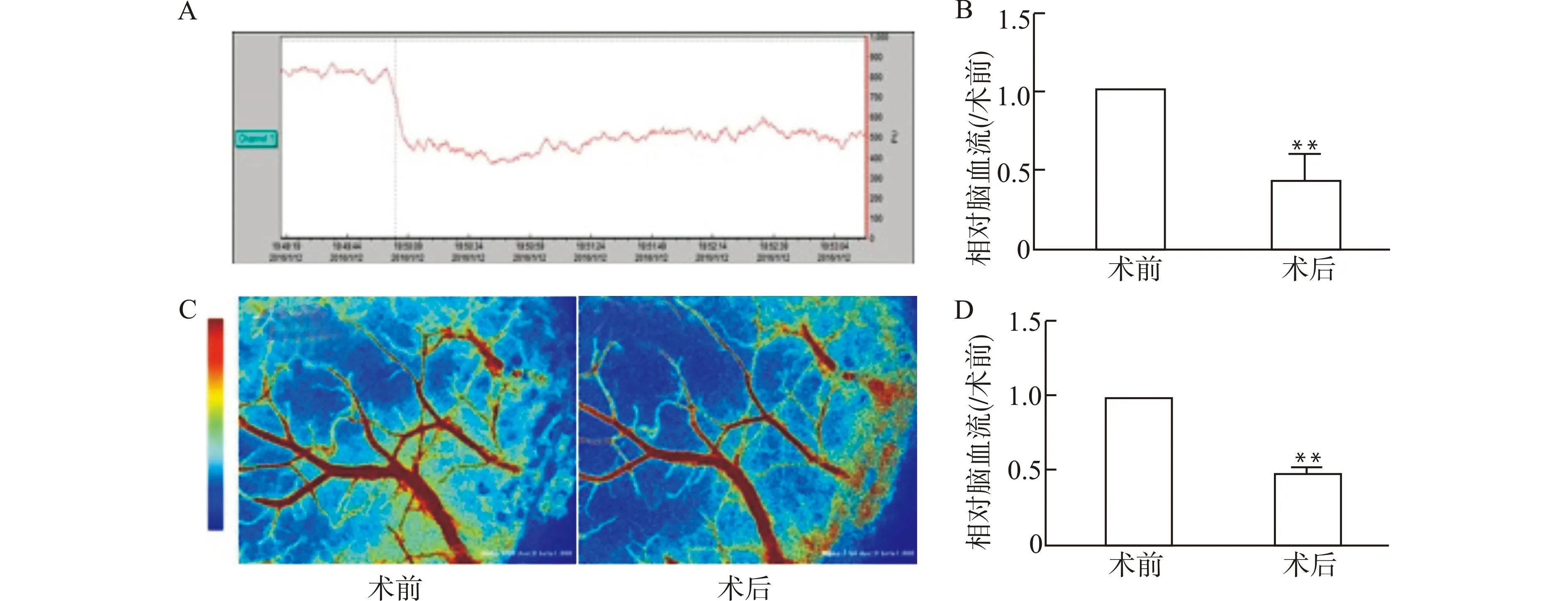
A:激光多普勒监测BCAS术中血流变化示意图;B:激光多普勒监测BCAS术中血流变化统计图;C:BCAS术中激光散斑衬比成像技术监测脑血流示意图;D:BCAS术中激光散斑衬比成像技术监测血流变化统计图;n=6;与术前比较,**P<0.01图1 成功构建小鼠BCAS模型Fig.1 Successful establishment of a mouse model of BCAS
2.2 TPPU改善低灌注损伤后脱髓鞘情况
利用LFB染色观察TPPU治疗4周后白质损伤及脱髓鞘情况。LFB染色显示,与vehicle组相比,TPPU治疗组小鼠在胼胝体中央区(middle part of corpus callosum,CCm)、新纹状体(caudoputamen,CPu)和前联合(anterior commissure,AC)区染色较深,髓鞘排列规则,空泡形成和髓鞘脱失情况都减少(图2),差异具有统计学意义(P<0.05,表1)。
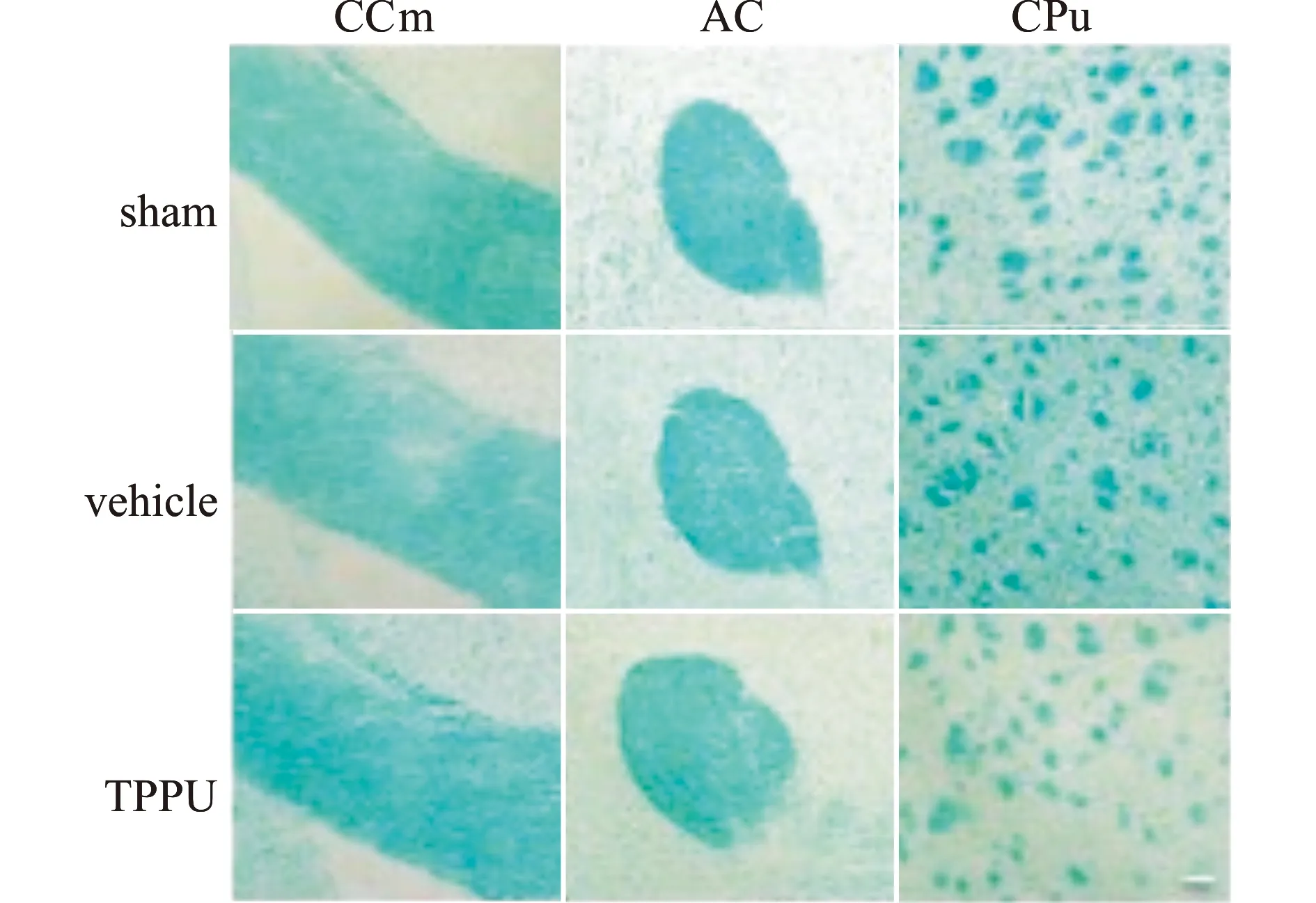
与sham组小鼠相比,vehicle组小鼠在胼胝体中央区(CCm)、新纹状体区(CPu)和前联合区(AC)LFB染色异常,颜色变浅,存在明显的髓鞘稀疏、空泡形成和排列紊乱;TPPU治疗组髓鞘结构相对完整,空泡减少,髓鞘厚度增厚;标尺=50 μm图2 BCAS术后不同白质区域LFB髓鞘染色情况Fig.2 LFB staining in different white matter areas after BCAS injury
表1 BCAS术后不同白质区域LFB髓鞘染色结果比较Table 1 LFB staining in different white matter areas
2.3 TPPU抑制低灌注损伤后星形胶质细胞活化
利用免疫荧光技术检测小鼠BCAS术后3 d、2周、4周及8周胼胝体中央部星形胶质细胞标志物GFAP的动态表达变化。如图3所示,自BCAS术后第3天起,模型动物胼胝体区域星形胶质细胞出现活化增殖,胞体肥大、突起增多,细胞数目增多,低灌注后第4周时达到高峰,第8周表达量有所下调,但仍较sham组明显增多,其差异均具有统计学意义(均P<0.01)。给予TPPU干预治疗后可发现各时间点星形胶质细胞活化明显减少,在第2、4、8周差异具有统计学意义。
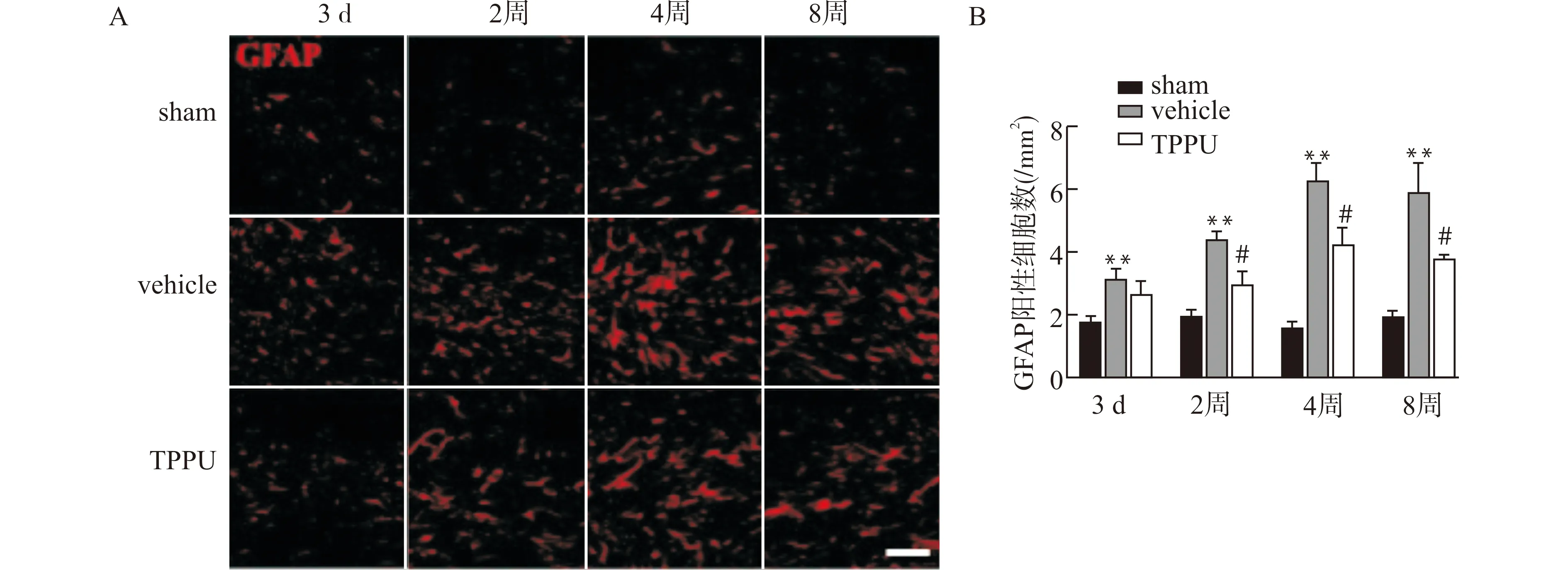
A:免疫荧光检测低灌注白质损伤后各组不同时间点GFAP表达变化代表图,标尺=50 μm;B:免疫荧光检测低灌注白质损伤后不同时间点各组GFAP表达变化统计图;与sham组比较,**P<0.01;与vehicle组比较,#P<0.05;n=5图3 TPPU抑制低灌注损伤后星形胶质细胞活化Fig.3 TPPU inhibits astrocytes activation after hypoperfusion injury
2.4 TPPU可抑制白质低灌注损伤后小胶质细胞活化
小胶质细胞的活化在缺血性脑卒中的发生发展中起到重要作用。
Iba1作为小胶质细胞的特异性标志物,胼胝体区域小胶质细胞自低灌注损伤后第3天即发生明显的活化增多,胞体肥厚,于第2周达到高峰,之后有所减少,但仍明显高于sham组。给予TPPU干预治疗后可发现各时间点小胶质细胞活化明显减少,在第2、4、8周差异均具有统计学意义(均P<0.05,图4)。
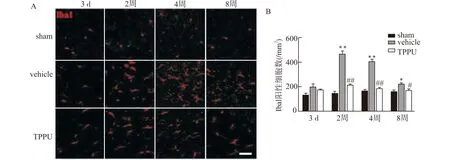
A:免疫荧光检测低灌注白质损伤后各组不同时间点Iba1表达变化代表图,标尺=50 μm;B:免疫荧光检测低灌注白质损伤后不同时间点各组Iba1表达变化统计图;与sham组比较,*P<0.05 **P<0.01;与vehicle组比较,#P<0.05 ##P<0.01;n=5图4 TPPU抑制低灌注损伤后小胶质细胞活化Fig.4 TPPU inhibits the activation of microglia after hypoperfusion injury
2.5 TPPU通过MAPK信号通路发挥对低灌注损伤白质的保护作用
由图5可见,低灌注损伤后4周,vehicle组磷酸化的ERK1/2及磷酸化的p38 MAPK水平较sham组明显增高(均P<0.05),而总ERK1/2、总p38 MAPK、总JNK及磷酸化的JNK水平均无明显差异(均P>0.05);给予TPPU治疗后,可明显降低磷酸化的ERK1/2及磷酸化的p38 MAPK的表达水平(均P<0.05)。说明TPPU可能通过MAPK信号通路参与保护低灌注所造成的白质损伤。
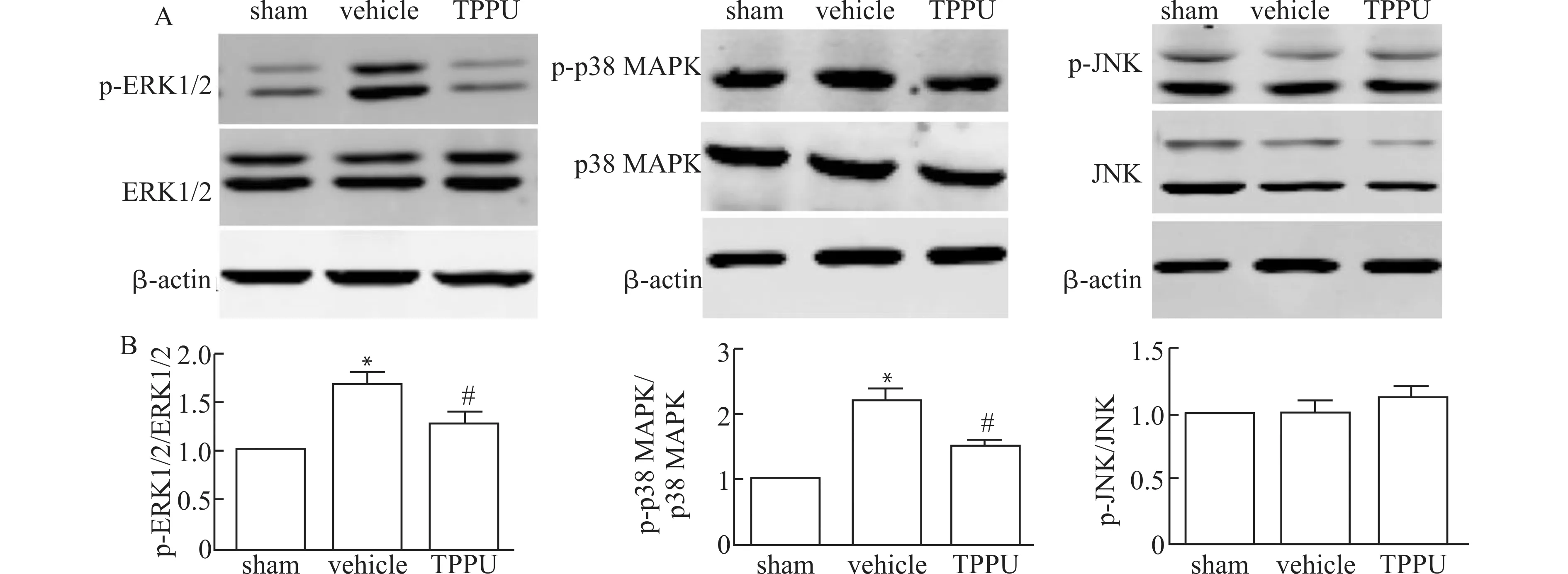
A:Western blot检测低灌注白质损伤后4周各组小鼠MAPK信号通路表达变化代表图;B:Western blot检测低灌注白质损伤后4周各组小鼠MAPK信号通路表达变化统计图;与sham组比较,*P<0.05;与vehicle组比较,#P<0.05;n=5图5 TPPU通过MAPK信号通路发挥对低灌注损伤白质的保护作用Fig.5 TPPU protects white matter damage caused by hypoperfusion through MAPK signaling pathway
3 讨论
缺血性脑白质病变发病率逐年升高,与认知功能障碍密切相关,但其具体机制不明,临床上亦缺乏良好的早期诊断和治疗手段。目前关于脑损伤及认知功能障碍的研究主要集中于单一细胞的功能及相关病理改变,以改善循环、营养神经细胞为主要治疗方法,仍未发现治疗脑白质损伤及认知功能障碍的有效手段。WMLs致认知损害的具体机制仍不明确,并且不同于大血管病变。WMLs相关认知功能障碍起病隐匿、病程较长、难以彻底治愈、缺乏特异性的早期诊断及治疗手段,因此,亟须深入研究WMLs及相关认知功能障碍的发病机制,为WMLs相关认知功能障碍的早期诊断和针对性干预提供参考。
EETs具有舒张血管、神经保护、抗炎、抗凋亡、抗氧化应激、抗血小板聚集、促进细胞增殖和血管新生等多种生物学功能[3]。其在中枢神经系统损伤中也发挥重要作用,EETs可促进缺血组织内血管的舒张,允许更多的血液流入缺血区域。另外,可通过调节分水岭区域血流及血流逆行通过闭塞的血管网络来改善缺血区域的血流情况。而且再灌注后可通过贮存脑血流量来防止缺血后血管调节障碍所导致的二次损伤。有研究表明,sEH抑制剂可通过调控脑血流量来发挥其在局灶性缺血性脑卒中的保护作用[5]。同时,增加EETs的表达可在血管内皮细胞中发挥明显的抑炎作用,降低白细胞粘附蛋白V-CAM和I-CAM的表达,减少环氧合酶COX-2相关炎症反应[6]。但EETs在生物体内极不稳定,易被sEH降解为DHETs,因而限制了EETs的外源性使用。而因为sEH为EETs代谢过程中的关键酶,给予sEH抑制剂TPPU将成功放大EETs功能,sEH抑制剂有望成为未来治疗缺血性脑损伤的重要药物之一。
本研究发现,可溶性环氧化物水解酶抑制剂TPPU干预后可有效减轻脑白质损伤的情况,改善髓鞘结构完整性,抑制低灌注性白质损伤后星形胶质细胞及小胶质细胞活化,促进白质连接完整性的恢复及髓鞘再生,最终促进认知功能的恢复。同时发现MAPK信号通路参与调控TPPU治疗小鼠低灌注性白质损伤,为进一步理解缺血性脑白质病变的病理机制,开发新的治疗药物提供实验依据。
EETs信号系统在低灌注性白质损伤中发挥抑炎及促进髓鞘功能恢复作用,但其中涉及的信号通路和机制尚不清楚。有研究发现,EETs信号系统与cAMP/PKA、PI3K-Akt及MAPK信号通路密切相关[7]。同时,有研究表明,MAPK信号通路所涉及的ERK1/2、p38 MAPK和JNK参与调节少突胶质细胞的分化及髓鞘再生[8-12]。本研究发现,低灌注白质损伤后,小鼠胼胝体区域磷酸化的ERK1/2及p38 MAPK均出现上调,而总的ERK1/2、p38 MAPK及JNK、磷酸化的JNK均未发生明显变化。给予sEH抑制剂TPPU进行干预后,可以逆转磷酸化的ERK1/2及p38 MAPK的变化。从以上结果中,我们推测,sEH抑制剂TPPU可能通过ERK1/2及p38 MAPK信号通路发挥其在低灌注白质损伤中的保护作用。ERK1/2及p38 MAPK信号通路在其中具体的作用还需要进行更深入的研究,这将对白质损伤的治疗提供新的临床思路及实验基础。
综上所述,本研究通过药源性TPPU抑制可溶性环氧化物水解酶sEH的活性,增加组织中EETs的表达量,从而发挥其在低灌注白质损伤后的神经保护作用,其中所涉及的信号通路包括ERK1/2及p38 MAPK等。通过sEH抑制剂TPPU可有效改善白质连接完整性,抑制星形胶质细胞及小胶质细胞的活化,最终促进低灌注白质损伤后神经功能的恢复。尽管其相关下游的作用靶点及机制还有待于进一步研究,但本研究结果已表明sEH抑制剂有望成为未来脱髓鞘相关疾病新的治疗靶点。

