经直肠超声结合剪切波弹性成像在直肠癌诊断及TNM分期中的应用
张珊珊,李诺,刘露,张绅
(中国医科大学附属第四医院 消化内镜科,辽宁 沈阳110032)
手术是治疗直肠癌的主要手段,全直肠系膜切除术(total mesorectal excision, TME)是临床治疗直肠癌的常用术式之一[1]。TNM 分期是肿瘤手术方式选择和预后评估的重要依据,良性腺瘤或处于T1期、T2期的直肠癌患者可考虑内镜显微外科手术或局部切除治疗,而T3期、T4期患者在术前则需要进行放疗、化疗辅助,故直肠癌的早期诊断和TNM分期十分重要[2-3]。 经直肠超声(transrectal ultrasound,TRUS)检查是诊断直肠癌分期的常用手段,其优势在于可清晰识别各个层次直肠壁,且操作简便,但也可能对肠腔梗阻或明显狭窄的直肠癌无法扫描[4-5]。剪切波弹性成像(shear wave elastrography, SWE)技术是一种通过彩色编码技术对特定成像系统中追踪和获得的横波进行处理,从而实时呈现出组织弹性图像的检查技术,并可通过杨氏模量定量测量对组织弹性图像进行定性分析,根据病灶组织的弹性硬度,判断肿瘤组织的良、恶性,这为直肠癌的早期诊断及TNM 分期提供了有价值的信息[6-7]。目前国内外采用TRUS 联合SWE 诊断直肠癌的研究还较少,本研究将根据病理结果分析两者联合诊断直肠癌及TNM 分期的应用效果。
1 资料与方法
1.1 一般资料
回顾性分析2019年12月—2021年2月中国医科大学附属第四医院收治的86 例直肠肿瘤患者临床资料。其中,男性64 例,女性22 例;年龄41~71 岁,平均(56.82±4.76)岁;直肠癌71 例,直肠腺瘤8 例,直肠间质瘤3 例,神经内分泌瘤4 例;肿瘤远端距肛门距离为6~13 cm,平均(9.25±1.28)cm;TNM 分期:T1期17例,T2期11例,T3期39例,T4期4 例。将71 例直肠癌患者作为直肠癌组,15 例非直肠癌患者作为非直肠癌组。纳入标准:符合《中国结直肠癌筛查与早诊早治指南》[8]诊断标准;入院后均进行TRUS 和SWE 检查,并在2 周内手术,有明确的病理结果,TNM 分期明确;肿瘤远端距肛门距离≤15 cm;临床资料完整。排除标准:直肠癌术后复发患者;术前进行放疗、化疗的直肠癌患者;明显肠腔狭窄,无法进行超声检查。
1.2 诊断仪器及参数
TRUS 检查采用Mylab 彩色多普勒超声诊断仪(意大利ESAOTE 公司),选择腔内双平面探头,频率线阵4~13 MHz,凸阵3~9 MHz。SWE 检查采用Aix-plorer 彩色多普勒超声诊断仪(法国Supersonic Imagine 公司),选择SE12-3 经直肠探头,频率3~12 MHz。
1.3 方法
所有患者检查前需进行灌肠处理,之后依次进行TRUS 和SWE 检查。
1.3.1 TRUS检查患者取左侧卧位,屈髋屈膝,深呼吸放松肛门,在套有避孕套的探头上涂抹适量耦合剂,进入直肠,确保清晰显示肿瘤病灶,采用膝胸位时针法记录病灶大小、边缘、浸润深度、回声、距肛缘的距离、血管形成、周围器官组织侵犯情况,进行术前分期。
1.3.2 SWE 检查调节探头以优化焦点、深度、动态范围、时间增益补偿,确保清晰显示肿瘤病灶,在无压缩情况下用换能器靠近病灶,直至彩色图信号稳定,冻结图像,启动Q-box 系统测量组织硬度,记录肿瘤病灶、周围脂肪和正常直肠壁3 个位置杨氏模量值,测量5 次后取最大值(Emax)和平均值(Emean)。
1.4 观察指标
以病理结果为标准,记录TRUS 与SWE 诊断直肠癌及其TNM 分期的敏感性、特异性及准确率。并绘制ROC 曲线分析TRUS、SWE 及联合诊断直肠癌的价值。比较直肠癌与直肠腺瘤患者肿瘤病灶、周围脂肪和正常直肠壁3 个位置的Emax、Emean值。
1.5 统计学方法
数据分析采用SPSS 23.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或方差分析,两两比较用LSD-t检验,绘制ROC 曲线。P<0.05 为差异有统计学意义。
2 结果
2.1 不同方式诊断直肠癌的敏感性、特异性及准确率
TRUS 诊断的敏感性为85.92%(95% CI:0.68,0.89),特异性为66.67%(95% CI:0.52,0.72),准确率为82.56%(95% CI:0.73,0.91);SWE 诊断的敏感性为87.32%(95% CI:0.70,0.90),特异性为73.33%(95% CI:0.55,0.79),准确率为84.88%(95% CI:0.76,0.94);联合诊断直肠癌的敏感性为97.18%(95% CI:0.80,0.99),特异性为86.67%(95% CI:0.71,0.98),准确率为95.35%(95% CI:0.78,0.99)。ROC 曲线分析结果显示,TRUS、SWE 及两者联合诊断直肠癌的AUC分别为0.801(95% CI:0.70,0.92)、0.886(95% CI:0.71,0.98)和0.968(95% CI:0.89,1.00)。见图1。
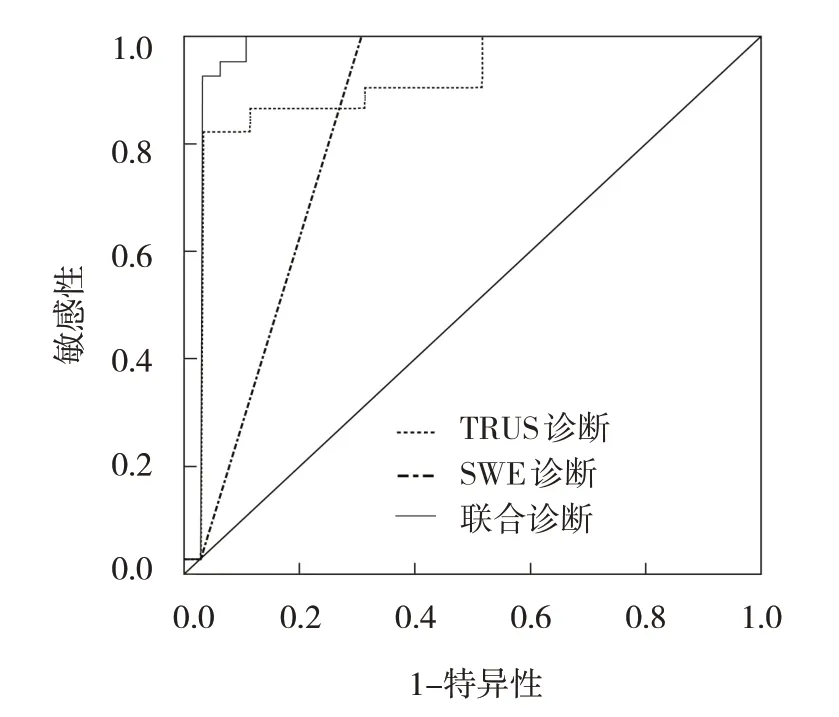
图1 TRUS、SWE及两者联合诊断直肠癌的ROC曲线
2.2 不同方式诊断直肠癌TNM 分期的敏感性、特异性及准确率
经TRUS诊断为T1期的准确率为88.24%(95%CI:0.71,0.91),T2期的准确率为81.82%(95% CI:0.67,0.89),T3期的准确率为84.62%(95% CI:0.69,0.90),T4期的准确率为100.00%(95% CI:0.99,1.00)。经SWE 诊断为T1期的准确率为88.24%(95% CI:0.71,0.92),T2期的准确率为90.91%(95% CI:0.79,0.95),T3期的准确率为87.18%(95% CI:0.76,0.91),T4期的准确率为100.00%(95% CI:0.99,1.00)。两者联合诊断为T1期的准确率为94.12%(95% CI:0.76,0.94),T2期的准确率为90.91%(95% CI:0.72,0.92),T3期的准确率为100.00%(95% CI:0.99,1.00),T4期的准确率为100.00%(95%CI:0.99,1.00)。见表1~3。

表1 TRUS诊断直肠癌TNM分期 例
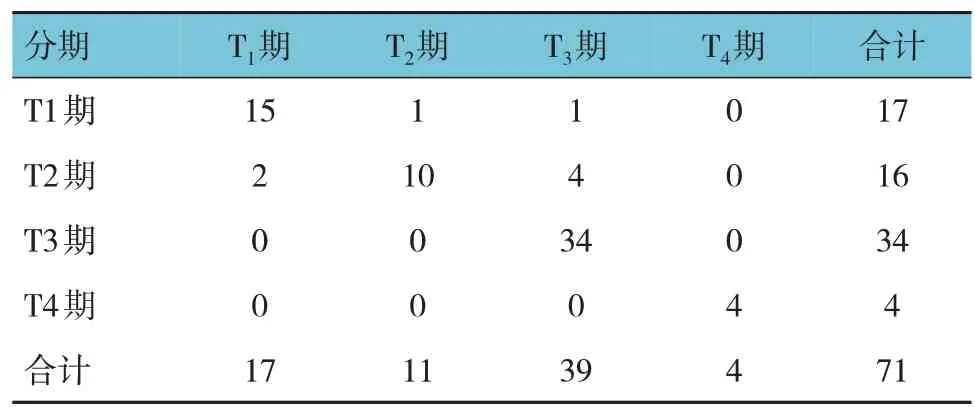
表2 SWE诊断直肠癌TNM分期 例

表3 联合诊断直肠癌TNM分期 例
2.3 两组杨氏模量值比较
两组Emax、Emean值比较,差异有统计学意义(P<0.05),直肠癌组较非直肠癌组高。见表4、5。
表4 两组杨氏模量Emax值比较 (±s)
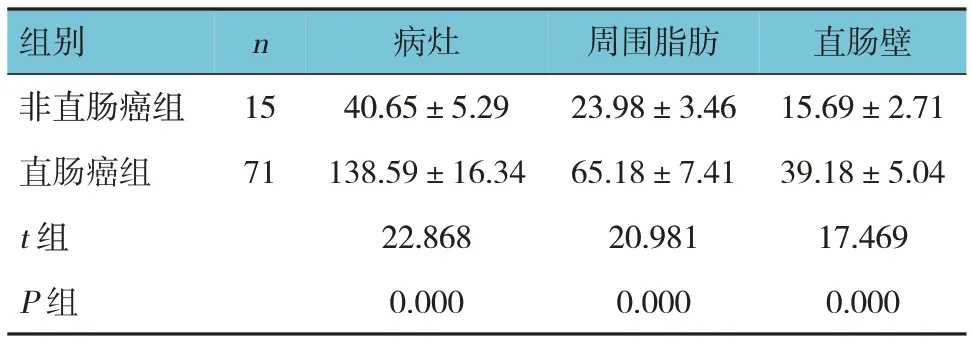
表4 两组杨氏模量Emax值比较 (±s)
组别n 病灶周围脂肪直肠壁非直肠癌组直肠癌组t 组P 组15 71 40.65±5.29 138.59±16.34 22.868 0.000 23.98±3.46 65.18±7.41 20.981 0.000 15.69±2.71 39.18±5.04 17.469 0.000
表5 两组杨氏模量Emean值比较 (±s)
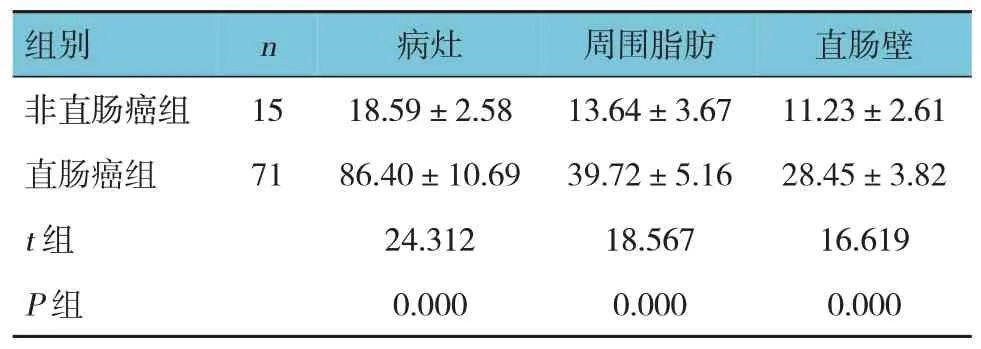
表5 两组杨氏模量Emean值比较 (±s)
组别n 病灶周围脂肪直肠壁非直肠癌组直肠癌组t 组P 组15 71 18.59±2.58 86.40±10.69 24.312 0.000 13.64±3.67 39.72±5.16 18.567 0.000 11.23±2.61 28.45±3.82 16.619 0.000
2.4 不同分期的杨氏模量值比较
不同分期的杨氏模量值比较,差异有统计学意义(P<0.05),且TNM 分期越晚,Emax、Emean值越高。见表6。
表6 不同分期杨氏模量值比较 (±s)
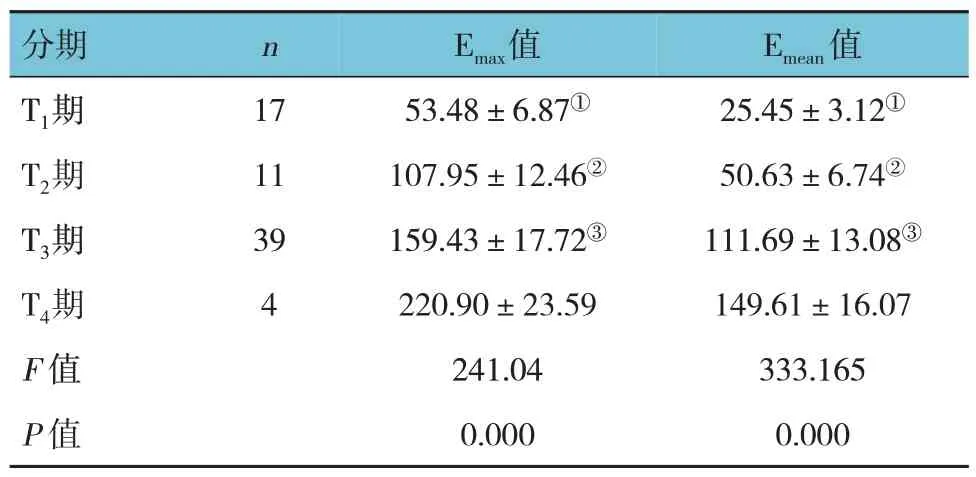
表6 不同分期杨氏模量值比较 (±s)
注:①与T2期、T3期、T4期比较,P<0.05;②期与T3期比较,P<0.05;③与T4期比较,P<0.05。
Emean值分期n Emax值25.45±3.12①50.63±6.74②111.69±13.08③149.61±16.07 333.165 0.000 T1期T2期T3期T4期F 值P 值17 11 39 4 53.48±6.87①107.95±12.46②159.43±17.72③220.90±23.59 241.04 0.000
3 讨论
术前对直肠癌进行准确分期是临床选择治疗方式的关键,TRUS 诊断直肠癌以5 层直肠壁模型为基础,其可清晰显示直肠壁横截面上正常肠壁与肿瘤侵犯的最深位置,并根据肿瘤侵犯情况给予分期[9-10]。有研究指出,TRUS 的分期诊断准确率为80%~95%,但由于超声波的穿透力有限,因此对深部肿瘤的层次鉴别率较低,尽管国外少量研究提出T1~T4期存在逐期递减的规律性,但仍不可避免整体分期诊断准确率的下降[11-12]。其可能原因为TRUS 无法区分癌组织与淋巴滤泡、炎症组织及纤维结缔组织;缩窄型直肠癌会遮蔽超声波,阻碍肿瘤的可视化,导致分期不足,肿瘤组织与肠壁出血或坏死则可能导致TRUS 过度分期。此外,由于放疗、化疗会使肿瘤病灶发生局部炎症、细胞坏死等情况,所以放疗、化疗后所得出的TRUS结果并不能体现正确的分期,而是肠壁的纤维化范围,因此诸多处于T3、T4期直肠癌患者在术前均需先进行放疗、化疗辅助治疗[13-14]。
SWE 通过判断弹性图像的软硬度诊断直肠肿瘤的良、恶性,若弹性图像显示周边肿物较硬,可考虑为恶性,若在联合TRUS 诊断时,TRUS 显示并非恶性表现,就可纠正SWE 诊断结果,故两者联合诊断对提高直肠癌诊断准确率具有一定价值[15]。FAN 等[16]研究指出,SWE 有助于判断直肠肿瘤的入侵深度,可为直肠癌分期的术前诊断提供可量化指标,并可用作常规TRUS 的补充。徐明达等[17]研究指出,联合诊断可有效提高直肠癌的诊断能力,并在直肠癌TNM 分期中具有较高的诊断准确性,这也与本研究结果一致。弹性体在受到外界施压时会发生形变,并会在无外力施压后恢复原始状态,不同组织间弹性应变情况也存在差异,如脂肪组织较易变性,在去掉外力后可快速恢复,而纤维组织和肌肉组织较脂肪组织恢复慢。超声弹性成像技术可在二维超声的基础上提供不同组织的弹性信息,因此临床基于该原理通过探头对组织施加外力来获取形变信息,并经软件处理后由彩色编码图像展现[18-19]。SWE 技术利用“马赫锥”原理在组织中产生一种剪切波,并通过弹性成像系统追踪和获取该类波,最后采用彩色编码技术将组织弹性图可视化地实时呈现出来,同时通过测量杨氏模量数值来反应组织的软硬程度,其与组织的硬度呈正相关,即组织越硬,图像所呈现的颜色则越红,杨氏模量值则越大,反之则越越蓝,临床可以此对肿瘤的良、恶性做出诊断[20-21]。病灶的软硬程度可反应病灶的特性,一般恶性病灶的组织较硬,而良性病灶较软,且组织的硬度会随肿瘤的发展及恶变程度而增大,所以可通过不同大小的杨氏模量值判断肿瘤的病理程度[22]。本研究中,直肠癌病灶、周围脂肪及直肠壁的Emax、Emean值均高于非直肠癌,且TNM 分期越晚,Emax、Emean值越高。但SWE 也易受肿瘤大小、病理分级、位置深浅等因素影响,良、恶性肿瘤间弹性图像有重叠,也容易造成误诊。因此针对直肠肿瘤类重大性疾病,建议采用联合诊断的方式,以确保诊断准确率。
综上所述,TRUS 结合SWE 诊断直肠癌及TNM分期的准确率较高,可为临床病变鉴别及病理程度提供一定的参考依据。但由于目前国内外采用TRUS 联合SWE 诊断直肠癌的相关研究还较少,本研究也存在样本量小、样本来源单一等局限,故今后还需扩大样本量,进行前瞻性、多中心的试验进一步丰富研究数据。

