未足月胎膜早破羊水残余量对炎症因子水平及围生期结局的影响*
刘芳,许云波
(1.湖北省妇幼保健院 产科,湖北 武汉430070;2.鄂东医疗集团黄石市妇幼保健院新生儿科,湖北 黄石435000)
未足月胎膜早破是一种妊娠期常见疾病,是产妇孕周未达37 周而胎膜出现自然破裂[1]。胎膜破裂可导致羊水量减少,而羊水可为胎儿生长发育提供必须的宫内环境,羊水量是评估胎儿健康状态的一个重要指标,羊水指数(AFI)≤50 mm 时,则为羊水过少[2]。当羊水过少时可能导致脐带受到压迫,增加难产风险,并提高宫内感染、产褥感染、胎儿窘迫及羊水污染等多种并发症风险,对母婴结局造成不利影响,威胁母婴安全[3]。因此,羊水残余量对未足月胎膜早破产妇来说具有重要意义。本研究纳入湖北省妇幼保健院就诊的未足月胎膜早破产妇,探讨未足月胎膜早破羊水残余量对炎症因子水平及围生期结局的影响。
1 资料与方法
1.1 一般资料
选取2018年3月—2019年2月于湖北省妇幼保健院就诊的160 例未足月胎膜早破产妇。根据AFI将产妇分为对照组(AFI> 50 mm)和研究组(AFI≤50 mm),分别有110 例和50 例。纳入标准:①符合2015年版《胎膜早破的诊断与处理指南》[4]中关于胎膜早破的诊断标准;②单胎妊娠;③胎膜早破孕周在28~36 周;④孕期羊水正常无异常病史。排除标准:①多胎妊娠;②胎位异常;③胎儿畸形或死胎;④合并高血压、糖尿病等严重疾病;⑤入院已临产;⑥明确剖宫产指征(骨盆狭窄或畸形、相对性头盆不称、疤痕子宫、子痫、重度子痫前期、先兆子宫破裂、胎位异常等)。对照组产妇年龄22~38 岁,平均(28.49±4.22)岁;妊娠次数1~5 次,平均(2.96±1.29)次;分娩次数0~3次,平均(1.82±0.41)次;分娩孕周29~36 周,平均(34.06±1.65)周。研究组产妇年龄23~38 岁,平均(28.67±4.18)岁;妊娠次数1~5 次,平均(3.01±1.23)次;分娩次数0~3 次,平均(1.87±0.44)次;分娩孕周30~36 周,平均(33.92±1.57)周。产妇均事先知情并自愿签署同意书。两组产妇一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
产妇均给予相同的治疗方法,即入院后卧床静养,对产妇胎动情况、羊水性状进行密切观察,每日对胎心进行监测。胎膜早破时给予抗菌药物预防感染,给予抑制宫缩,根据情况终止妊娠,科学选择分娩方式。
1.3 观察指标
比较两组产妇破膜到分娩的时间、分娩方式(阴道分娩、剖宫产及阴道助产)。比较两组产妇子宫内膜炎、产褥感染、绒毛膜羊膜炎、羊水污染、发热、产后出血、白细胞或粒细胞升高(白细胞>15×109/L 或粒细胞比值> 0.9)等并发症发生率。比较两组新生儿出现胎儿窘迫、胎儿窒息、低体重初生儿、新生儿呼吸窘迫综合征等情况,并采用新生儿Apgar 评分量表评估新生儿窒息情况[5]。于分娩前采集产妇静脉血,采用酶联免疫吸附试验对降钙素原(Procalcitonin, PCT)、C 反应蛋白(Creactive protein, CRP)、肿瘤坏死因子α(tumor necrosis factor- α, TNF- α)、白细胞介素6(Interleukin-6,IL-6)等炎症因子水平进行检测。
1.4 统计学方法
数据分析采用SPSS 24.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验,计数资料以率(%)表示,比较用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组分娩情况比较
研究组破膜到分娩时间为(75.57±12.72)h,对照组为(128.48±21.42)h,经t检验,差异有统计学意义(t=16.200,P=0.000),研究组较对照组低。两组阴道分娩、剖宫产比较,差异有统计学意义(P<0.05),研究组阴道分娩较对照组低,剖宫产较对照组高。见表1。

表1 两组分娩情况比较 例(%)
2.2 两组并发症比较
两组子宫内膜炎、产褥感染、绒毛膜羊膜炎及羊水污染发生率比较,差异有统计学意义(P<0.05),研究组较对照组高。两组发热、产后出血、白细胞或粒细胞升高发生率比较,差异无统计学意义(P>0.05)。见表2。
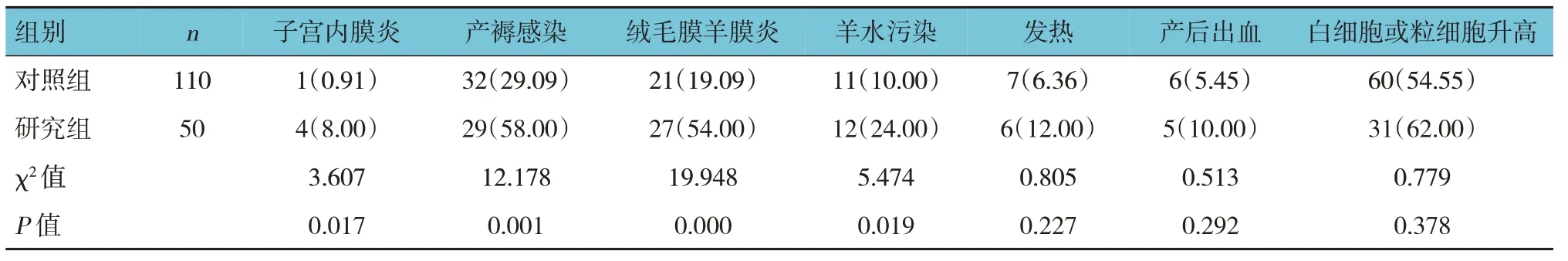
表2 两组并发症比较 例(%)
2.3 两组新生儿情况比较
研究组新生儿Apgar 评分为(8.29±1.54)分,对照组为(9.25±1.70)分,经t检验,差异有统计学意义(t=3.407,P=0.001),研究组较低。两组胎儿窘迫、新生儿窒息、低体重出生儿、新生儿呼吸窘迫综合征发生率比较,差异有统计学意义(P<0.05),研究组较对照组高。见表3。
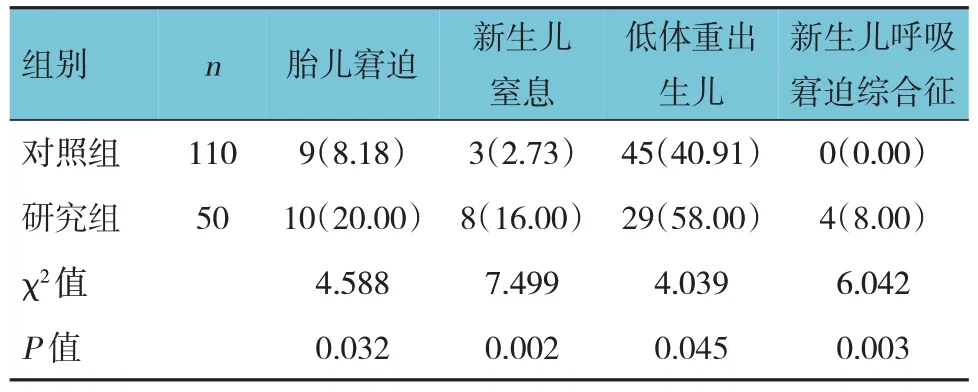
表3 两组新生儿情况比较 例(%)
2.4 两组炎症因子水平比较
两组炎症因子水平比较,差异有统计学意义(P<0.05),研究组较对照组高。见表4。
表4 两组炎症因子水平比较 (±s)

表4 两组炎症因子水平比较 (±s)
组别n PCT/(μg/L)CRP/(mg/L)TNF-α/(μg/L)IL-6/(μg/L)对照组研究组t 值P 值110 50 8.49±2.48 11.38±3.34 6.105 0.000 12.27±3.51 14.46±3.99 3.503 0.001 21.40±9.20 26.03±8.77 2.993 0.003 6.95±1.36 8.01±2.47 3.492 0.001
3 讨论
据相关调查显示,我国未足月胎膜早破的发病率不足5%[6]。未足月胎膜早破可引发产妇子宫内感染、产褥感染风险,进而导致胎儿窘迫、新生儿窒息、新生儿呼吸窘迫综合征等多种并发症。未足月胎膜早破导致羊水流失,羊水量不足,可对胎儿的生长发育造成不利影响,引发早产,并增加难产风险,严重威胁母婴结局[7]。多数未足月胎膜早破产妇羊水残留量可维持在一定水平,但部分产妇由于自身因素、胎位异常、药物影响等原因,出现残余羊水不足现象,可影响胎儿的吞咽、呼吸及排泄功能,增加母婴患病率[8]。因此,积极探讨残余羊水量与未足月胎膜早破产妇妊娠结局的相关性具有重要意义。
本研究中研究组破膜到分娩时间较对照组短,阴道分娩比例较对照组低,子宫内膜炎、产褥感染、绒毛膜羊膜炎、羊水污染、新生儿窘迫、胎儿窒息、低体重出生儿及新生儿呼吸窘迫综合征发生率均较对照组高,可见残余羊水量过少可提高未足月胎膜早破产妇及新生儿并发症的发生率,影响分娩方式及结局,危及母婴健康。原因在于充足的羊水可保护脐带,避免胎儿胸壁受到机械压力,进而促使其肺、呼吸道正常发育。当胎盘破裂后,在短时间内羊水量会不断流失,且羊膜腔内液体逐渐降低,产妇抵抗力下降,增加胎体粘连等并发症风险。当胎膜早破感染出现时,诸多炎症介质的存在可提高一氧化氮含量,形成亚硝酸盐,进而导致胎儿肺部发育不良[9]。而羊水量过少可减弱羊水缓冲作用,使子宫压力对胎儿产生直接作用,增加胎儿手足畸形、曲背及窒息等风险[10]。子宫壁对胎儿胸壁的压力过大,可对其肺部膨胀产生影响,诱发吸入性肺炎等疾病。此外,羊水量过少及胎膜早破均可导致胎膜屏障失效,而羊膜腔与外界环境相通,故提高羊水粪染、生殖道感染发生率[11]。
有研究发现胎膜早破及感染互为因果,故如何预防宫内感染、降低炎症反应在预防胎膜早破中尤为重要[12]。PCT是一种拷贝基因,来源于11 号染色体,多表达于肺神经内分泌细胞及甲状腺中,一般情况下机体内含有极少量的PCT,具有稳定的化学性质,但当机体受到细菌感染等刺激后,该基因表达迅速升高,并释放于血液中,故PCT 可作为细菌感染的一种敏感性指标。CRP 属于急性时相蛋白之一,多由肝脏产生,在创伤、炎症及感染后的36 h内,其水平上升至出现峰值,可提高白细胞吞噬功能,激活补体。但CRP 用于病毒感染及细菌感染的监测中特异性不高,故近年来常与PCT 联合用于炎症评价[13]。TNF-α 属于多肽调节因子,是在创伤刺激后机体最早产生的炎症介质,由巨噬细胞、中性粒细胞及肥大细胞等产生。TNF-α 低水平时可发挥炎症应答及修复组织作用,但高水平时可启动炎症反应,诱导氧化应激状态,扩大炎症反应,导致细胞凋亡、坏死。IL-6 由T 淋巴细胞分泌,可促使T淋巴细胞及B 淋巴细胞的生长及分化,发挥调节免疫功能的作用,但该水平过度升高会损伤机体免疫功能,且可诱发前列腺素,造成子宫收缩,进而提高胎膜早破等不良分娩结局的风险[14]。本研究中,研究组血清PCT、CRP、TNF-α 及IL-6 水平均较对照组高,可见过少残余羊水量可提高未足月胎膜早破产妇炎症因子水平,增加宫内感染风险。原因在于羊水量的降低,可丢失多种具有抗感染作用的细胞因子,降低机体抗感染能力,进而加重宫内感染,影响预后[15]。
综上所述,残余羊水量过少可对未足月胎膜早破产妇分娩及母婴结局造成不利影响,且会提高炎症反应水平,增加宫内感染风险,故临床应密切监测羊水残余量,以提高分娩安全性。

