极低射线下射频导管消融术治疗希氏束旁旁路69例临床分析
王鹏,沈利水,吴灵敏,郑黎晖,陈刚,牛国栋,姚焰
希氏束旁旁路(PHAP)是一种罕见的房室旁路,因其在解剖学上邻近房室传导系统,射频导管消融有损伤房室结及希氏束的可能,因此给射频导管消融带来了极大的挑战[1-3]。此外,消融PHAP还有导致冠状动脉损伤和完全性房室阻滞的风险[4]。虽然低功率射频导管消融或冷冻消融可降低房室传导系统损伤和完全性房室阻滞的发生率,但这些治疗方法的术中即刻成功率低,复发率高。有关PHAP 射频导管消融术后复发人群的再次消融疗效尚缺乏较大样本的临床研究。通过三维标测系统引导,我中心开展零射线或极低射线下射频导管消融治疗PHAP,本研究的目的旨在评估极低射线下射频导管消融治疗PHAP 的安全性、有效性和长期预后。
1 资料与方法
1.1 研究对象
本研究连续性纳入2010年1月至2020年6月期间因房室折返性心动过速(AVRT)和(或)预激综合征于我院行射频导管消融治疗的PHAP 患者69例。其中58 患者在国内不同的中心进行过一次或多次电生理检查和射频导管消融的既往史。入选标准:由于显性或隐性PHAP 而反复发作AVRT 患者;符合高危标准(房室旁路前传不应期<250 ms)或可诱发AVRT 的无症状预激综合征患者。排除标准:合并晚期恶性肿瘤、严重的心功能不全及预期寿命<1年的患者。在电生理检查前收集患者的年龄、性别、种族、身高、体重、体表面积及临床表现等基线资料。
1.2 心脏电生理检查
在心脏电生理检查前至少停用抗心律失常药物5 个半衰期以上。所有患者均在局部麻醉、清醒状态下接受电生理检查。在EnSite NavX 三维标测系统(雅培公司,美国)的引导下,经右股静脉将十极可调弯冠状窦电极导管(雅培公司,美国)置于冠状静脉窦内,将固定弯四极导管(深圳惠泰医疗器械股份公司,中国)置于右心室心尖。在血管入路迂曲和解剖异常的情况下,应用X 光透视引导电极导管置入。术中心脏电生理检查使用多通道记录系统(巴德公司,美国)以100 mm/s 的纸速与心电图Ⅰ、aVF 和V1导联同步记录腔内和12 导联体表心电图。术中使用三维标测系统进行电解剖标测以减少透视时间。所有患者均由两名高年资内科医生进行电生理检查。通过心房和(或)心室的分级递增刺激及期前刺激(S1S2)诱发心动过速的发作,根据情况需要,使用异丙肾上腺素后重复上述电生理诱发试验。
1.3 希氏束旁旁路的定义
PHAP 定义为解剖上位于Koch 三角的顶端,在房室(AV)融合或心房电位最为提前的部位有希氏束电位的房室旁路。如果旁路在射频消融过程中或射频消融结束时没有希氏束电位的,则认为是前间隔旁路,这些病例不纳入研究。
1.4 射频导管消融
在三维标测系统引导下进行PHAP 的标测和消融。消融参数:使用4 mm 尖端温控双向消融导管(Safire 大弯温控导管,雅培公司,美国),经股静脉入路(右前间隔)或股动脉入路(无冠窦部位)消融,功率上限40 W,最高温度55℃。在整个过程中用多通道记录仪记录体表心电图和心内心电图。房室融合或心房/心室最早激活的部位被认为是理想的靶点。初始消融功率为10 W,逐渐滴定至20~40 W(取决于解剖位置、旁路反应、房室结传导,如果在右前间隔消融不成功,则在主动脉无冠窦进行PHAP 的标测定位和消融。如果观察到消融过程中房室传导的延迟或阻滞,或者在30 W 消融10 s 后,旁路传导没有被阻断,停止消融并重新寻找靶点。消融的终点:在注射三磷酸腺苷后出现预激波形消失,或者右心室短阵连续刺激下出现室房分离。消融后,如果心室传导仍然存在,则采用希氏束旁起搏排除旁路的逆行传导。消融成功后,观察30 min 后重复术前的各种心房和心室程序性刺激,评价射频导管消融的即刻疗效。手术时间是指从股静脉穿刺开始到手术结束时取出股静脉鞘的时间间隔。透视时间定义为整个介入过程中透视的总持续时间,辐射剂量是导管实验室的计算剂量(以mGy 为单位)。
1.5 临床随访
射频导管消融术后第1年,每3~6 个月进行一次门诊随访,术后第2年起每12 个月进行一次电话随访,获取有关室上性心动过速的复发情况及心电图记录。
1.6 统计学分析方法
采用SPSS 22.0 软件进行统计学分析。正态分布的连续变量以均数±标准差()表示,非正态分布的连续变量采用中位数(P25,P75)表示,连续变量的比较采用独立样本t检验或Mann-Whitney非参数检验。分类变量采用百分比(率)表示,分类变量的比较采用卡方检验(或Fisher 确切检验)。采用Kaplan-Meier 法计算复发事件比例。采用多变量Cox 比例危险模型评价年龄、性别、消融次数和持续时间、既往消融次数、显性/隐性旁路与复发率的关系。P<0.05 为差异有统计学意义。
2 结果
2.1 69例PHAP 患者基线资料及电生理检查(表1)
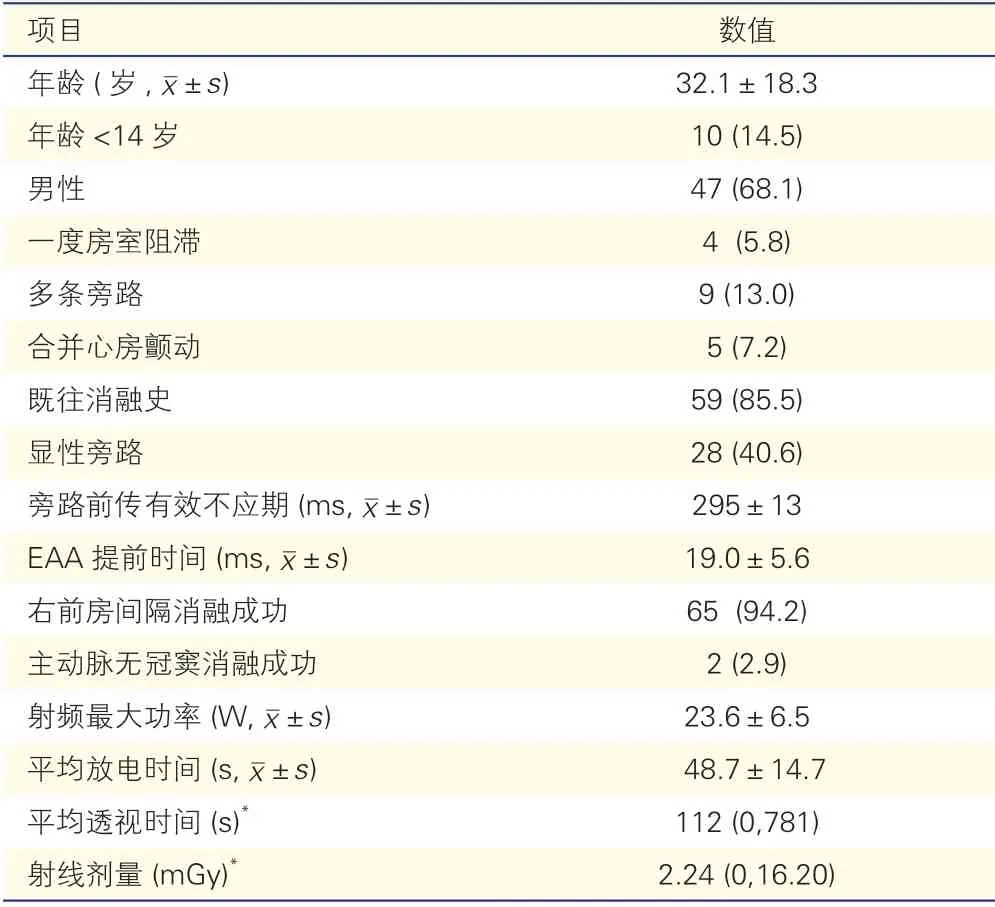
表1 69例PHAP 患者的临床特点、电生理及射频导管消融数据[例(%)]
69例PHAP 患者中,男性47例(68.1%)。年龄11~74(32.1±18.3)岁。所有患者均经右股静脉途径行心脏电生理检查和射频导管消融,其中2例在右前间隔消融无效后,改经右股动脉入路在主动脉无冠窦消融。5例患者伴有心房颤动。3例患者合并先天性心脏病(三尖瓣下移畸形1例、完全性大动脉转位1例及主动脉瓣二瓣化1例),9例患者存在2 条旁路(5例为三尖瓣环7~9 点钟方向右外侧显性旁路,2例右后间隔显性旁路,2例为左后间隔隐匿旁路)。在67例射频导管消融患者中,60例(86.9%)术中诱发顺向型AVRT,28例(40.6%)在体表心电图时可见预激波形。术中所有患者未诱发出逆向型AVRT 和房室结折返性心动过速。28例显性旁路患者的平均前向房室传导(旁路前传)有效不应期为(295±13)ms。
2.2 射频导管消融术结果
69例患者中有67例(97.1%)接受了射频导管消融治疗,其中2例患者因合并房室结传导异常而放弃消融。在67例成功消融的患者中,65例通过希氏束旁消融(此术式的手术图像见图1),另外2例在主动脉无冠窦消融成功(此术式的手术图像见图2)。平均手术时间51(20~120)min,平均最大射频功率为(23.6±6.5)W,消融的放电时间为12~60(48.1±14.7)s。5例患者出现短暂一过性房室传导延长,其中1例为短暂三度房室阻滞。消融术中10例患者出现交界性心律失常,1例术后出现完全性右束支阻滞。除1例一过性三度房室阻滞外,围术期未发现其他并发症。

图1 右前间隔途径成功消融显性希氏束旁旁路的靶点图(图中标有HIS 的阴影为希氏束位置)

图2 主动脉无冠窦途径成功消融显性希氏束旁旁路的靶点图(图中标有HIS 的阴影为希氏束位置)
2.3 X 线透视时间及剂量
中位透视时间为112(0,781)s,中位辐射剂量为2.24(0,16.20)mGy。其中,14例(20.3%)患者通过三维标测系统引导下完成了电极放置、旁路标测及消融,实现了零射线操作。55例患者因血管迂曲(16例)、冠状静脉窦电极置入困难(32例)、消融时需确保消融导管的贴靠稳定性(7例)、需要引入Swartz 鞘以提高导管稳定性(15例)以及需要检查导丝(12例)进行了低剂量的透视。与2015年12月前比较,2016年1月后患者的X 射线剂量及透视时间均显著降低(P均=0.0013,图3)。
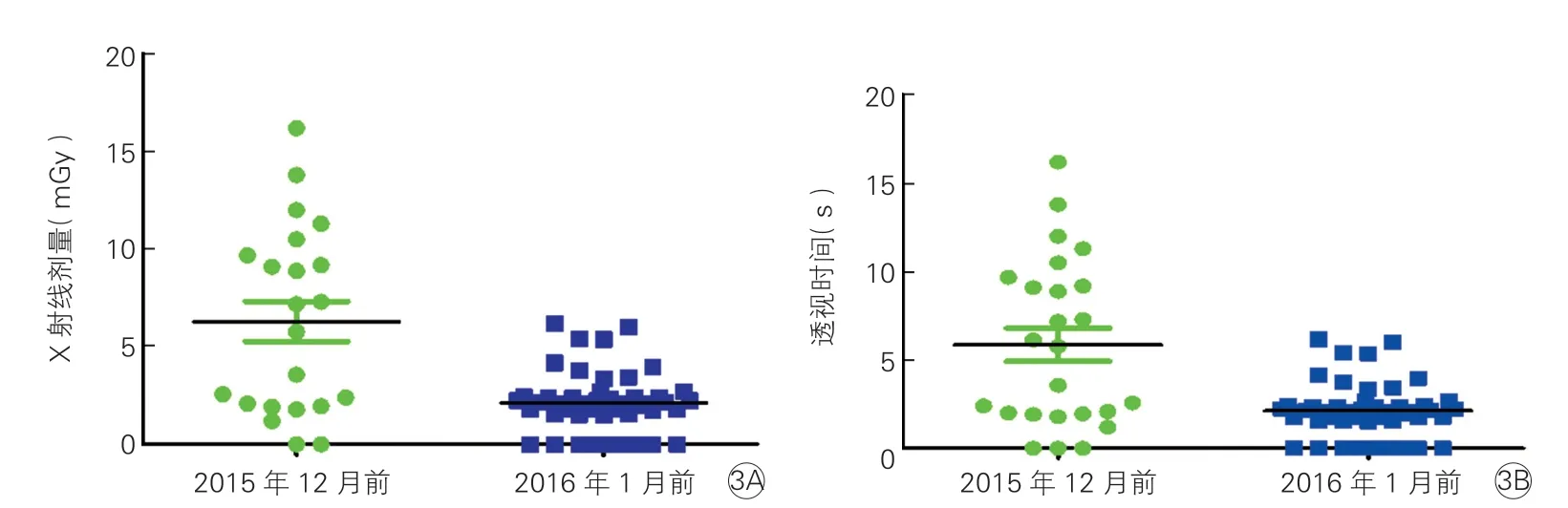
图3 2016年1月后与2015年12月前患者的X 射线剂量(3A)和透视时间(3B)的比较
2.4 长期随访结果
67例接受射频导管消融的患者中位随访时间30(12~45)个月。除2例经主动脉无冠窦消融患者在术后6 个月内复发外,其余65例患者在随访期间均无临床症状或室上性心动过速发作/心室预激发作,远期成功率97.0%。
根据多因素Cox 回归分析,年龄(HR=1.036,95%CI:0.918~1.137,P=0.327)、性 别(HR=1.314,95%CI:0.656~1.578,P=0.553)、显性/隐匿性旁路(HR=1.306,95%CI:0.689~1.625,P=0.518)、放 电时间(HR=1.027,95%CI:0.802~1.072,P=0.658)及最大射频消融功率(HR=1.05,95%CI:0.699~1.112,P=0.666)均与长期预后无关。
3 讨论
PHAP 非常罕见,占所有房室旁路的1.4%,其射频导管消融的急性成功率为85.1%~94.0%[5-7]。射频导管消融术中损伤房室传导系统导致三度房室阻滞是其重要的并发症。Haissaguerre 等[7]报道,由于房室阻滞的高风险,17%的前间隔旁路者和15%的中间隔旁路患者不能成功完成射频导管消融。Fred等[8]报道,由于旁路部位特殊(希氏束旁,心外膜区)、多条旁路、旁路斜型插入或存在结构性心脏病(如先天性心脏病)等原因,约三分之一的PHAP患者无法成功射频导管消融。Sacher 等[5]报道的大样本病例中,PHAP 和中间隔旁道的即刻消融成功率为27.3%,消融失败多因导管贴靠缺乏稳定性或因顾忌消融靶点过于接近房室结而消融不彻底所致。消融术中,如果导管稳定性不好,定位不精确,或消融能量过高或机械压迫过重,则损伤希氏束的几率很高。既往研究[7-9]曾报道股静脉途径穿刺,由于导管贴靠不稳定,会影响导管操作的同轴性及与心肌组织的有效接触。在确保安全有效的前提下,经颈静脉入路则能增加导管贴靠的稳定性,并获得较高的急性成功率。本研究发现,经股静脉途径在Swartz 鞘支撑下使用双向可调弯消融导管可有效保证导管在PHAP 靶点的稳定贴靠及精确定位,另消融时从低功率(15~20 W)起始,逐步滴定至30 W 的低功率消融也有效得保证了消融的安全性。
Liang 等[10]曾报道55例PHAP 患者,大多数(94%)经股静脉(下腔静脉)或动脉入路成功消融。本研究发现,除2例患者因术中一过性完全性房室阻滞而放弃消融外,射频导管消融PHAP 的即刻成功率为97.1%,且围术期无并发症发生。Swissa 等[11]发现,在55例接受冷冻消融治疗的儿童PHAP 患者中,复发率达14.9%。Drago 等[12]指出前间隔和PHAP 消融术后复发率为25.7%,并发现如果早期随访没有复发,长期随访中复发的风险非常低。在本研究中,有1例患者于术后5 个月复发,总体的远期成功率为97.0%。
本研究发现,与2015年12月前相比,2016年1月后的透视时间及射线剂量明显降低,或与术者操作经验及学习曲线积累相关[12-13]。X 线透视是指导心律失常射频导管消融的重要手段,在临床上得到广泛应用。然而,透视带来的辐射损伤风险具有随机性和必然性[14-15]。除放射治疗外,心血管疾病的介入治疗也是主要的辐射来源,约占所有诊疗相关辐射量的40%[16]。即使是低剂量也可对女性、儿童和年轻人造成损害。多项研究证实,非透视三维标测系统应用于指导多种快速性心律失常的射频导管消融具有较好的安全性、可行性和有效性[15-17]。2002年,Drago 等[17]报道了9例完全由Carto 标测系统引导的零透视消融术,另外12例右侧旁路患者的平均透视时间也仅为9.2±7.7(0.3~20.0)min。Giaccardi 等[18]报道的297例连续射频导管消融病例的平均透视时间仅为(14±6)s,其中26例为非透视消融,并证实极低射线透视的射频导管消融疗效不劣于传统透视指导下的消融。然而,由于标测消融PHAP 的高难度和房室阻滞的风险,极低射线下对PHAP 进行消融的研究或病例报告极为罕见,在传统透视下消融PHAP 的研究中,平均透视时间为23.0~28.5 min[11-13]。本研究是目前国内样本量较大的极低射线消融治疗PHAP 的研究之一。使用EnSite NavX 三维标测系统,能够指引标测电极,从电极插入静脉鞘起,精确重建血管和心腔的解剖结构。在确定了解剖轮廓后,三维标测可易化希氏束旁或冠状窦内的复杂和危险操作。本研究的消融病例,中位透视时间不足2 min,平均辐射剂量为低至2.24 mGy,其中14例为零射线手术。本研究报告了一次或多次射频导管消融治疗PHAP 的经验。
本研究为回顾性临床研究,存在一定的局限性,部分患者的既往电生理检查和消融数据无法完整收集。所有患者均经股静脉或动脉入路行心脏电生理检查及消融治疗。此外,没有设置传统透视引导下的消融作为对照组。
总之,在三维电生理标测系统引导下,对PHAP 进行电生理标测及射频导管消融治疗安全有效,且长期预后良好。该技术在保证安全性及有效性的前提下,可将透视时间及剂量减少到接近零水平,并有效保护患者及医务人员免于高辐射损害。
致谢:感谢雅培公司李万良工程师及王树杰工程师在标测研究中给予的帮助
利益冲突:所有作者均声明不存在利益冲突

