高脂饲料诱导肥胖SD大鼠盲肠及粪便短链脂肪酸分析
★ 姜璎娜 吉燕华 傅灵艳 张吉日木吐 聂鹏,2 徐国良,2,3 曾治君,2 刘红宁,2(.江西中医药大学中医基础理论分化发展研究中心 南昌 330004;2.江西省中医病因学重点实验室 南昌 330004;3.江西省中药药理重点实验室 南昌 330004)
现代不合理的饮食习惯引发的肥胖及代谢性疾病已经成为了全球性健康问题。由于长期机体能量摄入大于能量消耗,脂肪组织缓冲能力不足,导致多余能量无法以甘油三酯的形式储存而溢入体循环,进而机体发生高脂血症,外周和肝脏发生胰岛素抵抗最终形成2型糖尿病[1-3]。除了遗传和生活方式导致的肥胖,越来越多的学者将目光聚焦到肠道菌群,肠道菌群可以将不能消化的碳水化合物转化为可消化的能量[4-5],微生物对能量代谢的调节作用可能是便捷有效的减肥方式,肠道微生物发酵最终产物为短链脂肪酸(SCFAs),其中乙酸、丙酸和丁酸占据SCFAs含量96%以上,SCFAs含量是评价肠道微生物环境的重要指标。大量研究表明SCFAs与能量代谢有关,其中SCFAs可刺激饱腹感激素产生是其研究最深入的机制之一,SCFAs可以通过中枢神经系统及相关机制刺激瘦素产生,肠脑轴抑制食欲和能量摄入[6-8];激活棕色脂肪,上调脂质氧化基因增加能量消耗[9];其中丙酸盐和丁酸盐通过诱导肠道糖异生来预防肥胖和胰岛素抵抗[10]。
SCFAs与中长链脂肪酸相比,其碳链更短,可以快速为肠道细胞提供能量,同时由于其易挥发的特性,人们多运用气相色谱(GC)、气质联用(GC-MS)等方法进行SCFAs的检测[11],本文寻求更简便的样品前处理方法和在大规模样品中检测SCFAs的方法,首先构建气相色谱法检测SD大鼠粪便中SCFAs含量的方法学,再应用该方法检测正常和肥胖SD大鼠粪便及盲肠内容物SCFAs的含量,并对比盲肠内容物与粪便SCFAs含量的差异。
1 材料
1.1 动物3~4周龄SPF级雄性SD大鼠20只,体质量(180±10)g,购自江西中医药大学实验动物科技中心,许可证号:SCXK(赣)2018-0003,饲养于该中心屏障系统实验室[SYXK(赣)2017-0004]。
1.2 主要试剂与仪器标准品:乙酸(批号:A801294)、丙酸(批号:P816182)、丁酸(批号:B802730)均购于麦克林(上海)。仪器:气相色谱仪Agligent 7890B,配备FID检测器(安捷伦,美国);超纯水仪Millipore Milli-Q Advantage A10(默克,美国);小型台式高速冷冻离心机(赛默飞,德国)电子分析天平BT225(赛多利斯,德国);涡旋仪(赛默飞,美国)。
2 方法
2.1 分组及造模20只雄性SD大鼠适应性喂养1周后,按照体质量随机分为空白组和模型组(n=10),空白组给予普通饲料(10 %脂肪含量),模型组给予高脂饲料(60 %脂肪含量),以体重超过正常体重的15 %,Lee’s指数有显著差异视为肥胖模型造模成功。
2.2 大鼠粪便、盲肠内容物采集粪便:无菌环境佩戴一次性手套采集粪便,采集粪便样品转移至-80 ℃低温冰箱保存;盲肠内容物:剪断盲肠连接处的肠道并以剪断处为开口,将盲肠内容物直接挤出到2.0 mL的无菌冻存管内,并立刻放入液氮后转移至-80 ℃冰箱保存。
2.3 样品制备粪便(盲肠内容物)样品室温解冻,称取粪便(盲肠内容物)0.30 g± 0.05 g于2.0 mL无菌EP管中,按1∶5(W∶V)的体积加入1 500 μL的超纯水,涡旋30 s,离心4 min(5 000 rpm,25 ℃),取上清液500 μL置于新2.0 mL 无菌EP管中,加入100 μL 25 %偏磷酸溶液,涡旋30 s,离心15 min(15,000 rpm,25 ℃)过0.45 μm水系膜,取上清液置于进样小瓶用于气相色谱(Agilent 7890B)分析。
2.4 气相色谱条件仪器型号:Agilent 7890B;色谱 柱:DB-FFAP(30 m×0.25 μm×0.25 mm);进样口温度:220 ℃;载气:高纯氮气,载气流速1.0 mL/min;检测器(FID)温度:250℃;升温条件:初始温度100 ℃,每分钟升高30 ℃保持6 min;分流模式:不分流。
2.5 SCFAs标准溶液的制备
2.5.1 标准曲线的制备取乙酸、丙酸、丁酸标准品加入偏磷酸并过0.45 μm水系膜,配制成1 000 μg/mL的标准储备液,超纯水稀释为5 μg/mL,10 μg/mL,20 μg/mL,50 μg/mL,100 μg/mL,200 μg/mL,500 μg/mL,800 μg/mL 8个浓度制作成标准工作液,储存于-20 ℃备用。
2.5.2 空白基质标准曲线的制备选取空白组大鼠粪便作为空白基质加入“2.5.1”项下制备的混标(V空白基质∶ V混标=1∶1),配制成8个浓度标准工作液,为了使浓度范围更加精确,根据预实验中样品乙酸、丙酸、丁酸含量范围选取浓度梯度制成空白基质标准曲线。
2.6 SCFAs含量测定方法学考察
2.6.1 标准曲线取“2.4.1”项下配制的标准品混合工作液进入气相,测定的结果作为标准曲线拟合回归方程,横坐标为标准品浓度,纵坐标为不同浓度条件下标准品的峰面积。最低检测限(LOD)与最低定量限(LQD)一般使用信噪比(S/N)表示。国际纯粹与应用化学联合会规定,被测物的S/N=3时的浓度即为LOD;S/N=10时的浓度即为LQD。
2.6.2 基质效应基质效应指生物样品基质对于待测样品的干扰,将纯标准液标准曲线的斜率作为分母,空白基质标准曲线的斜率作为分子,计算得到基质效应。结果为100 %表示没有基质效应,大于100 %表明基质对物质的检测具有增强信号的作用,低于100 %表明基质对物质的检测具有减弱信号的作用。
2.6.3 准确度(相对回收率)准确度是指采用这种方法测定的结果,与真实值或者参考值比较后接近的程度,一般用相对回收率表示。方法:取高、中、低三个浓度的标准品加入空白基质后平行进样六次取平均值(中浓度样品选取与生物样品浓度一致,分别取其±50 %作为高低浓度,以下选取方式同此一致),代入空白基质标准曲线回算标准品浓度,其结果与真实值的比值作为其准确度。
2.6.4 日内和日内精密度实验
2.6.4.1 日内精密度实验24 h内选高、中、低三个浓度标准品连续进样6次,每个浓度配制平行三份样品作为三组,每组三个浓度,每个浓度平行进6针,取其平均值计算RSD(%)值。
2.6.4.2 日间精密度实验连续三天,选高、中、低三个浓度标准品每天连续进样6次,每个浓度配制平行三份样品作为三组,每组三个浓度,每个浓度平行进6针,取其平均值计算RSD(%)值。
2.6.5 稳定性实验稳定性实验考察待测样品的能够稳定存放的时间,考察样品于-20 ℃以及12 h -4℃/12 h -20 ℃循环在5天内的稳定性,测定于室温下进行,实验前样品平行准备三份。
2.7 统计学处理方法实验数据采用GraphPad Prism 7.0进行统计分析,数据结果均以()表示,两组之间数据采用t检验,以P<0.05为差异具有统计学意义。
3 结果
3.1 标准曲线将“2.5”项下所配制的标准工作液与空白基质工作液分别进样,将系列标准工作液进入GC分析,纯标准液气相色谱图与空白基质标准液气相色谱图如图1所示,专属性结果、线性结果如表1、2所示,两个标准曲线均显示乙酸、丙酸、丁酸基线分离度良好,出峰时间快,测样效率高,显示了良好的相关性,取信噪比S/N大于3作为方法的检测限,S/N大于10作为方法的定量限,见表3。

表1 SCFAs(标准液)的保留时间、标准曲线、线性范围
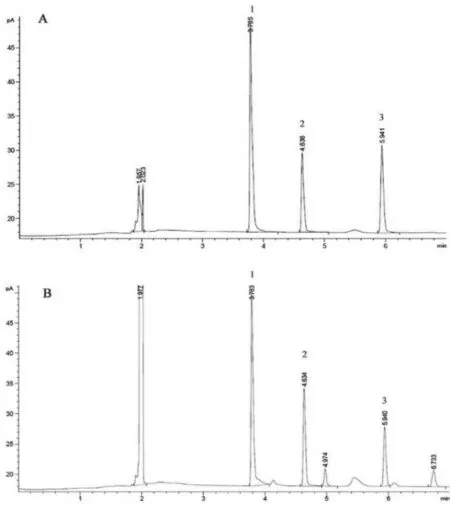
图1 气相色谱图
3.2 基质效应通过基质效应结果得出,基质对于SCFAs检测略有增强,但影响较小(106 %~111 %),见表3。

表2 SCFAs(空白基质)的保留时间、标准曲线、线性范围
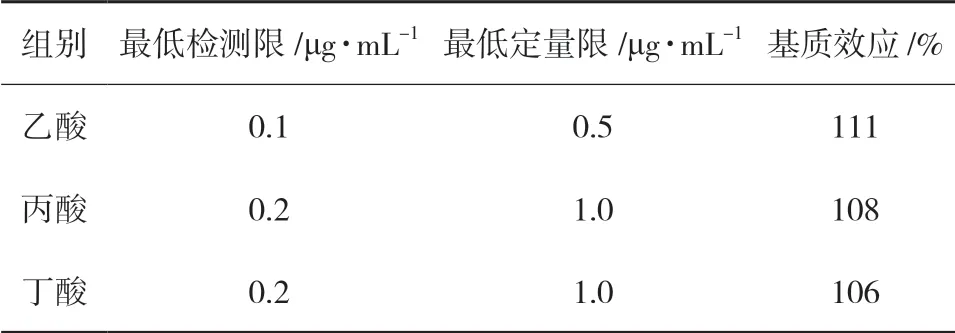
表3 SCFAs的最低检测限(LOD)、最低定量限(LOQ)和基质效应
3.3 准确度(相对回收率)、日内及日间精密度测定如表4所示,乙酸的相对回收率为104.27 %~ 111.21 %,丙酸的相对回收率为98.36 %~113.68 %,丁酸的相对回收率为95.19 %~107.00 %;SCFAs空白基质标准液的日内及日间精密度为1.94 %~ 3.68 %(n=6)和4.24 %~7.10 %(n=18),表现了较好的日间及日内精密度。

表4 SCFAs的准确度、日内、日间精密度
3.4 稳定性检测待测样品5天内在-20 ℃以及12 h -4 ℃/12 h -20 ℃循环温度下的稳定性。分别在第1、3、5天考察2种储存状态下待测样品的稳定性。-20 ℃存放条件下,3种SCFAs在5天内的RSD %均小于6 %,而循环温度下前3天中各种酸的RSD%均小于9 %,在两种储存条件下,乙酸、丙酸、丁酸储存在-20 ℃时在5天内表现出良好的稳定性,在12 h -4 ℃/12 h -20 ℃循环温度条件下在3天内表现出良好的稳定性。
3.5 大鼠粪便及盲肠内容物检测运用本文建立的方法学对空白组和模型组大鼠的粪便以及盲肠内容物进行含量测定,结果显示,与空白组相比,模型组大鼠粪便和盲肠内容物中乙酸、丙酸、丁酸含量均有显著性下降(P<0.01);两组大鼠盲肠内容物中SCFAs含量均高于粪便中SCFAs含量:盲肠内容物与其粪便结果相比,模型组中乙酸和丙酸含量显著增加(P<0.01),空白组中呈现类似结果,丙酸和丁酸含量显著增加(P<0.01、P<0.05),见图2;模型组粪便和盲肠内容物中乙酸、丙酸和丁酸含量比值分别为10∶3∶4和18∶5.5∶4,在空白组该比值分别为9∶2∶3和7.25∶2∶3.25。与空白组相比,模型组粪便丙酸/丁酸比值上升(P<0.05),与盲肠内容物中比例趋势一致(P<0.01),见表5。
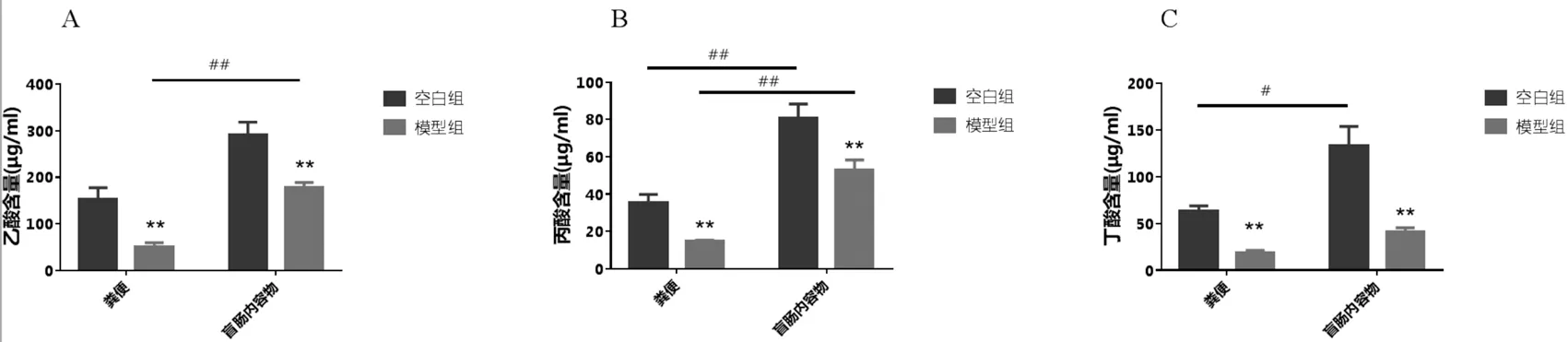
图2 大鼠粪便和盲肠内容物中短链脂肪酸含量的变化(,n=10)
表5 大鼠短链脂肪酸含量比值(,n=10)
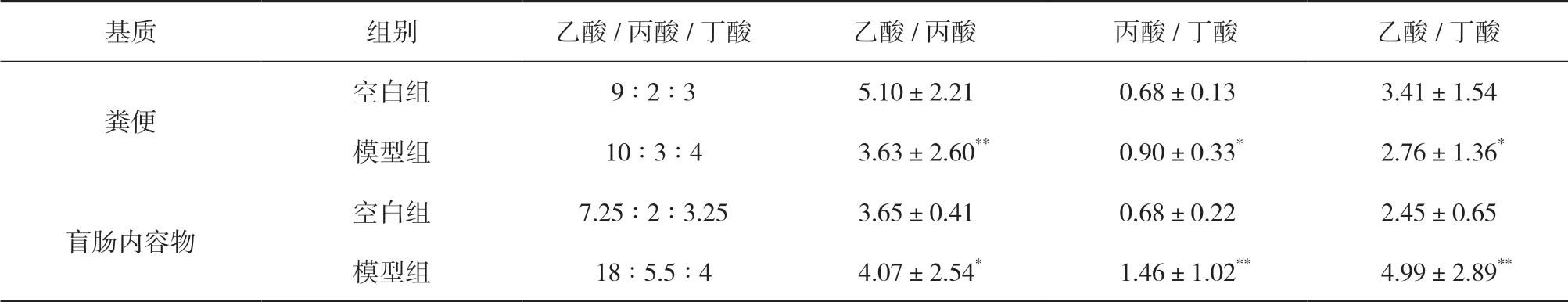
表5 大鼠短链脂肪酸含量比值(,n=10)
注:模型组与空白组比较,*P<0.05,**P<0.01。
基质 组别 乙酸/丙酸/丁酸 乙酸/丙酸 丙酸/丁酸 乙酸/丁酸粪便空白组 9∶2∶3 5.10±2.21 0.68±0.13 3.41±1.54模型组 10∶3∶4 3.63±2.60** 0.90±0.33* 2.76±1.36*空白组 7.25∶2∶3.25 3.65±0.41 0.68±0.22 2.45±0.65模型组 18∶5.5∶4 4.07±2.54* 1.46±1.02** 4.99±2.89**盲肠内容物
4 讨论
大量动物实验研究表明,SCFAs通过多种机制影响食欲和能量摄入,SCFAs在预防和治疗肥胖相关的胰岛素抵抗方面有着重要作用[12-14]。因此,建立一种快速稳定的方法学来测定SCFAs含量有助于后续研究分析及临床检测。
SCFAs样品具有挥发性强,极性大等特点,对SCFAs样品前处理的方法有水提法、高速离心法、超滤法、蒸馏法和萃取法等[15-19]。为了快速检测大规模生物样品,本文采用水提法,该处理方法操作简便,省去了衍生化的繁琐步骤,加快了处理样品时间。本研究制备了纯标准品的标准工作液和加入空白基质的标准工作液,其结果均展现出良好的线性关系,通过计算两个标准曲线斜率的比值得出基质效应,证明水提法后的基质对后续含量检测略有增强,但影响不大,同时日内、日间精密度的检测结果均显示此方法可以稳定的检测粪便以及盲肠内容物的SCFAs含量,为了确保生物样品稳定,考察了SCFAs储存在2种条件下在5天内表现出的稳定性,SCFAs在-20 ℃条件下至少可以保存5天,而12 h -4 ℃/12 h -20 ℃循环温度下可保存3天,故样品处理后建议低温保存,且不宜反复冻融。
SCFAs含量在肠道是一个动态调节的过程,其比值约为60∶20∶20[20],其中乙酸含量最高,丙酸与丁酸含量相似,这与本研究方法最后测得SCFAs含量结论一致。实验结果表明肥胖组大鼠与正常组相比SCFAs含量均下降,并且SCFAs的动态比值也发生了变化,其中丙酸与丁酸的比值上升,该比值比较有代表意义,有报道指出,丙酸与T2D风险增加有因果关系[21],而丁酸其衍生物对肠上皮细胞的正常生长发挥重要作用,此外,丁酸盐还可以作为结肠细胞的燃料来源,促进结肠癌细胞的凋亡,减少肠道炎症[22-24]。
盲肠是肠道菌群产生SCFAs主要部位之一,其位于远端小肠和结肠之间,定植足够数量并易于获得的微生物群,微生物发酵就会产生大量SCFAs[4]。相比盲肠内容物,体外粪便方便易取、无创伤,还可以及时反映大鼠生理和病理状态,但粪便样品杂质多,因此,干扰性也大。SCFAs的浓度从盲肠远端到粪便,在向下的传递过程中有明显由高到低的变化趋势[20],实验结果显示粪便与盲肠内容物中SCFAs含量确实存在差异(P<0.05),盲肠内容物中有更低的乙酸与更高的丁酸。在产生的SCFAs中,只有5 %~10 %随粪便排出[25],研究显示,产生丁酸盐的微生物群通路PWY-5022与体外粪便丁酸水平的相关性较差[21],表明体外粪便丁酸水平不能很好地反映丁酸的生成和吸收,这可能是丁酸在体外粪便中含量下降的原因之一。
综上所述,本文建立了高效稳定的气相检测短链脂肪酸方法学,并应用此方法检测了正常和肥胖SD大鼠的SCFAs含量,发现与正常大鼠相比,肥胖SD大鼠的SCFAs含量都显著降低,相应比值也发生了变化,其中丙酸/丁酸比值上升;同时也发现盲肠内容物与体外粪便SCFAs的含量与比值均存在差异,所以粪便中的SCFAs是否是微生物产生SCFAs的最佳预测因子还存在争议,但其结果可以作为肠道产SCFAs含量的参考依据。

