四溴双酚A对人体正常肝细胞毒性效应及作用机制
王晓丽,张运超,夏沪彬,陈超,刘勇弟, *
1. 华东理工大学资源与环境工程学院,上海200237 2. 华东理工大学生物工程学院,上海200237
四溴双酚A(TBBPA)是目前产量最大的溴系阻燃剂,由于其良好的阻燃、耐热性能等优点,广泛应用于生活的各个方面,如家用电器、家具、塑料和电子产品等。TBBPA可阻止或降低燃烧的速度,同时也可以防止添加的材料燃烧[1]。TBBPA可分为添加型和反应型2种类型,其中,添加型未形成新的化学键,易释放至环境中;反应型通过化学反应加入阻燃成分,以形成化学键的形式与材料结合,这种结合方式相对稳定,但是其中未聚合的TBBPA也会释放到环境中。在含有TBBPA的产品生产、使用及产品废弃之后堆放、填埋或者焚烧等处理过程中,TBBPA通过挥发、渗透等途径进入环境。TBBPA进入环境后,在不同介质之间进行迁移转化。在大气、土壤、水体沉积物及生物体中已被检出。土壤中TBBPA的污染状况已有报道。Yu和Hu[2]在垃圾填埋场附近的土壤中测得TBBPA浓度为1.4~1.8 μg·g-1(干重)。彭浩等[3]研究发现,在电子厂周围的土壤样本中TBBPA的浓度为(25.2±2.7) ng·g-1。Öberg等[4]在22处用市政废水浇灌的土壤中取116个污泥样品,测定出TBBPA的含量在220 ng·g-1范围内;清远的电子废物回收站点土壤中TBBPA污染水平极高,其浓度高达780 ng·g-1。电子废物回收站点的TBBPA浓度明显高于农田土壤,但与某些工业区土壤的污染水平相当,表明电子废物回收和工业场所是这些地区TBBPA的主要来源[5]。水环境中TBBPA的污染状况也有很多报道,Watanabe等[6]1983年在日本的Neya河的淤泥中检出了TBBPA,其含量为1.8~20 ng·g-1(干重)。Chu等[7]测定了加拿大的废水处理厂样本中TBBPA含量,其范围为2.1~28.3 ng·g-1(干重);Saint-Louis和Pelletier[8]测定了加拿大Saint Lawrence河底泥中TBBPA含量,为300 ng·g-1(干重)。在中国,除了黄河和巢湖外,其余水体中检测到的TBBPA浓度普遍<10 ng·L-1;黄河和巢湖水系TBBPA浓度较高,安徽省巢湖水样中TBBPA含量最高,远高于环境水域的全球水平[9]。大气中的TBBPA主要来源于电子产品的生产及回收。Takigami等[10]测定了在日本北海道采集的2个室内灰尘样本,其中,TBBPA含量分别为49 ng·g-1和52 ng·g-1,室内空气中的TBBPA分别为12~20 pg·m-3和8~10 pg·m-3,室外空气中分别为9.5 pg·m-3和7.1 pg·m-3。在中国贵屿的一个电子废物回收站点检测到的TBBPA的浓度平均值为82 850 pg·m-3[5]。Yu和Hu[2]测定了从中国一个办公室的计算机房内采集到的4个灰尘样品,其TBBPA含量为18.9~39.6 μg·g-1。TBBPA会对生物体造成危害。Herzke等[11]采集分析了挪威6种食肉性鸟类的鸟蛋中溴代阻燃剂的浓度水平,8个样品中都检出TBBPA且含量约为13 pg·g-1(湿重);Law等[12]测定了英国海域的68个海豚脂肪样品,其中,18个样品中检出的TBBPA浓度为6~35 ng·g-1(湿重)。最近人体内TBBPA含量的报道主要集中在母乳和血液样本。Shi等[13]调查了中国24组母乳样品和食物样品,其中,肉、蛋和水产品中TBBPA的平均含量分别为263、194和738 pg·g-1(脂重),母乳中TBBPA的含量为5 124 pg·g-1(脂重),婴儿通过母乳每日TBBPA的摄入量为320~37 240 pg·kg-1,平均为5 094 pg·kg-1(体重),成人日摄入TBBPA的平均值为256 pg·kg-1(体重),肉类产品是人类摄入TBBPA的主要来源。
TBBPA可通过皮肤接触、呼吸和进食等途径进入生物和人体内,TBBPA对生物体有很强的毒性效应,目前研究的重点是内分泌干扰性、神经毒性和生殖发育毒性等。研究表明,TBBPA在中国仓鼠卵巢细胞和蝌蚪变态过程中表现出抗甲状腺激素活性[14]。神经行为学研究表明,TBBPA急性暴露3 h会增加小鼠的运动行为,0.1 mg·kg-1和5 mg·kg-1剂量的处理组中小鼠相比对照组有更强的恐惧行为表现[15]。研究表明,当TBBPA浓度<1.5 μmol·L-1时,会使斑马鱼早熟,产卵率、孵化率和仔鱼成活率下降[16]。但是TBBPA对人体肝脏毒性的研究尚且不足,对TBBPA的人体肝毒性报道相当有限,未对其凋亡机制进行具体研究。另外,肝脏是人体主要的代谢和解毒器官,可以促进多种酶的合成进而对进入体内的外源毒性物质进行清除。探究TBBPA的肝毒性对于评价其对人体健康的毒性效应具有十分重要的意义。
在本研究中,用L02细胞作为受体模型来研究TBBPA的肝细胞毒性,并探讨细胞内活性氧(ROS)含量变化、细胞DNA损伤和细胞凋亡的变化,阐明TBBPA对L02细胞的细胞毒性作用及相关机制。进一步拓宽了TBBPA毒性研究的领域,并为相关的环境管理提供毒理学参考。
1 材料与方法(Materials and methods)
1.1 L02细胞来源
人体肝细胞HL-7702(L02)细胞系购自中国科学院的细胞库类型培养物保藏中心(上海,中国)。
1.2 L02细胞实验预处理
取对数期细胞,培养瓶中贴壁细胞密度达到70%~80%,用磷酸缓冲溶液(PBS)洗涤细胞2次,消化后加入DMEM培养基制成细胞悬液,依次接种于灭菌后的6孔板中,每孔加入2 mL,在37 ℃、5% CO2条件下培养15 h。弃上清液,用PBS洗涤细胞2次,加入含有5、10、20和40 μmol·L-1TBBPA的培养基用于胁迫实验,溶剂对照组为含0.1%二甲基亚砜(DMSO)的完全培养基,每组浓度设3个平行。在37 ℃、5% CO2下孵育48 h后,用移液枪吸出培养基,用PBS缓慢洗涤细胞2次。
1.3 L02细胞形态变化
细胞预处理同1.2部分,立即在倒置显微镜(IX71-F22RC,OLYMPUS,日本)(200×)下观察,并拍照。
1.4 L02细胞活力检测
胁迫细胞预处理同1.2部分,加入2.5、5、10、20、40、80、100和200 μmol·L-1的TBBPA进行胁迫实验,在37 ℃、5% CO2的条件下继续培养24、48和72 h。每孔加入20 μL MTT液(5 g·L-1),继续孵化4 h。弃去上清液,向每个孔里加入170 μL DMSO,在37 ℃振荡15 min,用酶标仪(Elx808,BIOTEK,美国)检测每个孔在490 nm处吸光度值(OD),并按式(1)计算细胞相对活力。
RAC=(OD浓度-OD调零)/(OD对照-OD调零)×100%
(1)
式中:RAC为细胞相对活力(%);OD浓度为实验组吸光度值;OD调零为调零组吸光度值;OD对照为对照组吸光度值。
1.5 L02细胞内氧化应激指标的测定
细胞收集和处理参照1.2部分。在37 ℃、5% CO2下孵育12 h后,对细胞进行消化并收集在离心管中,1 200 r·min-1离心5 min,弃去上清液。收集细胞并悬浮在用无血清培养液稀释的DCFH-DA中,在37 ℃细胞培养箱内孵育15 min,探针和细胞充分接触。使用流式细胞仪检测ROS,激发波长为488 nm,发射波长为525 nm。使用脂质过氧化测定试剂盒测量丙二醛(MDA)含量。将细胞收集在离心管中,离心后,弃去上清液并提取MDA。将样品在离心管中混合,在水浴中保温30 min后,进行冰浴和离心以测量532 nm和600 nm的吸光度;收集细胞并用PBS洗涤2次。分光光度计将波长调节至412 nm,测量在412 nm处30 s和150 s的吸光度(A1和A2),并制成标准曲线。最后,将样品的吸光度引入标准曲线公式,计算每0.1 g细胞样品中还原型谷胱甘肽(GSH)或氧化型谷胱甘肽(GSSG)的含量。
1.6 L02细胞内DNA损伤的测定
细胞收集和处理参照1.2部分。将细胞消化并在离心管中收集,1 200 r·min-1离心5 min,弃去上清液,PBS洗涤细胞2次。铺片、细胞进行裂解、漂洗,将载玻片置于冷却至4 ℃的碱性电泳液,解旋后电泳、加PI、盖玻片,荧光显微镜(Eclipse 80i,NIKON,日本)下观察、拍照(激发波长530 nm,观察波长>630 nm)。用CASP图像分析软件分析彗星图像,本实验采用尾部DNA百分含量(Tail DNA%)作为定量衡量彗星拖尾程度的指标。
1.7 L02细胞凋亡分析
细胞收集和处理参照1.2部分。将细胞消化并在离心管中收集,1 200 r·min-1离心5 min,消化细胞收集在离心管中,离心后弃去上清液;加入预冷PBS,重悬细胞,再次离心弃上清;分别加入5 μL的FITC-Annexin V及PI染液,室温下避光染色5~10 min,在1 h内用流式细胞仪进行检测,结果使用FACSDiva 4.1软件分析。
1.8 数据统计与分析
本实验所有数据的表达均采用平均值±标准误差的形式,数据统计分析采用的处理软件是SPSS18.0(SPSS, Chicago, IL, USA),统计分析方法是方差分析(analysis of variance, ANOVA)。绘图采用Origin 8.0软件(OriginLab, Northampton, MA, USA)。显著性水平达P<0.05和P<0.01为差异显著。
2 结果(Results)
2.1 TBBPA对细胞形态影响
TBBPA处理L02细胞48 h后其形态变化如图1所示。由图1可知,正常L02细胞数量多,边界清楚,细胞折光率良好,L02细胞形态具有良好梭形,并且边缘清晰、肝细胞明亮。TBBPA处理48 h后,与对照组相比,5 μmol·L-1剂量组中L02细胞未显示显著形态学的变化。随着TBBPA浓度的增加,L02细胞的数目慢慢减少,死亡细胞数量增多,细胞形态改变,并且大部分细胞倾向于变扁、变小和变圆。当浓度达到10 μmol·L-1时,L02细胞数量显著减少,细胞体积变小,部分细胞出现边缘模糊,甚至消失;在40 μmol·L-1剂量组暴露48 h后,细胞形态变圆,并且贴壁细胞形态趋于扁平,贴壁细胞减少,与周围的细胞脱离。细胞数量也达到最低。这表明,TBBPA对L02肝细胞具有毒性。

图1 L02细胞形态变化注:DMSO表示二甲基亚砜溶剂组。Fig. 1 Morphological changes of L02 cellsNote: DMSO means dimethyl sulfoxide solvent control.
2.2 TBBPA对细胞活力的影响
为了研究TBBPA对L02细胞活性的影响,用不同剂量的TBBPA处理L02细胞24、48和72 h后,MTT法测定细胞存活率。如图2所示,随着TBBPA剂量和胁迫时间的增加,L02细胞活力降低的程度不同。TBBPA浓度为5、10、20、40、80、100和200 μmol·L-1时,48 h暴露使细胞活力呈浓度依赖方式显著降低(P<0.05)。浓度为2.5 μmol·L-1时未发现显著的细胞死亡。当细胞暴露于5、10、20和40 μmol·L-1TBBPA 48 h后,观察到明显的细胞死亡(图2)。TBBPA将细胞活力分别降低至82.2%±1.05%、80.7%±0.63%、72.3%±0.89%和57.5%±0.79%。结果表明,TBBPA能够显著降低L02细胞活性。
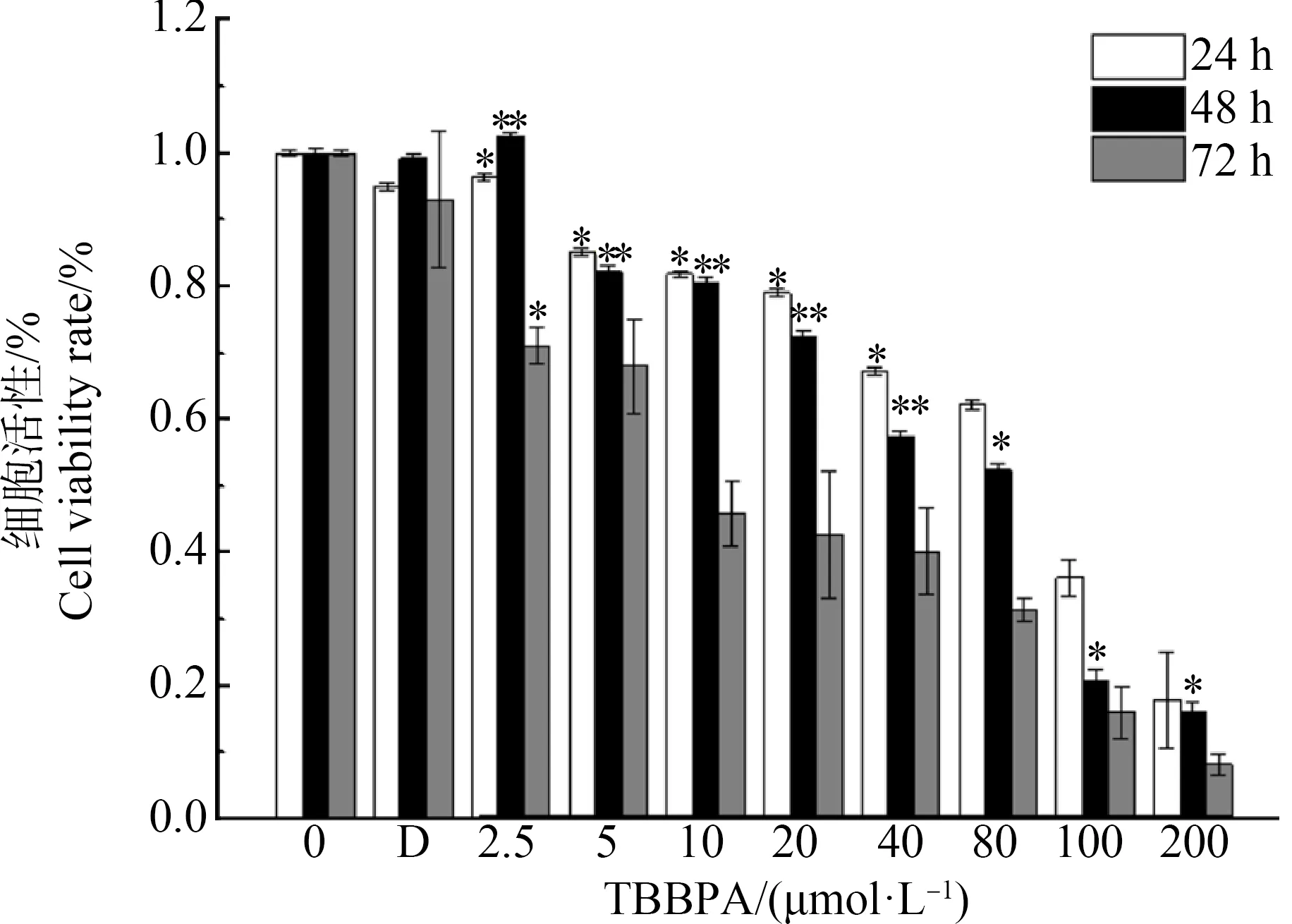
图2 2.5~200 μmol·L-1四溴双酚A(TBBPA)暴露24、48和72 h后对L02细胞增殖的影响注:数据表示为平均值±标准误差,n=6;D表示DMSO溶剂对照组;*P<0.05、**P <0.01,与DMSO对照组相比。Fig. 2 Effects of 2.5~200 μmol·L-1 tetrabromobisphenol A (TBBPA) on the proliferation of the L02 cell after 24, 48 and 72 h exposureNote: All data were expressed as mean±S.E.M, n=6; D represents DMSO solvent control; *P<0.05, **P<0.01, compared with DMSO control.
2.3 TBBPA对细胞内氧化应激的影响
在本实验中,通过荧光探针DCFH-DA检测L02细胞内的ROS水平,结果如图3所示,图3中流式图的横轴表示DCF的荧光强度,反映细胞内ROS浓度,纵轴表示对应细胞的数量。用TBBPA处理L02细胞12 h引起胞内ROS浓度呈剂量依赖性增加。如图4所示,5、10、20和40 μmol·L-1TBBPA处理组的胞内ROS浓度与DMSO对照组细胞相比,分别增加至DMSO对照组的1.26倍、1.63倍、2.51倍和3.07倍。5 μmol·L-1TBBPA暴露组中ROS含量与DMSO对照组之间没有显著性差异。20 μmol·L-1和40 μmol·L-1TBBPA暴露组中ROS含量与DMSO对照组比较差异性显著(P<0.05)。随着TBBPA剂量的增加,ROS的产量增加。高剂量的TBBPA可刺激L02细胞中产生大量的ROS,并使细胞中发生氧化应激。
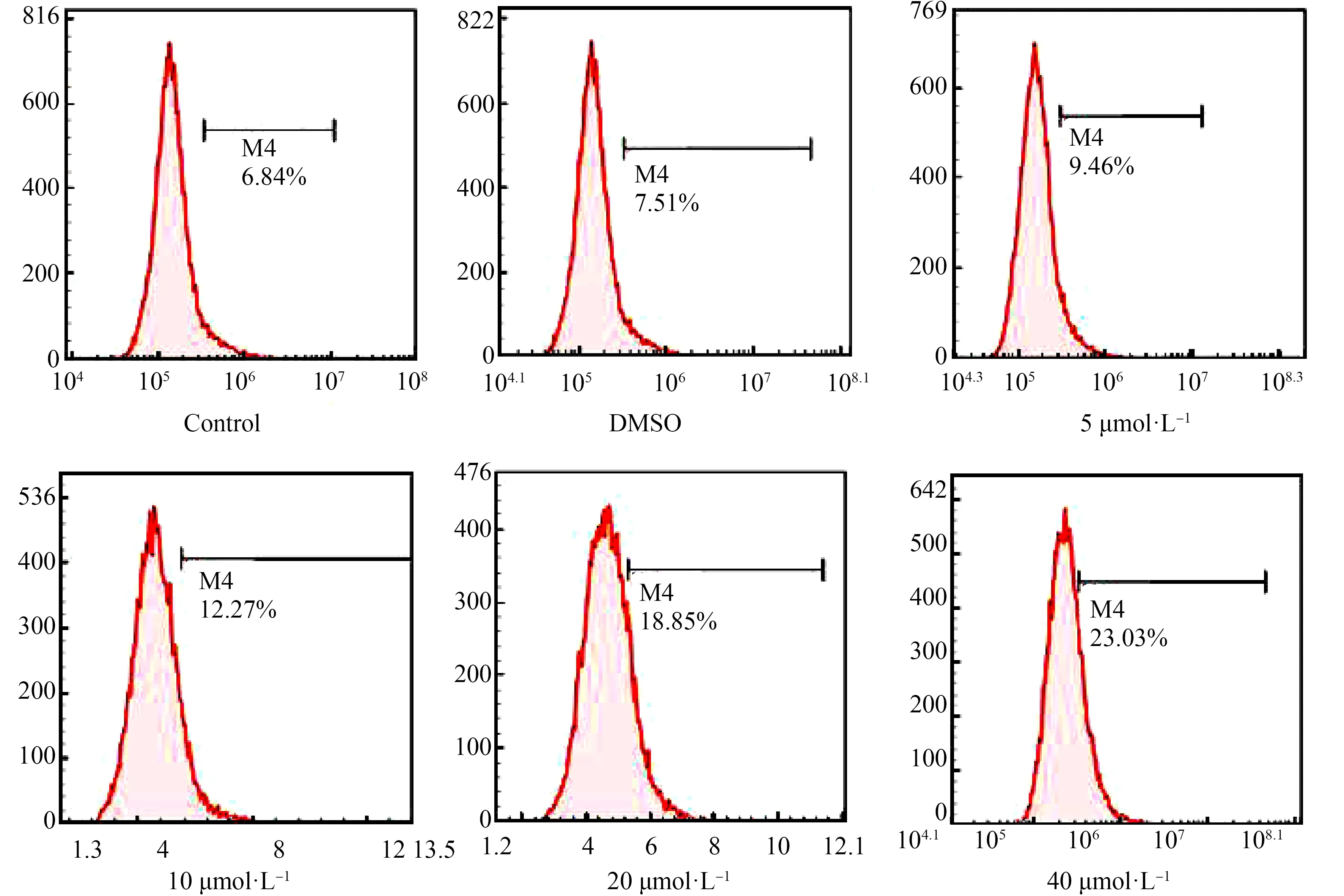
图3 流式细胞术分析L02细胞活性氧(ROS)水平Fig. 3 Analysis of reactive oxygen species (ROS) levels in L02 cells by flow cytometry

图4 TBBPA对L02细胞内的ROS水平的影响注:数据表示为平均值±标准误差,n=6;*P<0.05、**P<0.01,与DMSO对照组相比。Fig. 4 Effects of TBBPA on cellular ROS level in L02 cellsNote: All data were expressed as mean±S.E.M, n=6; *P<0.05, **P<0.01, compared with DMSO control.
如表1所示,TBBPA导致MDA含量显著增加。与DMSO对照组相比,20 μmol·L-1和40 μmol·L-1TBBPA暴露组的MDA含量增加至对照的约2.6倍和3.3倍(P<0.05)。实验结果表明,TBBPA可增加L02细胞内MDA含量,导致细胞处于氧化应激状态。如表1所示,TBBPA引起胞内抗氧化物质GSH含量降低。与DMSO对照组相比,20 μmol·L-1和40 μmol·L-1TBBPA暴露组的GSH含量降低至DMSO对照组的0.38%和0.29%(P<0.05)。这表明,TBBPA可导致L02细胞内GSH含量降低;TBBPA导致GSSG水平显著升高。与DMSO对照组相比,20 μmol·L-1和40 μmol·L-1TBBPA暴露组的GSSG含量升高为DMSO对照组的1.89倍和2.18倍(P<0.05)。这表明,TBBPA可导致L02细胞中抗氧化能力降低。

表1 L02细胞内丙二醛(MDA)、还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSH)的含量Table 1 Contents of malondialdehyde (MDA), reduced glutathione (GSH) and oxidized glutathione (GSSH) in L02 cells
2.4 TBBPA对DNA损伤的影响
DNA主要存在于细胞核的染色质中,作为基因的载体,是贮存全部遗传信息的分子[17]。选取了彗星头部和尾部DNA分布的相对含量作为参考指标来评价分析DNA损伤程度,经5、10、20和40 μmol·L-1TBBPA处理后,彗星头部DNA分布的相对含量分别为91.8%±0.25%、89.7%±0.43%、82.6%±1.09%和69.4%±3.37%(图5和图6)。尾部DNA分布的相对含量分别为8.2%±0.25%、10.3%±0.43%、17.4%±1.09%和30.6%±3.37%(图5和图6)。随着TBBPA浓度的增加,彗星头部DNA含量明显降低,尾部DNA含量增加。40 μmol·L-1TBBPA处理组细胞尾部DNA的相对量是DMSO对照组的6.5倍。这表明,随着TBBPA浓度的增加,拖尾现象愈加明显,DNA损伤程度逐渐增强。

图5 彗星实验的荧光照片(200×)Fig. 5 Photographs of Comet assay by fluorescence microscopy (200×)

图6 细胞头部和尾部DNA相对含量注:数据表示为平均值±标准误差,n=6;*P<0.05、**P<0.01,与DMSO对照组相比。Fig. 6 Relative content of DNA in the head and tail of cellsNote: All data were expressed as mean±S.E.M, n=6; *P<0.05, **P<0.01, compared with DMSO control.
2.5 TBBPA对细胞凋亡的影响
流式细胞术通过Annexin V/PI染色考察了TBBPA对L02细胞凋亡的影响。图7中流式图横轴表示膜联蛋白V(Annexin V)的绿色荧光强度,纵轴表示PI的红色荧光强度。Annexin V阳性且PI阴性表示是早期凋亡细胞,Annexin V阳性且PI阳性表示是晚期凋亡细胞。流式检测结果显示,TBBPA可以浓度依赖性地诱导L02细胞凋亡(P<0.05)(图8),L02细胞分别经5、10、20和40 μmol·L-1TBBPA处理48 h后细胞凋亡率分别为12.63%、15.11%、30.69%和42.88%。在处理组、空白对照组和DMSO对照组之间观察到统计学显著性(P<0.05)。如图8所示,细胞凋亡率随着TBBPA浓度的增加而增加,与DMSO对照组相比,20 μmol·L-1和40 μmol·L-1TBBPA处理组细胞凋亡率分别增加了3.2倍和4.8倍,诱导L02细胞的凋亡的效果明显。

图7 流式细胞术检测细胞凋亡Fig. 7 Representative graphs of cell apoptosis obtained from flow cytometry analysis
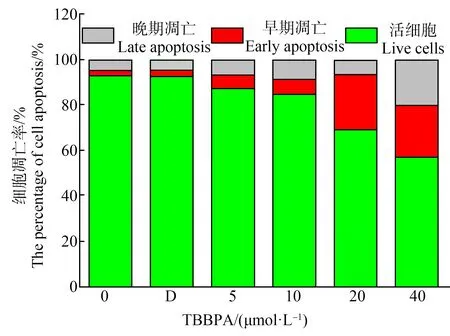
图8 TBBPA对L02细胞凋亡率的影响注:数据表示为平均值±标准误差,n=6;*P<0.05、**P<0.01,与DMSO对照组相比。Fig. 8 Effect of TBBPA on the apoptosis rate of L02 cellsNote: All data were expressed as mean±S.E.M, n=6; *P<0.05, **P<0.01, compared with DMSO control.
3 讨论(Discussion)
肝脏是人体主要的代谢和解毒器官,可以促进多种酶的合成,对进入体内的外源毒性物质进行清除。环境中的TBBPA可通过多种途径进入人体后,在肝脏中积累,增加肝脏的代谢负担并对人体肝脏造成损伤。本研究的结果显示,TBBPA抑制L02细胞增殖,与对照组比较,随着TBBPA浓度的增加,L02细胞数量明显减少,死亡细胞数量增多。细胞形态改变,细胞体积变小,突触变短,甚至消失;贴壁细胞减少,与周围的细胞脱离。MTT实验结果显示,TBBPA能不同程度地降低L02细胞的活性,对L02细胞有致毒性,TBBPA可以浓度依赖性地诱导L02细胞凋亡。Tada等[18]的研究表明,TBBPA处理组小鼠的肝细胞凋亡率明显高于对照组。Nakagawa等[19]研究了TBBPA对原代大鼠肝细胞毒性,发现TBBPA可以诱导细胞凋亡进而造成肝功能损伤。
TBBPA暴露可诱导大鼠小脑颗粒细胞[20]和大鼠胰腺细胞凋亡[21]。Grasselli等[22]发现TBBPA会影响田鼠肝癌细胞的基因表达异常和细胞凋亡;Wikoff和Birnbaum[23]认为是TBBPA通过诱导细胞内产生氧化应激造成细胞凋亡对肝脏产生毒性作用,研究氧化应激机制对于研究的细胞凋亡调控具有非常重要的理论意义。向明灯等[24]结果显示,随着TBBPA处理浓度增加,HepG2细胞存活率下降,凋亡率增加。以上结果均说明TBBPA对肝细胞有毒性效应。
肝细胞代谢时会产生ROS[25]。在正常的生理条件下,细胞内产生和消除的ROS处于平衡状态,以维持细胞的氧化还原稳定。当细胞受到外界环境刺激时ROS会过量产生,引起细胞内ROS的积累[26]。脂质过氧化反应是细胞内氧化损伤的一个重要指标,MDA是脂质过氧化反应的代谢产物,其含量可以间接反映细胞内氧化损伤的程度,如果细胞内MDA含量增加,则表明细胞ROS过多而造成氧化攻击[27]。TBBPA可以引起L02细胞中MDA含量增加,细胞处于氧化应激状态。当细胞处于氧化应激状态时,细胞内氧化还原状态不平衡,细胞自发产生抗氧化酶以维持氧化还原平衡。GSH是体内的重要的抗氧化剂,负责去除多余的ROS。GSSG为GSH的氧化形式,在氧化剂作用下GSH通过谷胱甘肽过氧化物酶被氧化成GSSG,调节细胞内氧化还原平衡状态[28]。GSSG/GSH是体内主要的内源性氧化还原调节剂。细胞内GSH水平与细胞凋亡密切相关,过度消耗GSH可引发细胞凋亡[29]。在正常生理条件下,GSSG/GSH的比例保持在一定水平,而在氧化应激下,GSH被氧化成GSSG,导致GSSG/GSH比率上升。因此,GSSG/GSH可用于评估细胞内氧化应激水平。本研究结果显示,随着TBBPA浓度的增加,GSSG/GSH比率也显著增加。这表明,细胞内氧化还原稳态偏移至氧化态。
细胞内ROS大量积累而使细胞处于氧化应激状态,对细胞中的DNA分子造成不同程度的氧化损伤,诱导肝细胞凋亡,对肝脏造成损伤[30]。据相关文献报道,细胞内源性产生和清除的ROS之间的不平衡导致ROS持续升高,可直接或间接造成DNA损伤,导致基因突变,激活细胞敏感信号通路[31]。Zhao等[32]的研究表明,阻燃剂暴露诱导细胞过量产生ROS,引起氧化应激和炎症反应,进而诱导细胞损伤。在本研究中,笔者发现40 μmol·L-1TBBPA处理组的胞内ROS含量显著增加,MDA和GSSG/GSH明显高于对照组和低剂量组,说明细胞处于氧化应激状态,40 μmol·L-1TBBPA处理后细胞尾部DNA相对含量增加至DMSO对照的6.5倍,细胞凋亡率比DMSO对照组增加了4.8倍。DNA损伤程度和L02细胞凋亡水平比对照组都有显著增强,这些结果表明氧化应激对DNA损伤和细胞凋亡有重要作用。
◆

