全氟辛烷磺酸(PFOS)对人骨髓间充质干细胞PPARs亚型及分化潜能的影响
郑璐,潘一帆,秦会,张疆雨,刘薇
大连理工大学环境学院,工业生态与环境工程教育部重点实验室,大连 116024
全氟辛烷磺酸(perfluorooctane sulfonate, PFOS)具有良好的热稳定性、疏水和疏油等特殊的理化性质,曾被广泛用于工业和民用领域数十年[1-2]。PFOS具有环境持久性、高生物累积性、远距离迁移性和多种毒性作用[3],在地表水、底泥和灰尘等多种环境介质以及人体中均检测到PFOS,对生态环境和人类健康造成严重威胁。因此,2009年5月斯德哥尔摩公约正式将PFOS列入持久性有机污染物名单[4]。目前环境残留是PFOS的重要暴露来源,PFOS的毒性机理研究对于其他全氟及多氟烷基化合物(per- and polyfluoroalkyl substances, PFASs)的研究具有重要参考价值。
由于PFOS与过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptors, PPARs)的天然配体脂肪酸的结构相似,使得PPARs成为其毒性作用的首要分子靶标[5],PPARs包括PPARα、PPARβ和PPARγ这3种亚型。动物实验发现PPARα是PFASs对啮齿类动物的主要靶标,是诱导肝肿瘤的重要机制,但人体PPARα的敏感性明显低于啮齿类动物[6],因此根据动物实验结果评估PFASs的健康风险具有较强的不确定性。此外,PPARs各亚型在调控细胞分化中起到不同甚至相反的作用。PPARγ为脂肪形成的主要调节剂,其表达可促进干细胞/祖细胞的成脂分化并抑制其成骨分化,从而增加细胞脂质水平并减少骨形成[7]。此外,PPARγ激活可促进破骨作用。因此PPARγ在调节骨量和骨代谢中也起到重要作用。与PPARγ相反,PPARβ作为骨转换的关键调节因子,其被激活而抑制成骨细胞介导的破骨细胞生成[8]。因此,研究PFOS与PPARs的相互作用,对于阐明其分子毒理学机制和毒性预测具有重要意义。
传统毒理学评价动物模型存在伦理学限制、种属差异和效率低等局限性,肿瘤细胞体外毒性测试体系受异常细胞周期调控等因素影响。人干细胞具有自我更新和多向分化能力,相比动物体内实验和动物细胞模型与人体健康相关性更强[9-10]。笔者前期研究发现PFOS在人骨髓间充质干细胞(human bone marrow-derived mesenchymal stem cells, hBMSCs)定向分化条件下,抑制细胞成骨分化,刺激成脂分化,与流行病学调查发现PFOS与骨密度降低以及骨质疏松症相关的结果一致,提示PFOS对hBMSCs分化的影响研究可准确有效识别该类污染物的毒性机理[11-12]。本研究采用hBMSCs成骨/成脂双向分化模型,研究PFOS暴露对PPARs各亚型的干扰,及其与干细胞成骨/成脂分化平衡的关联。研究结果可为揭示PFASs的毒性机理和分子靶标及其健康风险评价提供理论依据。
1 材料与方法(Materials and methods)
1.1 试剂材料
PFOS(C8F17KO3S)、二甲基亚砜(dimethyl sulfoxide, DMSO)、地塞米松、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine, IBMX)、吲哚美辛、茜素红S、油红O、十六烷基氯化吡啶和罗格列酮(rosiglitazone, ROSI)购自Sigma-Aldrich。重组人骨形态发生蛋白(recombinant human bone morphogenetic protein 2, BMP2)购自PeproTech。异丙醇购自天津科密欧化学试剂厂。CCK-8试剂盒购自碧云天生物。总RNA急速提取试剂盒购自上海飞捷生物技术有限公司。反转录试剂盒和SYBR荧光染料qPCR试剂盒购自北京全式金生物技术有限公司。
1.2 仪器
CO2细胞培养箱(NU-4750E,NUAIRE,美国);光学显微镜(YS100,Nikon,日本);全自动酶标仪(Infinite 200 PRO,Tecan,奥地利);高速冷冻离心机(Microfuge 20R,Beckman Coulter,美国);荧光定量PCR仪(Stepone Plus,Applied Biosystems,美国)。
1.3 细胞培养和暴露
hBMSCs、基础培养基和成骨诱导分化培养基购自赛业生物科技有限公司。细胞在37 ℃和5% CO2条件细胞箱中培养,在实验室增殖培养至第6代用于本研究。根据流行病学调查中一般人群和职业暴露人群的血液PFOS浓度设定细胞实验暴露浓度范围。例如,中国上海299名孕妇脐带血的血浆中PFOS的最高浓度为0.12 μmol·L-1[13];美国773名成年人血清中PFOS的算数平均浓度为0.36 μmol·L-1[14];在位于湖北省的中国最大的PFOS相关产品生产工厂之一,36个工人血清样本中检测到PFOS的几何平均浓度为2.58 μmol·L-1[15]。因此,本研究选择PFOS暴露浓度为0.1、1和10 μmol·L-1,具有良好的人体暴露相关性。未分化细胞经PFOS暴露7 d后,测定细胞活性和关键基因表达水平。
1.4 细胞活性测定
将hBMSCs以4 000个·孔-1的密度接种于96孔板中,每组设置3个平行。在CO2细胞培养箱中培养24 h后,换用含体积比为0.1% DMSO的溶剂对照培养基以及含PFOS的暴露培养基,每3 d更换暴露液。使用CCK-8试剂盒检测细胞活性,根据公式计算细胞活性:细胞活性=(暴露组吸光度-空白对照组吸光度)÷(溶剂对照组吸光度-空白对照吸光度)。
1.5 成骨/成脂双向诱导分化
作为成骨细胞和成脂细胞共同的祖细胞,hBMSCs的成骨和成脂分化之间相互制约抗衡,通过分化平衡维持骨骼紊态,hBMSCs双向诱导分化是一种常用的干细胞生物学模型,适合于研究外源化学物对细胞分化的影响[16-17]。本研究采用成骨/成脂双向诱导分化体系,研究PFOS对成骨成脂分化平衡的影响。采用成骨诱导因子BMP2和成脂诱导因子ROSI作为阳性对照。hBMSCs汇合度达100%以上后分别换用含0.1% DMSO、200 ng·mL-1BMP2、500 nmol·L-1ROSI或PFOS的成骨/成脂双向诱导培养基,混合培养基包含体积比为1∶1的成骨诱导培养基(赛业)和成脂诱导培养基(低糖基础培养基、10%胎牛血清、1%青链霉素、0.5 mmol·L-1IBMX、0.5 μmol·L-1地塞米松和50 μmol·L-1吲哚美辛),每3 d更换暴露液,共暴露14 d。在细胞分化第14天,分别通过钙结节形成和脂质形成表征成骨分化和成脂分化水平。用茜素红染色的方法表征钙结节形成。吸去暴露液,用磷酸盐缓冲液(phosphate buffered saline, PBS)洗涤。使用体积比为70%的乙醇固定细胞1 h后,再次用PBS洗涤,用40 mmol·L-1茜素红染液染色细胞20 min,用PBS冲洗。加入10%氯化十六烷基吡啶萃取20 min,将萃取溶液加入96孔板中,用酶标仪在584 nm检测吸光度。
用油红O染色表征脂质形成。吸去暴露液,用PBS洗涤。使用4%甲醛固定细胞30 min后,再次用PBS洗涤,用油红O染液染色细胞30 min,用PBS冲洗。加入异丙醇萃取20 min,将萃取溶液加入96孔板中,用酶标仪在584 nm检测吸光度。
1.6 实时荧光定量PCR(RT-qPCR)
将hBMSCs以8×104个·孔-1的密度接种于6孔板中,每组设置3个平行。接种48 h后将基础培养基分别更换为含0.1% DMSO的溶剂对照培养基或含PFOS的暴露培养基,每3 d更换暴露液。暴露7 d后,使用总RNA急速提取试剂盒进行RNA抽提。以总RNA为模板,使用反转录试剂盒进行反转录,反应条件为:42 ℃孵育15 min,85 ℃加热5 s。引物由上海生工合成,以cDNA为模板进行PCR反应,反应条件为:94 ℃,30 s;94 ℃,5 s;60 ℃,15 s;72 ℃,10 s。每个平行样本3个复孔进行RT-qPCR分析。以GAPDH基因为内参基因,对目的基因进行标准化,用StepOne软件进行CT值分析,用2-ΔΔCT法计算基因相对表达倍数。
1.7 基因芯片分析
细胞经0.1 μmol·L-1PFOS或0.1% DMSO连续暴露7 d后,使用TRIzol提取细胞总RNA,按照Affymetrix表达谱芯片的标准流程由上海伯豪生物公司进行微阵列测定[12]。筛选差异表达基因的标准为P<0.05且log2(表达差异倍数)>0.3。使用基因富集分析(Gene Set Enrichment Analysis, GSEA)对差异表达基因进行分析,识别PFOS影响的生物学通路。原始数据已上传至GEO数据库(GSE115836)。
1.8 统计分析
数据结果用平均值±标准误差表示,采用SPSS统计分析软件进行单因素方差分析(One-Way ANOVA)。用GSEA筛选差异表达基因和通路富集。“*、**”表示两组之间有显著性差异(P<0.05、P<0.01)。
2 结果(Results)
2.1 PFOS对hBMSCs未分化条件下PPARs各亚型mRNA表达水平的影响
在0.1~10 μmol·L-1浓度范围内,PFOS暴露7 d对细胞增殖未产生显著性影响,细胞存活率均>90%(图1)。因此,选择0.1~10 μmol·L-1作为后续研究的PFOS暴露浓度,可避免细胞毒性对机理研究的干扰。在对细胞增殖未产生显著性影响的浓度下,PFOS暴露诱导hBMSCs细胞中PPARα、PPARβ和PPARγ表达上调(图2)。在1 μmol·L-1PFOS作用下,PPAR各亚型mRNA表达上调幅度最大,分别上调至对照组的6.31倍、6.44倍和15.4倍。其中,PPARγ显著上调,由于PPARα和PPARβ误差较大,与对照组差异不显著(P>0.05)。

图1 未分化hBMSCs暴露于全氟辛烷磺酸(PFOS) 7 d后的细胞存活率Fig. 1 Cell viability of un-induced hBMSCs after 7 d of perfluorooctane sulfonate (PFOS) exposure

图2 PFOS暴露7 d对未分化hBMSCs中PPARα、PPARβ和PPARγ mRNA表达水平的影响注:与对照组相比,*P<0.05。Fig. 2 Effects of PFOS on mRNA expressions of PPARα, PPARβ, and PPARγ after 7 d of exposure in un-induced hBMSCsNote: Compared with the control, *P<0.05.
2.2 PFOS对hBMSCs分化关键调控基因mRNA表达水平的影响
ALP和Runx2均为成骨分化早期的标志性基因,经PFOS暴露7 d后,细胞ALP和Runx2的mRNA表达水平下降(图3)。PFOS在1 μmol·L-1浓度下产生的抑制作用最强,ALP和Runx2的mRNA表达水平分别下调至对照组的50.2%和67.4%,但差异不显著(P>0.05)。

图3 PFOS暴露7 d对未分化hBMSCs中ALP、RUNX2和OPG mRNA表达水平的影响注:与对照组相比,**P<0.01。Fig. 3 Effects of PFOS on mRNA expressions of ALP, RUNX2, and OPG after 7 d of exposure in un-induced hBMSCsNote: Compared with the control, **P<0.01.
与ALP和Runx2相反,PFOS暴露使OPG的mRNA表达水平升高。在0.1 μmol·L-1PFOS作用下,OPG表达水平升高至对照组的2.62倍,且差异显著(P<0.05)。
2.3 PFOS对hBMSCs成骨/成脂分化表型标志物的影响
进一步研究PFOS暴露对hBMSCs成骨/成脂分化的影响。阳性对照成骨诱导因子BMP2对钙沉积产生促进作用,但差异不显著。成脂诱导因子ROSI对脂肪滴形成产生显著的促进作用(图4和图5)。PFOS抑制钙沉积,0.1 μmol·L-1和1 μmol·L-1的PFOS表现出显著性抑制作用(图5)。同时,PFOS呈剂量依赖性促进脂质形成,在1 μmol·L-1和10 μmol·L-1浓度下,细胞脂质形成显著升高,分别升高至对照组2.1倍和2.7倍。

图4 成骨/成脂双向分化第14天用茜素染色测定钙沉积和用油红O染色测定脂肪滴注:(a)~(c)为钙结节染色,依次为溶剂对照、10 μmol·L-1 PFOS处理组和阳性对照BMP2处理组;(d)~(f)为脂肪滴染色,依次为溶剂对照、10 μmol·L-1 PFOS和阳性对照ROSI处理组。Fig. 4 Calcium deposition measured by Alizarin Red S staining and fat droplets measured by Oil Red O staining on day 14th of osteogenic/adipogenic bidirectional differentiationNote: (a)~(c) show nodule staining of solvent control, 10 μmol·L-1 PFOS treatment group and positive control BMP2 treatment group; (d)~(f) show fat drop staining of solvent control, 10 μmol·L-1 PFOS and positive control ROSI treatment group.
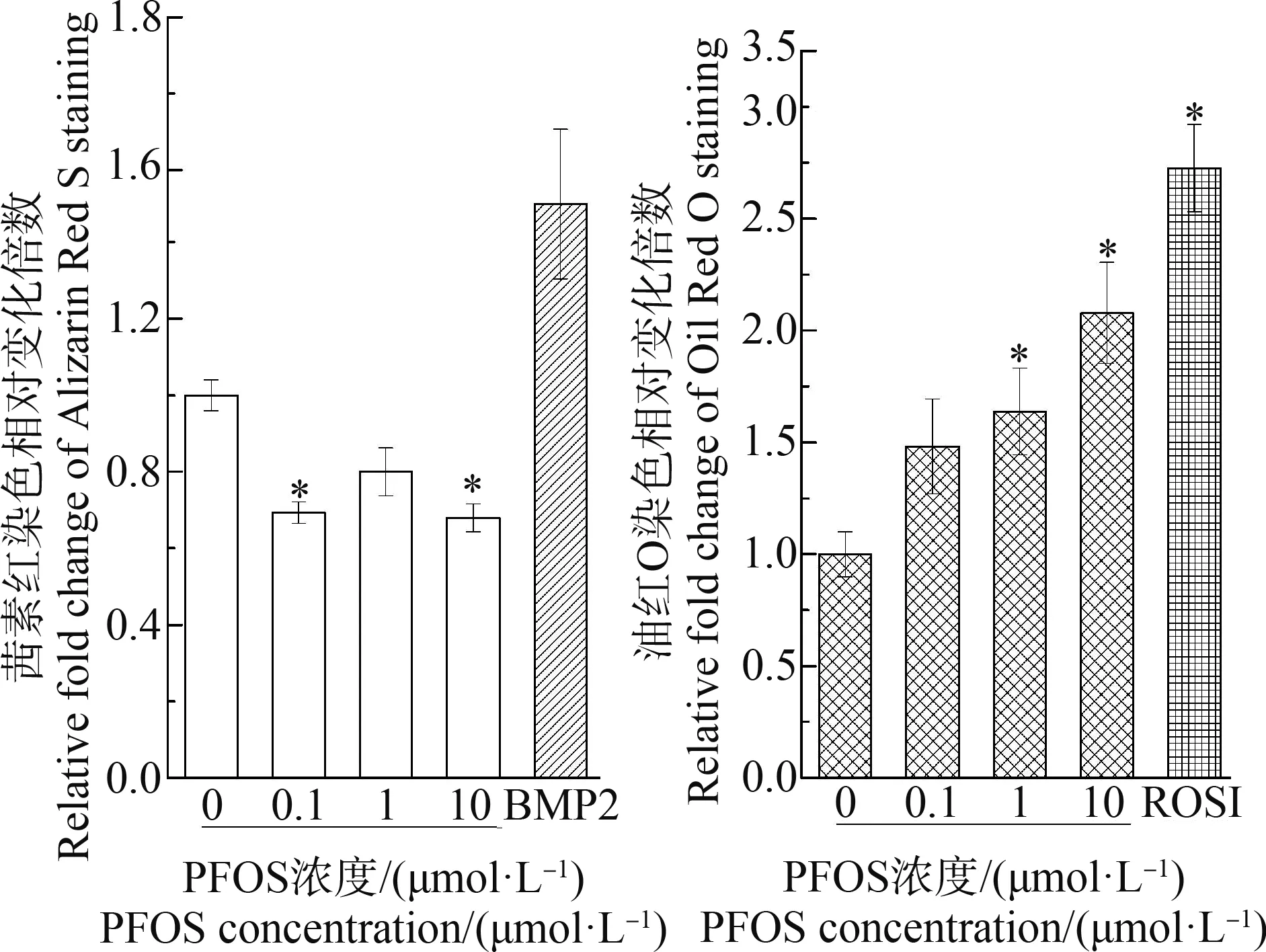
图5 诱导分化条件下PFOS暴露14 d对hBMSCs中钙结节形成和脂肪滴形成的影响注:与对照组相比,*P<0.05。Fig. 5 Effects of 14 d of exposure to PFOS on calcium nodule formation or droplet formation in hBMSCs cultured in induction mediumNote: Compared with the control, *P<0.05.
2.4 PFOS对hBMSCs基因表达谱的影响
在未分化条件下经0.1 μmol·L-1PFOS暴露7 d后,hBMSCs的基因表达谱中筛选出597个差异表达基因(P<0.05且log2(表达差异倍数)>0.3)。通过GSEA对差异基因进行通路富集分析,在表1中列出了根据P值选取受影响最显著的10个通路。其中,细胞凋亡(P=0.028)与骨质疏松症之间联系紧密,成骨细胞和破骨细胞凋亡可能与骨质疏松直接相关[18]。剪接体(P=0.106)通路相关基因异常突变可导致E/A剪接复合体功能受损,是骨髓增生异常的发病的主要机理[19]。

表1 PFOS诱导hBMSCs差异表达基因富集的生物学通路Table 1 Biological pathways enriched by the differentially expressed genes affected by PFOS in hBMSCs
3 讨论(Discussion)
尽管PPARs是PFOS的首要分子靶标,PPARs相关的PFOS毒性作用通路仍不清楚。笔者比较研究了PFOS对PPARs各亚型的干扰及其与细胞分化之间的关联,对深入理解PFOS的毒性作用机理具有重要意义。PFOS暴露诱导hBMSCs细胞PPARα、PPARβ和PPARγ表达均上调,与以往研究结果一致。动物毒理学研究表明,PFOS激活PPARα信号通路,并可诱发小鼠和大鼠肝癌[20]。Li等[21]发现,PFOS激活3T3-LI细胞中PPARs信号传导促进脂肪形成,其中PPARγ起主要作用,PPARα和PPARβ作用相对较弱,通过分子对接模拟显示PFOS直接与PPARα、PPARβ和PPARγ结合。笔者前期研究发现,hBMSCs在成脂诱导分化条件下,经0.2~100 nmol·L-1PFOS暴露7 d后,PPARγ的mRNA表达水平升高至对照组的1.05倍~1.53倍[15],上调倍数低于本研究,主要原因可能为未诱导分化条件下,无其他成脂诱导因子共同作用,PFOS对hBMSCs中PPARγ的激活作用更明显。
因为PPARs在细胞分化调控中起重要作用,因此进一步测定了PFOS暴露对细胞分化关键基因mRNA表达的干扰。Runx2表达下调与PPARγ激活一致。PPARγ和Runx2均是调节hBMSCs细胞分化的关键转录因子,在细胞分化过程中二者转录活性的调控机制密切关联,但变化趋势相反。p38MAPK介导丝氨酸磷酸化导致PPARγ失活和RUNX2激活,而蛋白磷酸化酶5通过PPARγ和Runx2蛋白的去磷酸化,激活PPARγ抑制RUNX2[7]。而OPG上调与PPARβ激活一致,主要原因可能为PPARβ的激活诱导成骨细胞中WNT-β-catenin介导的OPGmRNA表达增加[8]。OPG为骨转换关键因子,成骨细胞中OPG与RANK结合,形成调节骨代谢的OPG/RANKL/RANK通路有效抑制破骨细胞的发育,并增加骨量[22]。因此,PPARs各亚型的激活可能在调控细胞分化中产生不同的作用。
细胞分化表型标志物的分析结果表明,在双向分化条件下,PFOS暴露抑制成骨分化且促进成脂分化,与ALP和RUNX2基因表达下调一致,主要原因可能为PPARγ激活。PPARγ是成脂分化的关键正向调控因子,也是成脂/成骨分化平衡的关键因子。在骨髓中,PPARγ激活抑制Runx2介导的骨钙素在成骨细胞中的转录[22]。笔者经前期研究发现,在分别对hBMSCs进行定向成骨分化诱导和成脂分化诱导时,PFOS抑制成骨分化,促进成脂分化[15]。本研究发现,在成脂/成骨双向诱导分化模型中,PFOS干扰骨髓干细胞成骨/成脂分化平衡,进一步证明hBMSCs多向分化是PFOS暴露的敏感靶标,对于揭示其毒性作用机制具有重要价值。PFOS作用下hBMSCs基因表达谱中差异表达基因的富集分析显示,受影响通路主要涉及细胞分化、骨代谢和脂质代谢相关通路,进一步证实了PFOS对hBMSCs分化潜能的损伤,并提示骨代谢和脂代谢相关生物学过程受到干扰。PFOS激活PPARβ可能是OPG表达上调的重要机制[8],其在PFOS干扰细胞分化中的作用,仍需进一步研究。尽管OPG表达上调,但细胞成骨分化仍受到抑制,可能是因为PFOS对PPARγ的激活作用强于PPARβ。此外,PFOS暴露剂量和暴露时间也是影响细胞分化效应的重要因素。研究结果提示有必要进一步研究PFOS以及其他PFASs类化学物对PPARs各亚型的激活与hBMSCs分化紊态失衡之间的关联,有利于阐明PFASs损伤干细胞分化的毒性机理,并为该类化学品健康效应的预测和筛选提供理论依据和方法。
◆

