磷酸三(1,3-二氯-2-丙基)酯导致小鼠神经毒性结局的潜在靶点研究
朱亭,严骁,邹忠杰,王美欢,唐斌,许榕发,郑晶,*,麦碧娴,于云江
1. 中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广州 510640 2. 生态环境部华南环境科学研究所,国家环境保护环境污染健康风险评价重点实验室,广州 510655 3. 中国科学院大学,北京 100049 4. 广东药科大学中药学院,广州 510006
近年来随着各国对溴系阻燃剂的逐步禁用和淘汰,有机磷系阻燃剂(organophosphate flame retardants, OPFRs)作为替代品其生产量和使用量快速增长[1]。磷酸三(1,3-二氯-2-丙基)酯(tris(1,3-dichloro-2-propyl) phosphate, TDCPP)是目前使用量最大的OPFRs之一,被广泛用于家具、儿童塑料玩具和汽车的内饰中[1-2]。作为添加型助剂,TDCPP以非化学结合的方式添加到材料中[3],使用过程中极易释放到环境中,研究显示,在世界各地的大气、室内灰尘、饮用水和生物体样本中,以及电脑和手机等电子设备表面均检测出一定浓度的TDCPP[4-6],生活环境中的高检出率增加了人体暴露风险,TDCPP在人体尿液、血液和头发等样品中也被广泛检出[7-8]。多项研究证实,TDCPP可能具有神经毒性、生殖发育毒性、内分泌干扰毒性和致癌性等[2,9-10]。由于TDCPP与具有较强神经毒性的有机磷农药(organophosphate pesticides, OPs)氯吡硫磷(chlorpyrifos, CPF)结构相似,其潜在的神经毒性尤其值得关注。有研究发现,TDCPP能改变PC12细胞的神经元分化,从而影响神经发育[11];此外,TDCPP能下调成年斑马鱼的神经系统发育相关基因的表达以及破坏神经元功能,引起神经毒性[2];也有研究表明,TDCPP引起大鼠脑组织氧化损伤和炎症反应[12]。然而目前关于TDCPP对哺乳动物的神经毒性及其作用机制的相关研究依然很缺乏。
代谢组学是一种研究生物体液或组织中的小分子代谢物整体变化情况的组学分析方法[13]。利用代谢组学寻找生物效应标志物可以明确环境污染物对生物代谢途径的影响,为揭示毒性机制提供新思路。血液运输是生物体内物质循环的主要方式,因此血液代谢组学在机体损伤和疾病状态的生物标志物筛选上也具有独特优势。目前,已有不少研究利用血液代谢组学探讨神经功能改变或帕金森病(Parkinson’s disease, PD)[14]、阿尔茨海默症(Alzheimer’s disease, AD)[15]和重度抑郁症(major depressive disorder, MDD)[16]等神经疾病的发生和发展机制。此外,也有研究通过血液代谢组学探讨空气污染与中枢神经系统疾病发生之间的关联[17]。
本研究使用基于1H-NMR的代谢组学技术结合脑组织神经因子基因表达量分析了TDCPP对小鼠神经系统的潜在毒性作用,筛选早期毒性标志物,为TDCPP的污染防治和毒性风险评价提供基础数据。
1 材料与方法(Materials and methods)
1.1 实验试剂与仪器
TDCPP(纯度>95%,J&K Scientific百灵威科技,中国);SV Total RNA Isolation Kit试剂盒(Promega公司,美国);PrimeScriptTMRT reagent Kit、SYBR®Premix Ex TaqTMKit试剂盒购自日本Takara公司;5-羟色胺(5-hydroxytryptamine, 5-HT)、乙酰胆碱酯酶(acetylcholinesterase, AChE)试剂盒购自中国南京建成生物工程研究所;氘水(D2O)、Na2HPO4、NaH2PO4购自美国Sigma公司。
NanoDrop One微量核酸蛋白分析仪(Thermo Fisher Scientific公司,美国);Step One Plus实时荧光定量PCR仪(Applied Biosystems公司,美国);高速冷冻离心机5424R(Eppendorf公司,德国);SpectraMax i3x酶标仪(Molecular Devices公司,奥地利)。AVANCE Ⅲ 500 MHz全数字化超导核磁共振谱仪(Bruker公司,瑞士)。
1.2 实验动物分组、染毒及样品采集
4周龄SPF级雄性C57BL/6小鼠16只,体质量15~18 g,购自北京维通利华实验动物技术有限公司,饲养于中国科学院广州生物医药与健康研究院SPF级动物房中,保持12 h/12 h的日/夜光照循环,室内温度20~24 ℃,湿度40%~60%,实验动物自由饮水和摄食。将小鼠随机分为溶剂对照组(给予等体积的玉米油)和TDCPP染毒组(300 mg·kg-1·d-1),每组8只。染毒方式为灌胃染毒,灌胃体积0.1 mL,每日灌胃1次,连续染毒35 d。每3 d准确称取并记录小鼠体质量。根据世界卫生组织(WHO)报道的雄性小鼠经口摄入TDCPP的LD50为2 670 mg·kg-1[18],本研究所选用剂量约为1/10 LD50。
末次染毒24 h后,使用3%戊巴比妥钠(0.15 mL/100 g)腹腔注射麻醉动物,待小鼠翻正反射消失且无疼痛反应后,用眼眶静脉取血法采集血液样品,全血室温静置30 min后3 500 r·min-1离心30 min,取血清置于-80 ℃冰箱保存。随后将小鼠脱颈椎处死,取全脑在冰上分离大脑皮层,称量质量后放入样品冻存管,液氮速冻后置于-80 ℃冰箱保存。
1.3 神经炎症关键基因表达的检测
将小鼠大脑皮层组织在液氮中研磨后提取总RNA,以反转录获得的cDNA为模板进行实时荧光定量PCR检测。检测的基因包括神经营养因子-3(Ntf3)、胶质细胞源性神经营养因子(GDNF)和成纤维细胞生长因子-22,-23(fgf-22、fgf-23)、诱导型一氧化氮合酶(iNOS)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-1β(IL-1β),内参基因为β-actin。设计引物序列如表1所示,采用20 μL体系,每个样本进行3次平行试验。

表1 qPCR基因引物序列Table 1 Gene primer sequences for qPCR
1.4 5-HT含量和AChE活性检测
小鼠大脑皮层中神经递质5-HT含量采用酶联免疫吸附试验(ELISA)法,AChE活性采用化学比色法,均使用南京建成试剂盒测定。
1.5 血清样品处理
小鼠血清室温解冻,混匀后取200 μL加至5 mm的NMR测试管中,再加入150 μL磷酸缓冲液(含0.2 mol·L-1Na2HPO4和0.2 mol·L-1NaH2PO4,pH 7.4)和150 μL D2O,振荡混匀,待上机测试。
1.6 1H-NMR测定及数据处理
小鼠血清样品的1H-NMR试验在500 MHz超导核磁共振谱仪上进行,实验温度为24.85℃;采用Carr-Purcell-Meibom-Gill(CPMG)脉冲序列抑制血清中蛋白质及脂蛋白较宽的共振信号,总回波时间2nτ=100 ms,弛豫延迟时间4 s,采样时间3.28 s。
采用线宽为0.3 Hz的指数窗函数进行傅里叶变换。运用软件MestReNova 6.1(Mestrelab Research S.L,Santiago de Compostela,西班牙)对所获谱图进行手动相位和基线校正后,参照乳酸的甲基共振双重峰(δ 1.33)进行定标。切除δ 4.68~5.22范围内的谱图,在δ 0.5~9.5区域按δ 0.01等间隔分段积分,对各分段积分值进行归一化处理。
1.7 统计学分析及通路分析
使用SPSS 20.0软件进行数据分析。组间差异使用单因素方差分析,P<0.05时认为在统计学上具有显著差异。归一化的代谢组学数据使用SIMCA-P 12.0(Umetrics AB,Umea,瑞典)进行基于多变量统计的模式识别分析,经Pareto标度化预处理后,进一步进行正交偏最小二乘判别分析(OPLS-DA)。根据变量重要性因子(VIP值)>1来筛选潜在特征代谢物,并进行t检验获得差异代谢物,显著性水平设为P<0.05。用MetaboAnalyst在线数据库(http: //www.Metaboanalyst.ca)对差异代谢物进行功能分析和通路定位,寻找显著影响的关键代谢通路。
2 结果(Results)
2.1 小鼠一般体征
小鼠在研究过程中体质量变化如图1所示。试验期间对照组和TDCPP染毒组小鼠体质量均呈增长趋势,两组间无显著性差异(P>0.05)。TDCPP染毒组小鼠在研究过程中未出现肉眼可见畸变或行为异常。染毒35 d后,对照组与TDCPP染毒组小鼠体质量分别为(25.55±0.61) g和(23.56±1.26) g。

图1 对照组与磷酸三(1,3-二氯-2-丙基)酯(TDCPP)染毒组小鼠体质量Fig. 1 Body mass of mice from control group and tris (1,3-dichloro-2-propyl) phosphate (TDCPP) exposed group
2.2 大脑皮层5-HT含量及AChE活性
5-HT和AChE作为大脑中调节活动的重要神经递质和神经传导的关键性酶,是神经系统功能变化的重要标志物,常用于污染物神经毒性评价[19-20]。如图2所示,经TDCPP持续染毒35 d后,TDCPP染毒组与对照组小鼠大脑皮层5-HT含量和AChE活性没有显著差异(P>0.05)。
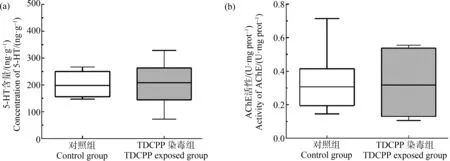
图2 小鼠大脑皮层5-HT含量和AChE活性Fig. 2 Concentration of 5-HT and activity of AChE in mice cerebral cortex
2.3 大脑皮层神经毒性相关基因表达
促炎性细胞因子TNF-α、IL-6和IL-1β,神经营养因子Ntf3、GDNF、fgf-22和fgf-23,以及一氧化氮合酶iNOS在大脑皮层中mRNA相对表达量如图3所示。研究结果显示,小鼠经TDCPP持续染毒35 d后,TNF-α、IL-6、IL-1β、iNOS和GDNF的mRNA表达量显著上调(P<0.05),其表达水平分别是对照组的1.6倍、4.1倍、2.9倍、1.3倍和2.0倍。而Ntf3的mRNA表达量显著下调(P<0.05),其表达水平仅为对照组的53%。成纤维细胞生长因子fgf-22和fgf-23的基因表达水平在对照组与TDCPP染毒组小鼠之间无显著差异(P>0.05)。
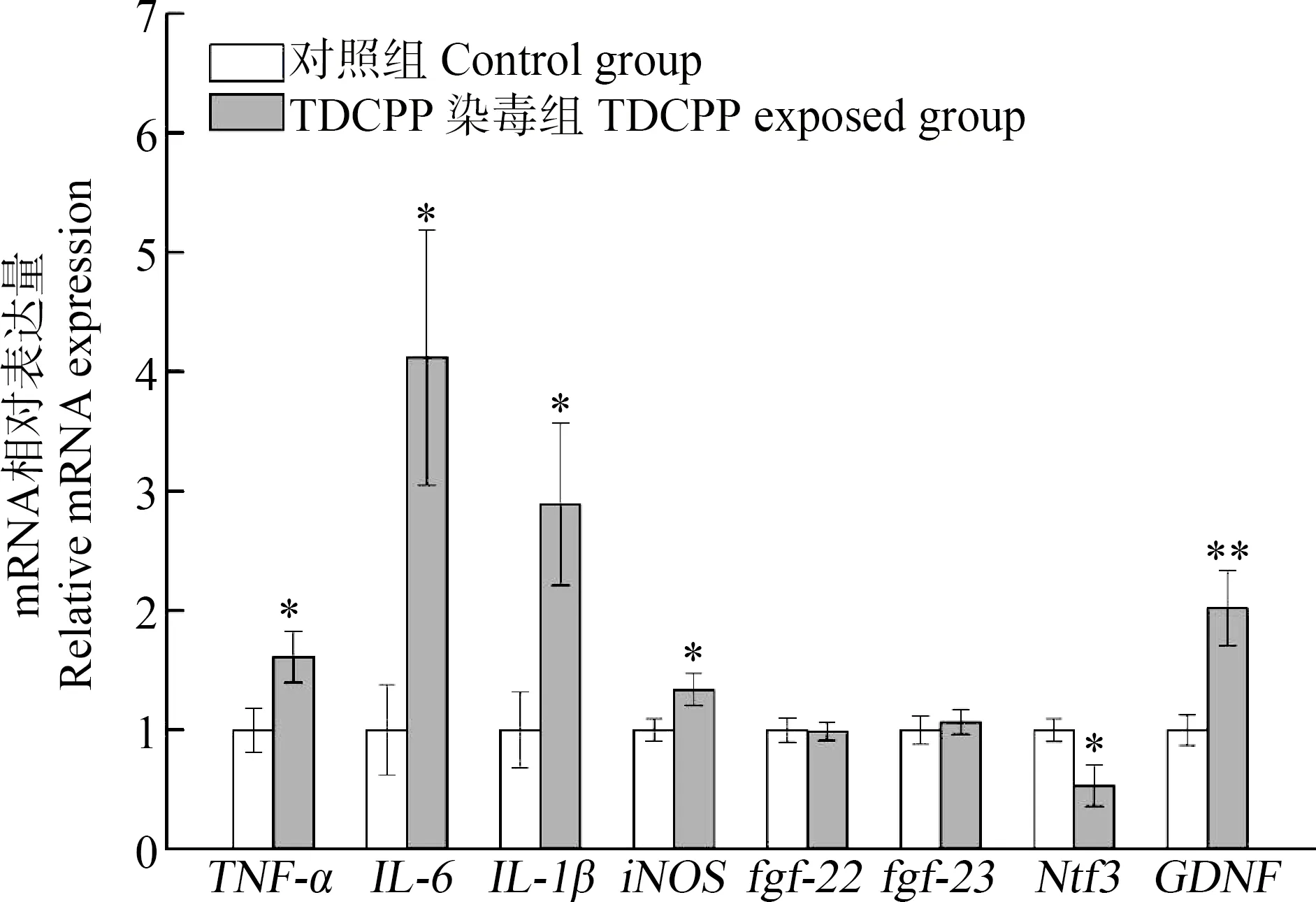
图3 小鼠大脑皮层神经毒性相关基因的相对表达量注:*P<0.05、**P<0.01,与对照组相比。Fig. 3 Relative expression of genes for nervous toxic effect in mice cerebral cortexNote: *P<0.05, ** P<0.01, compared with control group.
2.4 小鼠代谢表型的改变
采用OPLS-DA研究对照组与TDCPP染毒组小鼠的代谢物图谱差异,结果如图4(a)所示。TDCPP染毒组小鼠血清中的代谢物与对照组在PC1维度上完全区分开,表明TDCPP染毒后小鼠机体的生理状态和物质代谢发生了明显变化。同时,采用置换检验(permutation test)验证OPLS-DA模型的过拟合程度和可靠性(图4(b))。OPLS-DA的主要参数为:R2X=0.83,R2Y=0.97,Q2=0.88。模型置换得到的R2、Q2点均低于原始点,且Q2回归线与纵坐标轴的截距均小于零,说明建立的模型符合样本数据的真实情况,且如有新样本加入对原有分布情况影响不大,可以充分解释两组样本间的差异。

图4 小鼠血清1H-NMR谱的OPLS-DA得分图(a)和置换检验验证图(b)Fig. 4 OPLS-DA score plot (a) and permutation test (b) derived from 1H-NMR spectra of mice serum
2.5 TDCPP诱导的差异代谢物与代谢通路分析
采用OPLS-DA模型,筛选同时满足VIP值>1和和独立样本t检验P<0.05的代谢物作为TDCPP诱导的差异代谢物(表2)。结果显示,小鼠在TDCPP持续染毒35 d后,血清中多种代谢物水平发生显著变化,包括氨基酸、生物碱、羧酸、糖类、生长因子和脂质。进一步应用MetaboAnalyst对差异代谢物进行代谢通路分析(Pathway Analysis),结果如表3所示。在TDCPP显著影响的小鼠关键代谢通路中,3条通路与氨基酸代谢相关,2条通路与糖代谢相关。根据差异代谢通路绘制TDCPP诱导小鼠体内代谢紊乱的通路图如图5所示。

图5 TDCPP诱导小鼠代谢紊乱的代谢通路图注:红色和绿色标记分别表示TDCPP染毒后小鼠血清中上调和下调的代谢物。Fig. 5 TDCPP induced metabolic pathway disturbance in miceNote: Metabolite names marked with red and green represent up-regulated and down-regulated in mice serum after TDCPP exposure, respectively.

表2 对照组与TDCPP染毒组小鼠血清中的差异代谢物Table 2 Potential biomarkers in mice serum between control group and TDCPP exposed group

表3 与TDCPP暴露相关的关键代谢通路Table 3 Key metabolism pathways related to TDCPP exposure
3 讨论(Discussion)
广泛使用的有机磷系阻燃剂TDCPP在多种环境介质和生物体中被检出且具有较高浓度,其潜在的慢性神经毒性引起研究者们的高度关注。研究显示,TDCPP能够引起禽类步态模式和翼瓣反射等行为学异常[21],改变斑马鱼孵化率、存活率和游动速率并诱导自噬[22],并且影响大鼠的学习记忆能力和空间探索能力[12]。代谢组学是研究机体代谢产物变化的一种系统生物学方法,可通过揭示代谢产物变化规律来解释机体物质代谢途径改变。本研究利用代谢组学技术研究TDCPP对机体代谢网络的影响,并结合神经毒性指标相互验证和补充,为探索TDCPP的潜在神经毒性作用机制提供依据。
AChE是重要的中枢神经酶,作为生物标志物常用来评估环境物质的神经毒性。AChE活性受到抑制也是OPs的常见神经毒性作用机制之一。5-HT作为中枢神经递质和外周调质,参与多项重要的生理和病理过程。本研究中小鼠经300 mg·kg-1·d-1的TDCPP持续染毒35 d后,未观察到脑组织中AChE活性和5-HT含量的显著改变(P>0.05)。以往研究也获得了类似的结果,鲦鱼[23]和斑马鱼[2]经急性或慢性TDCPP暴露后,大脑中AChE活性和神经递质水平均没有显著变化。提示与CPF等OPs不同,TDCPP可能并不是典型的乙酰胆碱酯酶抑制毒物,或许其对生物体的神经毒性存在其他作用机制[2,23]。
神经炎症反应是中枢神经系统产生的抵御感染和损伤的复杂级联反应,长期的慢性炎症反应可诱发或加重重度抑郁障碍(MDD)、阿尔兹海默症(AD)、帕金森病(PD)等神经退行性疾病的病变[17,24-25]。TNF-α、IL-6和IL-1β是3类重要的促炎性细胞因子,iNOS则是一类可被促炎性细胞因子诱导产生的一氧化氮(NO)合酶,TNF-α、IL-6、IL-1β和iNOS均在慢性神经炎症发展过程中积聚,对神经元造成损伤,其在脑组织中的表达量可反映机体炎症水平和组织的损伤程度[26-27]。本研究发现,TDCPP染毒组小鼠大脑皮层中TNF-α、IL-6、IL-1β和iNOS基因表达水平显著升高(P<0.05),提示TDCPP暴露可能诱导小鼠脑组织发生炎症反应,而iNOS基因的过度表达可导致NO增加,进一步加重脑组织损伤。NTF、FGF和GDNF是3类重要的神经营养因子,在神经系统发育、减轻神经退行性病变和神经损伤的修复过程中发挥着重要作用[28]。本研究结果表明,与对照组相比,TDCPP染毒组小鼠大脑皮层中GDNF基因表达量显著升高,Ntf3基因表达量显著降低(P<0.05),fgf-22和fgf-23基因表达量无显著改变(P>0.05),提示TDCPP对神经营养因子转录水平的影响可能具有选择性。相似的神经营养因子基因表达水平的改变也在TDCPP慢性暴露的鲦鱼脑组织中被报道[23]。研究结果显示,神经炎症与神经损伤可能在TDCPP诱导的小鼠神经毒性中发挥作用。
血清代谢组学研究显示,TDCPP暴露显著干扰了小鼠的代谢过程,主要表现为氨基酸代谢、脂质代谢和糖类代谢的改变。多项代谢组学研究均证实,谷氨酸、甘氨酸、异亮氨酸等氨基酸和葡萄糖是包括MDD、PD在内的等多种神经性疾病的生物标志物,在患者血清中含量发生显著改变[29]。异亮氨酸属于支链氨基酸,对中枢神经系统内星形胶质细胞的产生具有重要作用,且与5-HT等神经递质的含量关系密切,其缺乏可能引发抑郁[30]。谷氨酸作为兴奋性中枢神经系统神经递质,过量可引发“兴奋性毒性”,导致受体过度激活和iNOS酶活性增加,破坏神经元完整性[31]。甘氨酸是中枢神经系统中谷氨酸及其N-甲基-D-天冬氨酸(NMDA)受体的抑制性神经递质和调节剂,过度积累也和抑郁症的病理生理有关[29]。肌酸是磷酸肌酸前体,磷酸肌酸作为高能磷酸化合物,能刺激突触囊泡对谷氨酸的摄取和过度释放,诱导神经毒性[32]。在本研究中,TDCPP染毒组小鼠血清中异亮氨酸显著降低,谷氨酸、甘氨酸、肌酸和β-葡萄糖显著升高(P<0.05),表明TDCPP可能通过影响氨基酸代谢中神经功能相关因子,诱导神经系统功能失调,增加神经性疾病患病风险。
Sethi等[33]研究发现,脂质、胆碱和肌醇等脂质代谢相关因子是精神分裂症患者血清中主要差异代谢物。TDCPP染毒组小鼠血清中脂质水平显著升高(P<0.05),提示脂质代谢可能受到干扰。在脂质代谢中,磷酸胆碱、鲨肌醇和甜菜碱均发挥重要作用。磷酸胆碱是细胞膜磷脂的前体并且与纹状体脂质周转相关[34],胆碱代谢的改变引起神经信号转导紊乱[29];鲨肌醇不仅能代谢脂肪和胆固醇,还能减少大脑中β-淀粉样蛋白浓度和斑块损伤,改善大脑学习障碍和认知缺陷[35];甜菜碱能通过提高脂肪分解酶的活性促进脂肪分解,并且能降低血浆中的半胱氨酸浓度,从而减轻由半胱氨酸引起的神经混乱症状如抑郁、沮丧等[36]。本研究结果中经TDCPP染毒的小鼠血清中磷酸胆碱和鲨肌醇水平显著降低(P<0.05)而甜菜碱水平显著升高(P<0.01),表明TDCPP染毒引起小鼠体内脂质代谢失衡,可能导致神经信号紊乱和障碍。
综上所述,小鼠经300 mg·kg-1·d-1的TDCPP持续染毒35 d对脑组织中AChE活性和5-HT含量无显著影响,但可引起小鼠大脑皮层中神经炎症和神经营养相关基因表达量改变,成为大脑神经炎症发生和神经元损伤的潜在诱因;同时TDCPP持续染毒显著干扰了小鼠的氨基酸代谢、糖类代谢和脂质代谢,引起异亮氨酸、谷氨酸、甘氨酸和葡萄糖等多种神经性疾病相关生物标志物的改变,进一步影响神经系统功能,增加疾病风险。
◆

