磺胺类抗生素复合污染降解菌的筛选及其降毒作用
张瑾,张博翔,周睿,卞志强
1. 安徽建筑大学环境与能源工程学院,合肥 230601 2. 大连海事大学环境科学与工程学院环境系统生物学研究所,大连 116026
抗生素(antibiotics)具有对病原微生物有明显抑制生长发育甚至杀灭的效果,主要应用在临床治疗、动物饲养等方面。我国每年人均消费抗生素量为138 g,每年约有900万t抗生素类药物被用于动物促生长添加剂、预防和治疗[1-2]。磺胺类抗生素(sulfonamides antibiotics, SAs)是一大类因其具有抗菌谱广、性质稳定、生产和价格低廉的优点而被各国大量投入到各领域使用的抗生素,主要应用在畜牧业、水产养殖业和农业等方面[3-5]。据调查表明,各国SAs的使用量:中国>韩国>英国>美国>丹麦>挪威>瑞典>肯尼亚[6-8]。然而,磺胺类药物在人体及家畜体内不易被代谢,有一部分会以原始形态或中间产物的形态随粪便和尿液排入环境中,且排入环境中的磺胺类物质或其代谢物仍具有生物活性[9]。近年来,已有关于在水体和土壤中检出SAs的报道,如陈海燕等[10]在安徽省9个地区取得76份土壤样品均检测出磺胺嘧啶、磺胺二甲嘧啶和磺胺甲恶唑等3种SAs,平均含量分别为0.26、5.41和2.58 μg·kg-1,澳大利亚昆士兰水体中同样检测出多种抗生素,如诺氟沙星和磺胺二甲嘧啶等[11-12]。此外,进入环境中的各种SAs不仅以各种形式和浓度在环境中持久共存,形成复合污染物,而且很可能会对其中的微生物产生毒性,甚至联合毒性,导致微生物活性降低,改变微生物群落结构,甚至诱导抗性基因的产生[13-14]。因此,开展SAs抗生素去除技术的研究具有重要的环境意义。
目前,关于SAs的去除方法主要有两大类,生物去除法和非生物去除法,如陈小洁等[15]利用水生植物大漂和凤眼莲对污水中的抗生素(<2.5 μg·mL-1)进行去除,发现,经过培养72 h后,大漂和凤眼莲对盐酸四环素的去除率分别达80%和90%以上,对氨苄青霉素的去除率分别达80%和70%以上。付袁芝[16]以磺胺二甲基嘧啶为唯一碳源,对活性污泥进行驯化,筛选了一株磺胺二甲基嘧啶高效降解菌YL-1,对100 mg·L-1二甲基嘧啶降解90 h的降解率高达90%。孙丰霞[17]通过延长污泥停留时间、水力停留时间优化了序列间歇式活性污泥法(SBR)去除污水中2种SAs,结果表明,2种SAs(100~300 ng·g-1)经过处理8 h后,去除率约60%。冯精兰等[18]应用Fenton高级氧化技术在最佳条件下4.52 mg·L-1的磺胺间甲氧嘧啶钠降解2 h后,降解率达到87.4%。鲍晓磊等[19]利用磁性纳米复合材料CoFeM48去除水中5种SAs,100 mg·L-1的抗生素在15 ℃条件下吸附24 h,吸附容量在68.9 μg·g-1(磺胺二甲嘧啶)至99.6 μg·g-1(磺胺甲二唑)。这些研究结果显示,非生物去除法虽然具有一定的效率,但生物去除法更加安全、经济且不易造成二次污染,可大范围使用。然而,针对生物法,目前大多数学者仅从单一污染的环境介质中筛选出高效降解菌并对其降解性能、降解机制等进行了细致研究,但对多种SAs复合污染的高效降解菌筛选及其降解性能的探究鲜有报道。
众所周知,毒性是污染物环境风险评价的重要指标之一。然而,目前国内外关于污染物的去除技术或方法,大多数考虑了污染物的量或浓度,却较少考虑污染物的毒性,而有关SAs复合污染降解菌的降毒作用的研究则更少。因此,本论文拟以广泛应用的3种SAs:磺胺吡啶(SP)、磺胺氯哒嗪(SCP)和磺胺二甲嘧啶(SM2)为研究对象,从土壤中筛选3种抗生素复合污染的降解菌,以蛋白核小球藻为指示生物,测定其降解前后的环境生物效应,并分析降解菌对SAs及其复合污染物的降毒能力,研究结果拟为SAs抗生素的去除提供方法和数据参考。
1 材料与方法(Materials and methods)
1.1 样品采集
土壤来自安徽建筑大学校园,采用蛇形取样法采集土壤下5~20 cm的土样,晾干后过2 mm筛子,四分法[20]取样备用。
1.2 试剂与仪器
蛋白核小球藻(Chlorellapyrenoidosa,C.pyrenoidosa)购自中国科学院。降解菌驯化过程培养基主要有筛选用培养基(唯一碳源培养基)和富集培养基,牛肉膏蛋白胨培养基详见参考文献[16]。C.pyrenoidosa的培养基为SE培养基,配制及其培养方法参考文献[21]。
SP、SCP和SM2均购自上海原叶生物科技有限公司,其基本理化性质如表1所示,色谱级纯度的甲酸和甲醇均购自合肥国药集团化学试剂有限公司。
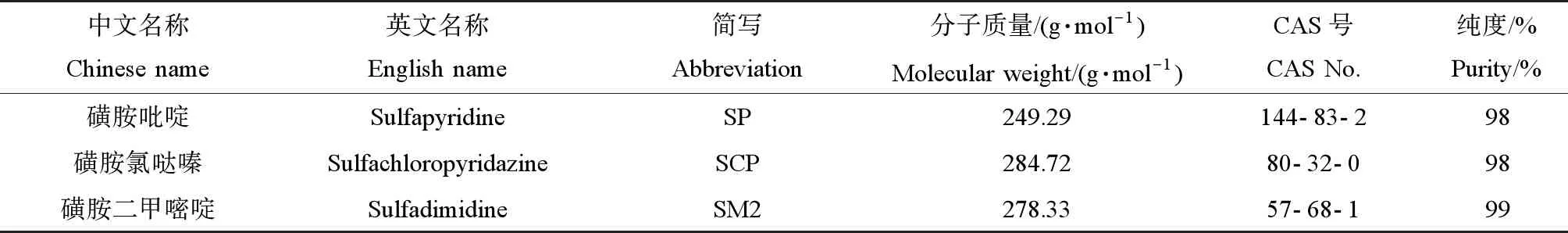
表1 3 种抗生素的基本理化性质Table 1 Basic physical and chemical properties of three antibiotics
采用高效液相色谱法(HPLC)测定SAs,分析条件:流动相为甲醇和0.1%甲酸水溶液(V(甲醇)∶V(0.1%甲酸)=60∶40),流速为1 mL·min-1,检测波长λ=270 nm,柱温40 ℃[22]。
主要仪器:Agilent 1100 series高效液相色谱(美国安捷伦),Bio-RAD 680酶标仪(美国伯乐),TU1901紫外-可见吸收光谱仪(日本岛津),NY 1483196孔平底透明聚苯乙烯微板(美国康宁),SHP-250FE智能生化培养箱(中国上海三发科学)。
1.3 3种SAs复合污染降解菌的筛选与驯化
在250 mL锥形瓶内加入100 mL筛选培养基(筛选培养基中混合3种SAs)和16 g土样,采用梯度摇瓶法(混合抗生素浓度从100 mg·L-1至1 500 mg·L-1梯度增加)[16]。每隔7 d倒掉上清液,逐步提高混合抗生素浓度。取上清液稀释后,在新鲜的培养基上进行分区划线分离,置于培养箱中,30 ℃条件下培养3 d,取出保存,并将浓度提高到最大限度时,分区划线分离得到的不同形态的单菌落,进行标记。挑取菌落,继续进行平板分区划线分离,直至得到基本一致的单菌落。
1.4 降解菌株的生长条件及降解能力的比较
将分离纯化得到的单菌落分别进行生长和降解能力的比较,将筛选出的降解菌以1%的接种量加入100、750和1 500 mg·L-13种混合抗生素富集培养基中,30 ℃、150 r·min-1的摇床中振荡培养3 d,测其OD600值和抗生素含量,分析并比较菌株的降解能力。
1.5 降解菌的鉴定
观察降解菌菌落的形状、颜色、大小、表面和边缘特征并做记录。根据《伯杰氏细菌鉴定手册(第8版)》[23],主要选择了以下指标进行实验鉴定:革兰氏染色试验、淀粉水解试验、硝酸盐还原试验、甲基红实验、蔗糖利用实验、乳糖利用实验、乙酰甲基甲醇实验、七叶灵水解实验、过氧化氢酶实验和葡萄糖发酵试验。
1.6 最佳降解菌的生长和降解条件的确定
将降解菌的菌苔接种于3种混合抗生素富集培养基中,以适当的摇床转速和温度进行培养,观察在不同的pH(5、6、7、8和9)、接种量(0.1%、0.5%、1.0%、2%和3%)、3种混合抗生素浓度(100、250、500、750、1 000、1 250和1 500 mg·L-1)条件下生长和降解的情况,确定最佳生长和降解条件。在此条件下,每隔2 h取样一次至24 h,此后,每隔4 h取样一次至36 h,再每隔12 h取样一次至72 h,测定样品菌液的OD600和3种混合抗生素含量,得到菌株的生长-降解曲线。
1.7 3种抗生素及其混合物降解前后对绿藻的毒性效应比较
以绿藻C.pyrenoidosa为受试生物,3种磺胺类抗生素SP、SCP、SM2及其混合物在降解前后对C.pyrenoidosa的毒性测定采用时间依赖微板毒性分析法(t-MTA)[21]:在96孔微板周边的36个微孔加入200 μL超纯水以防止边缘效应,在第2、6、7、11列共24个孔中加100 μL超纯水作为空白对照,3、8列的12孔中依次加入按预实验所设计的12个浓度梯度溶液100 μL,4、5列是3列的重复,9、10列是8列的重复。然后,在空白对照孔和药物处理孔中分别加入事先培养至对数期的绿藻溶液100 μL,使每个孔的液体体积均为200 μL,重复3板。将微板置于22 ℃光照培养箱中培养,分别在暴露时间为12、24、48、72和96 h时,取出,用酶标仪测定OD690,并计算毒物对蛋白核小球藻在不同暴露时间的生长抑制率(E),其计算公式具体参见参考文献[21]。
1.8 混合物的设计
3种抗生素的三元混合物设计采用均匀设计射线法(UD-Ray),共5条混合物射线,具体设计步骤参照文献[24],每条混合物射线的组分浓度比(pi)如表2所示。
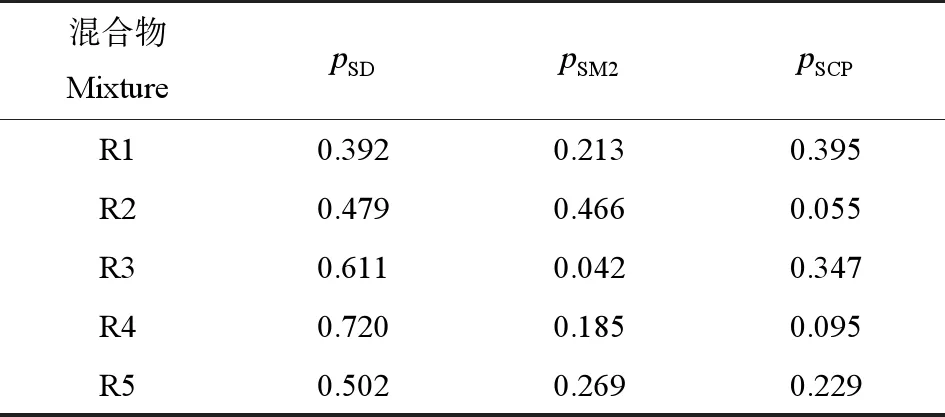
表2 三元混合物中3个磺胺类抗生素(SAs)的浓度比(pi)Table 2 Concentration ratios (pi) of three sulfonamide antibiotics (SAs) in ternary mixtures
1.9 效应数据处理与拟合
采用APTox软件[24]对SAs及其混合物的浓度-效应数据进行非线性拟合,选择常用Logit函数进行所有子集回归,采用非线性最小二乘法简化浓度-效应曲线(CRC)模型,求得CRC函数的回归参数和相关系数(r)用来评估实验数据的误差性。
2 结果(Results)
2.1 SAs降解筛选
以SP、SM2和SCP为碳源,经分离纯化后共得到2株(S1、S2)降解菌,其生长情况和对抗生素的降解能力如图1所示。由图1可知,S1菌随着3种抗生素混合浓度的升高,生长状况和降解能力均优于S2菌。S1降解菌在降解1 500 mg·L-1的混合抗生素72 h后,OD600为0.14,SP、SM2和SCP的降解率分别是53.73%、39.07%和27.93%,而S2降解菌在降解1 500 mg·L-1混合抗生素72 h后,OD600为0.12,SP、SM2和SCP的降解率分别是52.00%、40.00%和17.84%,综合比较,S1菌株生长与降解能力优于S2菌株。

图1 S1菌与S2菌在不同浓度抗生素中生长和降解能力Fig. 1 Growth and degradation ability of S1 and S2 bacteria in different concentrations of antibiotics
2.2 S1降解菌形态学特征及生理生化鉴定
针对生长状况和降解能力均较好的菌株S1降解菌,进一步做了形态及生理生化鉴定,其结果如图2所示,10项生理生化实验结果如表3所示。由图2可知,S1降解菌的菌落相对较小,形状为圆形,边缘整齐规则,菌落为乳黄色,中间部位有突起,表面湿润光滑,不易被挑起。菌液呈乳黄色,有少量沉淀物。结合表3中S1菌株的10项生理生化实验结果和《伯杰氏细菌鉴定手册(第8版)》,初步判断S1降解菌为马氏棒杆菌。
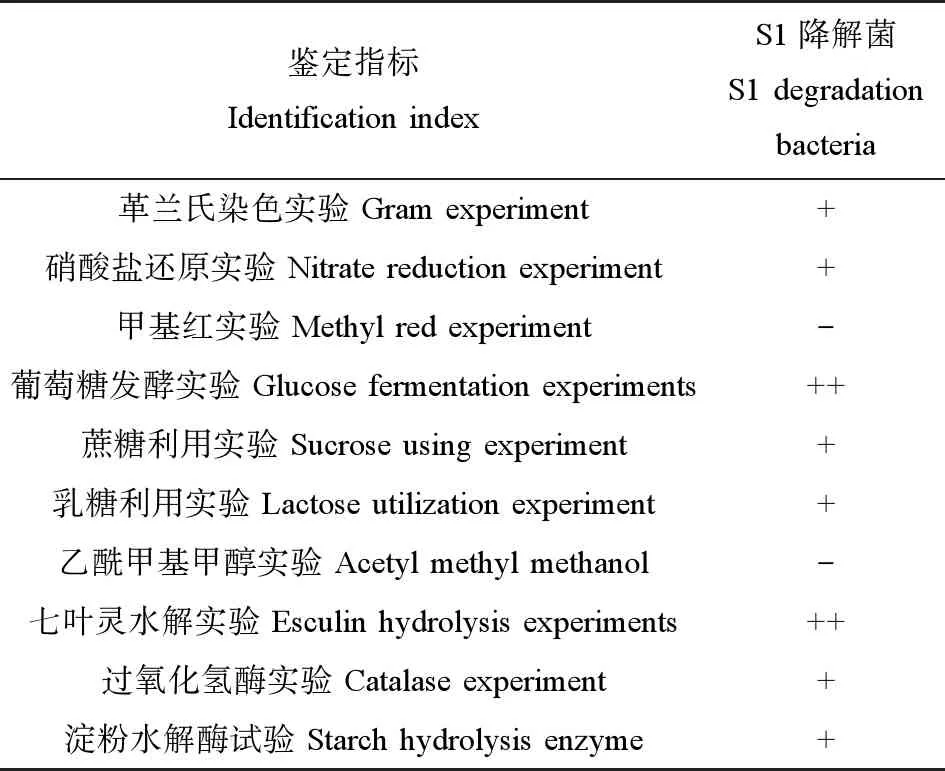
表3 S1降解菌的10项生理生化实验结果Table 3 The results of 10 physiological and biochemical experiments of S1 degradation bacteria

图2 S1降解菌形态及生理生化特征注:(a)为菌落图;(b)为革兰氏染色实验;(c)为硝酸盐还原实验;(d)为甲基红实验;(e)为葡萄糖发酵实验;(f)为蔗糖利用实验;(g)为乳糖利用实验;(h)为乙酰甲基甲醇实验;(i)为七叶灵水解实验;(j)为过氧化氢酶实验;(k)为淀粉水解酶实验。Fig. 2 Morphology and physiological and biochemical characteristics of S1 degradation bacteriaNote: (a) bacterial colony; (b) Gram experiment; (c) nitrate reduction experiment; (d) methyl red experiment; (e) glucose fermentation experiments; (f) sucrose using experiment; (g) lactose utilization experiment; (h) acetyl methyl methanol; (i) esculin hydrolysis experiments; (j) catalase experiment; (k) starch hydrolysis enzyme.
2.3 混合抗生素的浓度对S1降解菌生长和降解的影响
混合抗生素的浓度对S1降解菌生长和降解能力的影响结果如图3所示。由图3可知,从100~1 000 mg·L-1的3种混合抗生素富集培养基,随着浓度升高S1降解菌的生长OD600值也在提高,100~750 mg·L-1时菌株S1的生长增速最快,可是因为在此条件下随着碳源的量增加,能供给微生物的营养物质增多,但继续提高浓度至1 000~1 500 mg·L-1,S1降解菌的生长增速变化不大,但总体呈现上升趋势。可能是因为随着浓度升高抗生素对S1降解菌生长的抑制作用在增强[25]。随着抗生素浓度的不断增加,S1降解菌对SP、SM2和SCP的降解率也在不断上升,S1降解菌在低浓度抗生素中,对SM2降解能力最强,高浓度时对SP的降解能力最强。由此可知S1降解菌在1 500 mg·L-1中,更利于它的生长与降解。

图3 混合抗生素的浓度对S1降解菌生长和降解的影响Fig. 3 Effects of concentration of mixed antibiotics on growth and degradation of S1 degradation bacteria
2.4 pH对S1降解菌生长和降解的影响
pH对S1降解菌生长和降解能力的影响结果如图4所示。由图4可知,随着pH的升高S1降解菌的生长OD600也在不断升高且增长很明显,用肉眼可以观察到培养基中菌的浊度也在不断提高,可能是因为生长相关酶的活性逐渐提高。当pH=7时,OD600达到最大值,继续提高pH时,S1降解菌的OD600开始下降,这说明S1高效降解菌生长受到了抑制。由此可知,在酸性和碱性条件下不利于S1降解菌的生长,中性条件利于S1降解菌的生长。同时,pH对S1菌的降解率影响也很大,随着pH升高S1降解菌对SCP、SP和SM2的降解率也在不断升高,且增长幅度较为明显,在pH=7时降解率达到最高。当继续提高pH时,S1降解菌对SP和SM2的降解率有小幅度下降,但对SCP影响较大,降解率从42.46%下降到16.78%。可能是由于在碱性和酸性条件下抑制了S1高效降解菌的生长使其降解酶的含量减少[26]。由此可知,在pH=7时,最利于S1降解菌生长与降解。
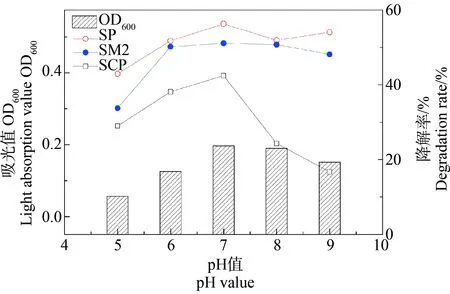
图4 pH对S1降解菌生长和降解的影响Fig. 4 Effects of pH on the growth and degradation of S1 degradation bacteria
2.5 接种量对S1降解菌生长和降解的影响
接种量对S1降解菌生长和降解能力的影响结果如图5所示。

图5 接种量对S1降解菌生长和降解的影响Fig. 5 Effects of inoculum size on growth and degradation of S1 degradation bacteria
由图5可知,接种量对S1降解菌OD600和降解能力均有一定的影响。接种量在0.1%~2%时,S1降解菌的OD600有小幅度变化处于稳定增长的状态,继续升高接种量时,OD600开始呈下降趋势。这说明接种量>2%时,随着菌量的增加,抗生素作为碳源被利用,但随着营养被逐渐利用完,中间的有毒代谢产物增多,使菌体迅速进入衰亡期[27]。当接种量从0.1%~2%不断上升,SM2和SP的降解率上升幅度较小,SCP降解率的上升幅度较大,均在2%的接种量时,达到最大降解率,SM2、SP和SCP降解率分别是49.7%、53.75%和31.63%。当继续提高接种量时3种抗生素降解率均下降,尤其SCP的下降趋势最明显。综上分析,S1降解菌的最适接种量为2.0%。
2.6 S1降解菌在最佳条件下生长和降解曲线
S1降解菌在最佳条件下生长和降解曲线如图6所示。

图6 S1降解菌在不同时间生长和降解情况Fig. 6 Growth and degradation of S1 degradation bacteriain in different time
由图6可知,在前6 h,S1降解菌处于生长的停滞期,可能是此阶段,菌株需要一段时间适应新环境,所以生长较为缓慢,此时抗生素的浓度变化也相对较小。在6~20 h,S1降解菌处于对数生长期,此阶段,S1菌开始利用培养基中的抗生素作为唯一碳源,细胞代谢活跃旺盛,各类蛋白质、DNA和RNA迅速合成,OD600值呈现直线上升的趋势,同时3种抗生素的浓度也呈现直线下降趋势,降解速率达到最大。在20~36 h,S1降解菌处于稳定期,可能由于降解能力有限和一些中间代谢产物具有毒性,所以OD600几乎保持不变,对抗生素的降解也变得缓慢。在36~72 h,S1降解菌处于衰亡期,菌体的繁殖速率小于死亡速率,由于菌体有毒代谢产物逐渐积累,使其菌体整体停止生长以及导致菌体死亡,在培养基底部可以看到明显的团状沉淀物,可能是由于死亡的菌体聚集成团沉淀,使其培养基的浊度下降而造成OD600值下降。在S1菌株的衰亡期,抗生素的浓度也没有明显变化。
2.7 SAs降解前和降解后的毒性效应
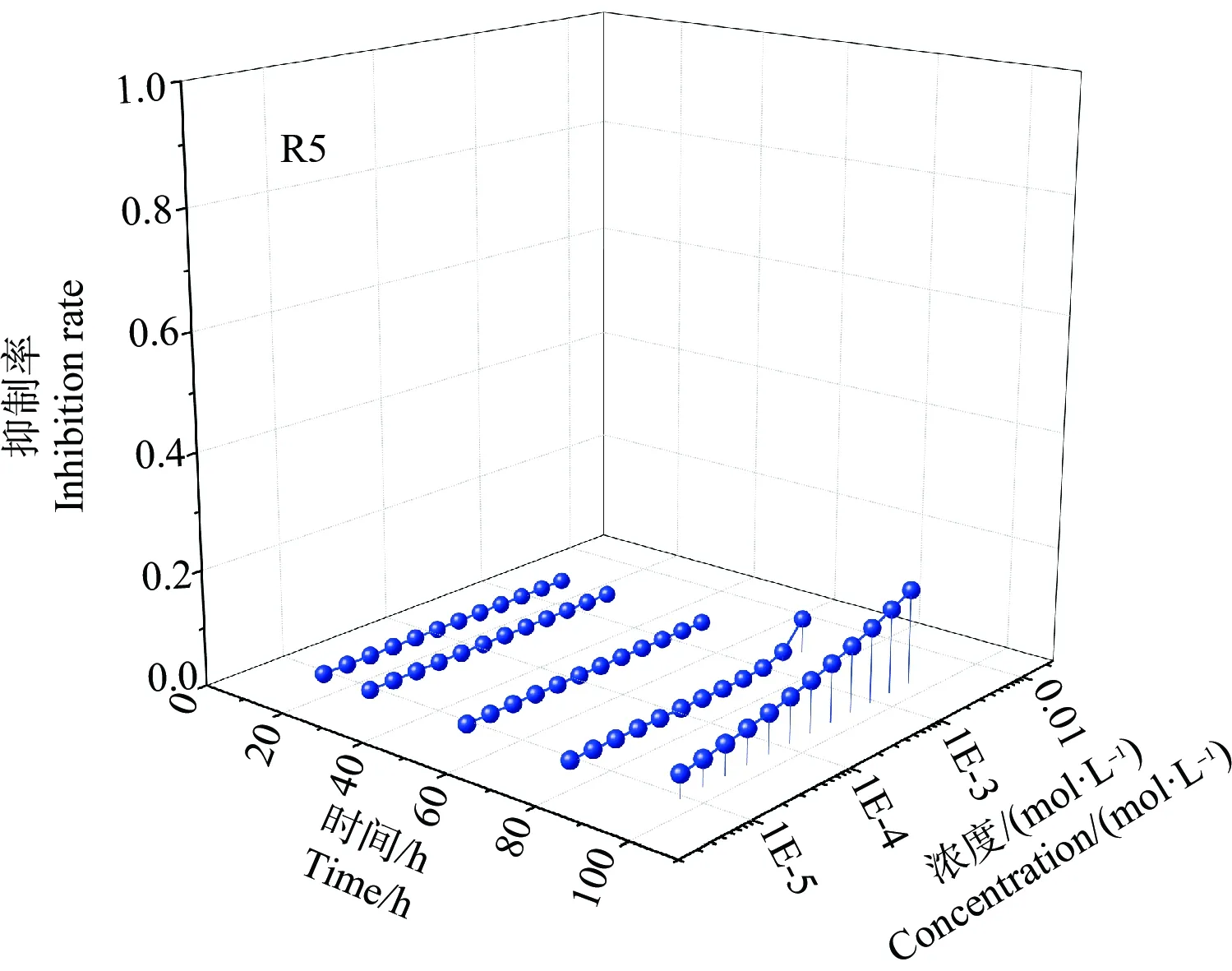
3个SAs降解前对绿藻的毒性结果如图7所示。由图7可知,3种抗生素在降解前对绿藻的毒性随暴露时间的延长逐渐增强,96 h毒性达到最强,即具有明显的时间依赖毒性。以半数效应浓度(EC50)的负对数值(pEC50)为毒性大小指标,3种SAs在降解前对C.pyrenoidosa在96 h毒性顺序为:SP(pEC50=2.66) 图7 降解前3种SAs对C. pyrenoidosa在不同暴露时间的浓度-效应曲线Fig. 7 Concentration-effect curves of three SAs before degradation to C. pyrenoidosa in different exposure time 3种SAs在降解后对绿藻的毒性效应如图8所示。由图8可知,降解后的3种抗生素对C.pyrenoidos毒性作用都减弱。降解后的3种抗生素对C.pyrenoidosa在96 h的毒性顺序为:SM2(pEC50=0.012) 图8 降解后3种SAs对C. pyrenoidosa在不同暴露时间的浓度-效应曲线图Fig. 8 Concentration-effect curves of three SAs after degradation to C. pyrenoidosa in different exposure times 3种SAs混合物在降解前对绿藻的毒性如图9所示。由图9可知,3种SAs的混合物对绿藻也具有明显的时间依赖毒性,即随暴露时间的延长,毒性逐渐增强。3种抗生素混合物的5条射线在96 h对C.pyrenoidosa的毒性效应大小顺序为R5(pEC50=2.83)>R3(pEC50=2.82)>R4(pEC50=2.80)>R1(pEC50=2.76)>R2(pEC50=2.75),其中,R5对C.pyrenoidosa毒性最强,这可能是3种的毒性及其在混合物中的浓度比不同所致。因此,本研究仅考察了射线R5在降解后的毒性效应,结果如图10所示。由图10可知,降解后的R5溶液对C.pyrenoidos毒性效应也明显降低,在96 h的pEC50值为0.016,比降解前毒性降低了99.43%。 图9 降解前SAs混合物对C. pyrenoidosa在不同暴露时间的浓度-效应曲线Fig. 9 Concentration-effect curve of SAs mixtures before degradation to C. pyrenoidosa in different exposure time 图10 混合物射线R5降解后对C. pyrenoidosa在不同暴露时间的浓度-效应曲线Fig. 10 Concentration-effect curve of mixture ray R5 after degradation to C. pyrenoidosa in different exposure time 抗生素的生物降解以微生物代谢为主,微生物对抗生素的降解过程比较复杂,不同种类的抗生素由于结构不同,降解途径存在显著的差异,主要通过生物积累、生物吸着以及水解、氧化等作用实现[28]。本研究通过逐渐提高混合抗生素浓度,筛选得到一株对混合抗生素耐性较强且可降解抗生素的菌株S1,其对3种混合抗生素最大耐受限度可达到1 500 mg·L-1,对混合抗生素的降解率约50%。S1菌株比文献中报道的菌株耐受能力更强,降解率虽然没有文献中的高,但文献报道的菌株只能对单一抗生素进行降解,如张珈瑜等[29]从城市污水处理厂活性污泥中分离得到一株以SM2为唯一碳源的菌株,在其最佳条件下100 mg·L-1抗生素在36 h降解率可高达100%;Yang等[30]利用SBR反应器驯化活性污泥得到降解SM2菌株对1 mg·L-1的SM2降解率达到56%;陈佩等[31]从活性污泥中分离得到一株对SP具有高效降解能力的菌株B1,含有430 mg·L-1SP废水处理74 h后,SP降解率可达74.26%。此外,本研究所获得的S1菌可以同时降解多种SAs,更利于对复合污染物的修复,而这更符合实际环境多种抗生素共存的实际情况。因此,本研究结果有望应用于抗生素的复合污染修复中。 毒性指标更能准确地反映污染物对生态系统中生物的影响[32]。因此,为了进一步检测筛选出来的菌株S1的降解能力,进行了3种抗生素及其混合物降解前后对绿藻的毒性效应比较。通过结果发现单元抗生素在降解前的毒性(SP 此外,环境中复合污染是普遍存在的污染现象[34],单一的污染物去除修复措施不能彻底解决问题。筛选出可以同时降解多种污染物的菌株在环境修复中能显示出更好的价值。因此,本研究所获得的高效降毒菌S1降解菌,对于环境中复合污染的磺胺类抗生素的去除更具有实际意义。 综上所述,本研究表明: (1)采用富集摇瓶训化法,以SCP、SM2和SP这3种抗生素为唯一碳源,从土壤筛选出2株菌株(S1和S2),S1降解菌性能优于S2,结合菌株形态特征和生理生化特性分析结果,初步判断为S1降解菌为马氏棒杆菌。 (2)在3种混合抗生素浓度为1 500 mg·L-1,pH=7.0、30 ℃、150 r·min-1,接种量2.0%时,S1降解菌生长和降解能力最佳,降解24 h后SM2、SP和SCP降解率分别是49.7%、53.75%和31.63%,S1降解菌在12~20 h处于生长和降解旺盛期。 (3)S1降解菌降解后的抗生素及其混合物对蛋白核小球藻的毒性效应比降解前的毒性降低了99%以上,S1降解菌对3种SAs的降解能力为SM2>SP>SCP。研究结果为SAs以及其他污染物的去除提供数据和方法参考。 ◆

2.8 3种SAs混合物在降解前后的毒性效应

3 讨论(Discussion)

