全氟化合物污染现状及与有机污染物联合毒性研究进展
朱永乐,汤家喜,李梦雪,王鹤飞,杨欢
辽宁工程技术大学环境科学与工程学院,阜新 123000
全氟化合物(perfluorocarbons, PFASs)由于独特的物理化学性质,如降低表面张力、较好的稳定性、疏水性以及亲水性,被应用于消防材料、工业表面活性剂、杀虫剂以及纸张和纺织品表面处理剂等中。因其广泛的应用和较强的环境持久性,PFASs在全球范围内的空气、土壤、沉积物、野生动物甚至极地冰川等中被检出[1-6]。PFASs具有极稳定的共价键在自然环境中不容易降解。自2005年以来,欧盟、加拿大和美国等开始监管全氟辛烷磺酸(PFOS)[6-7]。自2009年以来,PFOS受到《关于持久性有机污染物的斯德哥尔摩公约》的限制,专家建议将其纳入《鹿特丹公约》,要求对发展中国家的危险化学品出口实行管控。2019年4月,召开了《斯德哥尔摩公约》第九次缔约方大会,通过了将全氟辛酸及其盐类(PFOA)和相关化合物增列入附件A的决定,并设置了相关特定豁免[7-8]。国际癌症研究机构最近也将PFOA列入可能具有致癌性的物质中,美国环境保护局(US EPA)得出结论,PFOS和PFOA都可能对人类致癌[8]。目前各国已经对PFOS和PFOA等长链PFASs禁止或限制生产和使用。一些短链( 本文主要从当前国内外PFASs的污染现状及其与其他有机污染物之间单一、联合毒性等方面进行了综述,以期为进一步研究PFASs在各圈层介质中的环境行为及毒性效应,以及了解PFASs的联合生物毒性及其作用机制提供参考依据。 大气是PFASs进行长距离迁移的重要介质。PFASs可与大气气溶胶和颗粒物结合进行远距离迁移,并最终通过干湿沉降进入地表环境[18]。从全球范围来看,大气中PFASs主要分布在人口稠密和工业发达区域,且城市区域的浓度分布显著高于乡村,陆地区域高于海洋[18-19]。2015年,对中国北京环境空气颗粒物中PFASs的浓度研究发现,PM2.5、PM10和总悬浮颗粒物(TSP)中∑PFASs含量分别为87.03~96.77、99.82~101.41和118.69~141.87 ng·g-1,全氟丁酸(PFBA)、全氟戊酸(PFPeA)和PFOA是主要成分[20]。Chen等[18]发现中国辽宁阜新氟化工园区周边大气中离子型PFASs含量为(4 900±4 200) pg·m-3,显著高于非离子型PFASs的含量(1 400±3 000) pg·m-3,其中PFBA和PFOA的含量占整体离子型PFASs含量的79%。Ge等[21]研究日本金泽市大气颗粒物中PFASs含量分布发现,大气中的PFASs主要以PFOA、全氟壬酸(PFNA)和全氟癸酸(PFDA)为主。粗颗粒物中PFOS质量分数最大,而超细颗粒物中全氟羧酸(PFCAs)的质量分数最大,降水是造成大气中PFASs浓度季节性差异的主要原因。中国深圳市冬夏两季室外及室内大气中均以挥发性PFASs为主,离子型PFASs为辅,全氟丁基磺酸(PFBS)是深圳市大气中最主要的全氟磺酸类(PFSAs)物质,PFCAs浓度均大于PFSAs[22]。中国北方的降雪中PFASs的浓度较高总含量达33.5~229 ng·L-1[23]。由此可知,大气中具有较高的PFASs浓度,这主要是因为工业生产所排放的废气废水中PFASs直接释放于空气中。人体中的PFASs主要来源于呼吸暴露。因此,开展大气PFASs的综合防治,是降低人体血液中PFASs浓度的有效措施之一。 PFASs可以随地下水进行远距离迁移,在地下水和表层水中容易被检出。PFASs进入到浅层地下水系统中,主要以2种形式存在。一种是直接进入到含水层,溶解在地下水中。另一种是残留在渗流区[24-25]。大气中的PFASs会直接通过降雨降雪进入到水体中,雨水冲刷也会将土壤中的PFASs带入河流中。水体中的PFASs会随着蒸发作用再次进入到大气中,也会迁移到地下水中。同时,水生生物也会直接摄入PFASs,使之进入生物链循环,这也是水体中PFASs进入人体的主要途径(图1)。当前水体中PFASs污染不容小觑,研究者在世界各个国家和地区的地表水、地下水、海水和污水处理厂出水中均检测到了不同浓度的PFASs[18,25]。中国目前在受污染水体中检出率较高的2种PFASs为PFOS和PFOA。一般地表水中浓度均可达到ng·L-1水平。Sun等[26]在对中国上海市地表水中的PFASs含量进行检测,∑PFASs最大含量为362.37 ng·L-1。周珍等[27]对中国武汉市某污水处理厂附近水体研究时发现,PFOA、PFBA和PFBS等具有较高的检出率,最高浓度分别可达285、5 780和3 800 ng·L-1。某些氟化学产品制造厂等点源污染可造成周边环境水体严重污染,例如,Zhu等[28]对中国大凌河研究发现,在夏季该流域∑PFASs高达9.54 ng·L-1,主要污染物为PFBA、PFBS和PFOA,在4个采样季节中对∑PFASs贡献率超过了90%,这与阜新市2个氟化工园区的排放有直接关系。相关研究还表明,地下水中PFASs的污染程度与季节也存在一定的关系,潮湿季节的污染程度略高于干燥季节[29-30],这与Liu等[24]与Wu等[31]的研究结果完全一致。Liu等[24]指出,湿季浅层地下水的PFASs浓度高于旱季,地下水位的变化导致地下水中PFASs浓度在时间和空间上的变化,两者基本呈现正相关;Wu等[31]通过对中国观澜河水体研究发现,雨季的PFASs浓度水平明显高于旱季,支流PFASs水平相对高于主流,主要来源是工业排放、生活废水等,并进一步分析得出全氟十四酸(PFTA)对当地水生植物具有较高的生态风险。毋庸置疑的是,工业的快速发展已经加重了PFASs的污染程度,尤其中国辽河流域因长期接纳工业污染与生活污水,其污染更为严重。Bao等[32]分析中国辽河支流地下水中PFASs浓度,发现∑PFASs有较高的检出浓度,为26.7 μg·L-1,随着水体深度的增加,含量逐渐降低(表1)。Chen等[33]在对中国大辽河的研究中发现,该地PFASs污染浓度最高可达781 ng·L-1。工农业活动是水体中PFASs的主要来源,废水被直接排放到河流、湖泊中,PFASs会被动植物的摄食和吸收进而残留在体内,还会通过食物链进入人体。当前,常规的生物处理工艺只能够部分去除长链PFASs,但是对于其他类型的PFASs并不具有很好的去除率[2]。 表1 中国部分地区水体中PFASs的浓度Table 1 PFASs concentrations in water bodies in some regions of China (ng·L-1) 图1 水环境中全氟化合物(PFASs)的迁移Fig. 1 Migration of perfluorocarbons (PFASs) in water environment 沉积物和土壤对有机污染物具有较高的富集能力,目前我国部分地区PFASs的土壤污染问题较为严重,如表2所示。沉积物和土壤是PFASs的一个重要汇集场所,空气的PFASs可通过降水降雪重新迁移到土壤中[18,34]。中国山东省某湿地沉积物中PFOA和PFOS的浓度范围为0.09~2.76 ng·g-1dw和0.17~5.25 ng·g-1dw[35];中国北京市某垃圾填埋场周围土壤∑PFASs为0.10~169.05 ng·g-1,而周围河流底泥中污染程度较低,PFASs的平均浓度为1.91 ng·g-1[36]。对于工业集中的区域,PFASs检出浓度更高[37-38]。例如,薛建芳[38]研究某氟化工园区周边农田中PFASs的动态变化时发现,农田土壤中PFASs的最高平均浓度(224.73 ng·g-1)出现在冬小麦的越冬期,最低浓度出现小麦的成熟期(35.38 ng·g-1),并在整个生长周期呈现逐渐下降的趋势;Chen等[18]对阜新市氟化学工业园区表层土壤调查研究发现,土壤中离子型∑PFASs为2.4~240 ng·g-1。近年来,修复PFASs污染土壤的相关研究也在逐步推进。Cai等[39]指出,土壤基质吸附PFASs是控制PFASs对土壤微生物毒性的关键因子。碳链长度和功能基团的差异对土壤微生物活性有不同的影响,也同时会影响吸附进度。链长越长,PFASs毒性越大。此外,土壤的pH也是土壤吸附的另一个相关因素,随着pH增加,吸附能力也逐渐增加。世界各地土壤中均存在较高的PFASs检出率,土壤中的PFASs会直接被农作物根系吸收并被人体食用,这会直接威胁到人类的生命健康。 表2 中国部分地区土壤中PFASs的浓度Table 2 PFASs concentrations in soil in some regions of China (ng·g-1) 植物体内PFASs主要来源于大气和土壤。大气中PFASs会通过蒸腾作用直接进入到植物叶片,而土壤中的PFASs由土壤转移到根部时,土壤孔隙中的PFASs经被动扩散被植物根吸收,再经过木质部的水相或韧皮部汁液的蒸腾作用转移到植物其他部位[40](图2)。Felizeter等[41]研究莴苣对PFASs的吸收时发现,莴苣可吸收水溶液中PFASs,并通过植物蒸腾作用进行迁移。植物具有较完全的富集系统能够在体内长时间富集PFASs,因此植物相对于土壤、水体等介质具有较高的PFASs浓度。Chen等[18]调查了阜新市2个氟化学工业园区周边柳树叶片中PFASs的含量,结果显示,叶片中PFBA的浓度较高,为(14 000±33 000) ng·g-1dw,其次是PFOA和PFBS,浓度分别为(1 500±5 200) ng·g-1dw和(930±2 300) ng·g-1dw。 图2 PFASs在植物体内迁移Fig. 2 Migration of PFASs in plants 植物不同部位对PFASs的富集能力有所差异,大多数植物中根部的浓度高于茎、叶以及果实等部位。Felizeter等[42]研究发现,小麦根部PFOS浓度为31.98 ng·g-1,大于茎的6.34 ng·g-1;Zhang等[43]对茶叶中PFASs的含量分析表明,茶叶残留的PFASs主要是C≤8的PFASs,占总量的50%~99%左右,PFOA和全氟己酸(PFHxA)是主要的残留物,这均与上述结论一致。而Lechner和Knapp[44]通过室内培养实验,对马铃著、胡萝卜和黄瓜从土壤与污泥混合物中吸收富集PFOA和PFOS进行了研究发现,植物的营养器官(茎叶)对2种物质的传输因子最高,对PFOA的传输因子高于PFOS。这主要是因为PFASs在植物中的传输和富集作用会因为植物的不同而不同,同时受土壤中有机碳的影响[40]。 当前利用植物修复PFASs污染土壤是新的研究趋势,植物修复相对于其他修复成本低廉、可选择性强,然而选择何种富集能力较强的植物进行修复却始终是未解难题。国内外相关研究有利用金鱼藻、菖蒲和芦苇等植物进行模拟,但是效果不太理想。因此,选择对PFASs具有超富集能力植物是下一个具有研究前景的方向。 人体主要通过4种途径接触PFASs,主要是呼吸直接吸入、皮肤接触、食物链循环和饮水暴露,其中食物链摄取是主要途径之一,如图3所示。环境介质中的PFASs进入到动物体内,会发生生物蓄积作用并通过食物链被逐级放大,最终在人体内富集产生生物毒性。Müller等[45]研究加拿大北部地区PFASs在“青苔—北美驯鹿—狼”陆生食物链中的生物放大效应时发现,所有物种体内均含有PFCAs和PFOS,它们在北美驯鹿和狼肝脏中的浓度分别是6~10 ng·g-1和0.7~2.2 ng·g-1以及10~18 ng·g-1和1.4~1.7 ng·g-1;2016年对中国主产区的鸡肉调查发现[46],全国部分主产区鸡肉中检测出17种PFASs,以中短链为主。∑PFASs检出率高达97.6%,其平均值为0.476 μg·kg-1,是鸡肉中的2倍,主要污染物是PFHxA(0.206 μg·kg-1)、PFPeA(0.112 μg·kg-1)和全氟戊烷磺酸盐(PFPeS)(0.0480 μg·kg-1)。PFASs在动物及人体内富集浓度还会呈现较明显的区域化效应。例如,从工业区周边的动物园获取的血液样品中PFASs的浓度高于其他地区。此外,进入人体中的PFASs不仅难以排出,还会影响发育、引发疾病等。2017年,对中国沈阳市1 612名成年人血样分析发现[47],血清中存在较高浓度的PFASs,血清中PFASs的浓度水平及其异构体的水平与人群中超重或腹型超重水平呈正相关。同直链PFASs相比,支链异构体与超重及腹型超重之间相关关系更强。研究某氟化工园区周围青少年体内PFASs浓度水平时发现[48],共计检出16种PFASs,其中11种检出率>60%。PFOA为主要污染物,占检出PFASs总含量的67.8%~97.7%,中位数为94.2 ng·mL-1。男生体内PFBA和全氟辛烷磺酸(PFHpA)浓度高于女生,而且发现,PFHpA和PFOA浓度水平随学生家庭至工厂距离增大而下降。可见,人体内的PFASs浓度与工业有着较为密切的关系。 图3 人体接PFASs的途径Fig. 3 The way of human contact with PFASs 综上所述,PFASs不仅会在不同的环境介质中迁移扩散,还会进入和累积到各种动物体内。我国工业、农业正处于快速发展的阶段,PFASs在工业和生活产品中的广泛应用大大增加了它的排放来源。PFASs难以被自然降解并容易聚集在各种自然环境中及生物体内,这也是PFASs被当作一种新的环境污染物引起了越来越多的科学家注意的主要原因。针对于目前PFASs的污染问题,虽然相关的去除与降解等研究工作也逐渐被开展,但是总体而言还是处于初级阶段。例如,He等[49]在仿生材料的启发下,构建了一种多项催化剂负载生物炭(Fe(TPFPP)/BC),通过激活过硫酸盐(PS)来实现对PFOA的降解;Albert等[50]在活硅藻(Dt)上功能化铁纳米粒子,实现Fenton反应和活性氧(ROS)的产生,以提高对PFASs的去除效率;张春晖等[51]分别以溶胶涂覆法和电沉积法制备了改性DSA(Ti/SnO2-ZnO)电极,并用于PFOA与PFOS的电化学降解过程研究。这些相关研究立足于PFASs污染现状,为PFASs的污染防治工作提供了理论指导。 在实际的环境介质中,人体可通过直接和间接等2种途径接触PFASs,而PFASs一旦进入人体后,很难发生代谢反应排出体外,将在人体内发生蓄积,产生潜在的毒性作用。目前国内外对于PFASs的毒理学研究,主要是单一毒性与联合毒性2个方面。 PFASs中含有化学键能极高的碳氟键,同时结构中缺乏活性基团,目前被认为是具有生物惰性的物质[40,50,52-54]。PFASs可以在动物及人体内长期残留,这主要来源于其特殊的结构。相关的研究表明[54-55],PFOS是完全氟化的阴离子并以盐的形式被广泛使用或渗入较大的聚合物,直链PFOS的稳定结构呈现螺旋状,高能C—F(448 KJ·mol-1)及碳链周围紧密包裹的氟原子使PFOS显示更高的稳定性。吴江平等[55]研究PFASs的生物富集效应时发现,生物对PFASs的富集能力随化合物的种类和生物种类的不同而不同。对于同一种PFASs,哺乳动物和爬行动物等高生态位生物的生物富集能力明显高于无脊椎动物和鱼类的生物富集能力。PFASs具有生物学放大效应,高生态位动物放大程度存在差异性。影响PFASs的生物富集因素以及放大效应的因素很多,但主要与自身的结构密切相关,例如碳链长度、碳链末端基团类型和是否含有支链等[36,55-56]。Liu等[17]指出,PFBS、PFHxS、PFBA和PFHxA具有相似和不同的毒性机制。此外,PFBS和PFHxS的影响强于PFBA和PFHxA。相关研究同样表明[17,23,55],PFCAs具有较强的生物富集效应并且生物对PFCAs的富集能力与其碳链长度(氟代碳原子数)有关,碳链长度越长,生物富集能力越大。但当PFASs的氟代碳原子个数超过11时,生物富集能力反而出现下降。这主要因为长链PFASs的分子体积较大,无法通过生物体的细胞膜,从而降低了细胞对化合物的摄入能力。PFASs碳链末端化学基团的类型也会影响其生物富集能力。即使相同碳链长度的PFASs,碳链末端不同的化学基团使PFASs的生物富集能力不同。如相同碳链长度的PFSAs(末端为—HSO3)的生物富集能力显著高于PFCAs(末端为—COOH),这可能是因为—HSO3具有与蛋白质更强的结合能力(图4)[55]。PFASs对肝脏、神经、生殖系统和免疫系统等多种器官具有毒性和致癌性。一旦被生物体摄入后,优先吸附在蛋白质上,大部分与血液中血浆蛋白结合并累积在蛋白质含量较高的肝脏中,还会造成呼吸系统病变。同时,相对于直链PFASs而言,生物体更容易将支链PFASs排出体外,但这不能确切表明PFASs的毒性与其碳链长度呈现正相关关系[62-65]。Naile等[66]指出,PFASs的毒性不能完全归因于碳链长度与功能基团,短链PFASs替代品的毒性机制与PFOS、PFOA完全不同;侯沙沙等[48]通过分析某氟化工园区周围青少年体内PFASs浓度发现,该地区青少年处于PFOA高暴露水平,部分PFASs与青少年性征发育负相关,可能对青春期性发育产生影响。男生外生殖器发育与PFNA有关,女生阴毛发育与PFHxS有关。PFASs的种类较多,属于表面活性剂。但都具有共同的特点,就是不会被人体所降解,特别是可自发地分布在固液界面以降低固体表面张力。同样,在生物体内也发挥疏水疏油的特点,分布在细胞壁、细胞核等界面,无疑会对细胞的物质交换、氨基酸的合成以及基因表达等产生影响。相关研究表明,在PFOS和PFOA的暴露下,苯丙氨酸、酪氨酸和色氨酸等多种氨基酸受到显著影响[67]。韦荣国等[63]也指出,PFASs会影响甲状腺激素相关基因的表达并且短链PFASs(C<8)对基因表达的影响比长链的PFASs(C>8)更加明显。 单一PFASs具有的多种生物毒性已经被证实。PFASs不仅会干扰DNA链的合成表达及酶的合成,同时还会影响生物体的生殖和发育。PFASs属于持久性有机污染物,具有较强的亲蛋白能力,会在蛋白质、脂肪含量较高的肝脏和肌肉组织中富集。但是富集不同链长的PFASs的具体器官需要进一步研究和证实。不同的PFASs具有独特的毒性,完整的PFASs评估工作也需要更多的实验及数据支撑[63,68]。 单一的PFASs的生物毒性一直是人们的研究热点。但是实际环境中,PFASs不可能单独存在,更多的是2种或者多种PFASs共存于环境中,它们作用于生物体时往往会发生与单一污染物作用完全不同的联合毒性。因此,研究PFASs对生物的联合毒性效应,对于探讨PFASs的生态毒理具有重要意义。 当前国内主要利用PFOA与PFOS进行毒理学实验,采用的生物主要是鱼、大鼠及一些耐受性较高的细菌等。这主要因为多数的毒理学实验基于高剂量的PFASs暴露,尤其是对于PFASs间的联合暴露实验,有的浓度甚至高达200~250 μmol·L-1。高剂量暴露的理论基础是污染物与剂量之间具有较强的线性关系,但是对于PFASs之间的联合暴露却不能准确适用。相关研究已经表明,高剂量的PFOS暴露实验与低剂量的PFOS暴露实验的毒性效应不尽相同,即高剂量暴露下无效应并不能说明低剂量暴露下也无效应[65,69-70]。PFASs对生物具有单一毒性和应激效应,复合污染表现为加和、协同和拮抗等3种作用。PFASs之间的联合毒性效应随作用对象、浓度比例的不同而不同。周静韵和段舜山[71]通过研究PFOA与PFNA对2种不同海洋微藻的联合毒性效应发现,PFOA与PFNA联合暴露对杜氏盐藻的生长表现为加和作用,而对三角褐指藻表现为协同作用。相同的2种PFASs产生2种不同的毒性效应,与其本身结构性质有关外,还与单一PFASs对生物的作用机制异同有关[63,71]。几种PFASs联合暴露不仅会对生物表现出不同的毒性效应,也影响细胞的生物膜结构以及DNA的表达,干扰细胞的正常生命活动,导致细胞失活或者死亡。刘歌声[67]研究发现,当PFOS、PFOA与大肠杆菌接触时,会与大肠杆菌细胞界面的疏水点位结合,与生物分子发生反应,影响细胞的正常代谢,进而引起氧化损伤。氧化损伤会增加DNA和细胞膜的损伤,而细胞膜的损伤会导致细胞内含物的外流,进而造成细胞死亡(图5)。 图5 全氟辛烷磺酸(PFOS)与全氟羧酸及其盐类(PFOA)对大肠杆菌的致毒机理Fig. 5 Toxic mechanism of perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) to Escherichia coli 目前PFASs的联合毒性研究主要集中在PFOS与PFOA,相关的毒理学报道甚少。PFASs之间的联合毒性是继单一PFASs毒性之后的一个新的研究方向,所以应广泛针对PFASs之间的联合暴露开展相关工作,扩大研究和实验对象,进行PFASs的全面调查与试验工作。 目前复合污染的研究,多数集中在复合污染对单一因素毒性作用的加强与减弱方面,往往忽略了不同污染物之间的相互作用,以及复合污染带来的单一因素没有的影响。PFASs主要来源于工业生产以及农业活动,对于一些工厂周围分布着农业用地的工农业用地混合区域,往往会形成多种有机污染物与PFASs之间的联合污染。例如农业活动中的多氯联苯、二噁英与PFASs可以形成大面积的复合污染。PFOS与其他有机污染物共存时,无论单一有机污染物的毒性程度如何,PFOS的存在都会改变共存污染物的表观毒性[63,69-71]。Xu等[72]指出,高浓度的PFOS会显著增加藻类细胞细胞膜的通透性,而细胞膜的高通透性可能造成PFOS刺激细胞内活性氧自由基的产生,从而引起其他生物大分子的脂质过氧化损伤,这是其毒性效应的主要机制。PFOS与其他有机污染物共存时,PFOS凭借较强的疏水疏油性质,会对细胞膜功能产生破坏,改变细胞膜的通透性,从而影响细胞对其他有机物的摄取并表现出不同的毒性效应[52,55,63,71-73]。Chen等[74]研究纳米塑料(NPS)与PFOS对微生物的代谢毒性时也得出了相似的结论。单一NPS暴露对嗜热菌的代谢表现出明显的干扰作用,导致产氢量减少53.9%。然而,NPS与PFOS联合暴露时产生了拮抗作用,导致制氢量减少31.6%。尽管如此,单一和联合暴露并没有改变产氢类型。与单一NPS暴露相比,联合暴露下的嗜热菌对半膜渗透染料的渗透性较低,活性氧种类较少。PFOS的加入虽然减轻了NPS的毒性作用,但没有改变其毒性机制(图6)。PFASs在人体中的生物累积性和相关潜在毒性已被证实,大多数与有机物间的联合毒性研究集中在啮齿类动物或人类细胞中,而关于这些化学物质在水生环境中的生态毒性信息更少。当PFASs与其他有机物共存时,PFASs可以溶解非极性物质,这也是联合暴露必须要考虑的问题之一。由于不同的PFASs可能在同一环境中共存而且它们之间的毒理学相互作用也有可能发生,因此应研究尽可能多的PFASs与其他有机物之间的联合毒性,特别是要尽快找出可能与之相互作用的有机物。因为当这些有机物与PFASs相互作用时,可能会大大影响复杂混合物中相互作用的模式[67,70-73]。 图6 纳米塑料(NPS)与全氟辛烷磺酸(PFOS)联合暴露下对嗜热菌的代谢毒性Fig. 6 Metabolic toxicity of nanoplastics (NPS) and perfluorooctane sulfonate (PFOS) combined exposure to thermophilic bacteria PFASs作为一种新型污染物,因具有独特的化学结构,目前已经在大气、水体和土壤等多种介质中检出并且能够长期残留于环境中,随食物链逐级放大,富集在生物体内。单一的PFASs本身极难降解,易对生物造成多种生物毒性,若与其他有机污染物形成复合污染,其联合毒性作用更为复杂,因此,研究PFASs与其他有机物的复合污染的生物毒性作用机理具有十分重要的意义。 目前,我国的PFASs污染防治和研究工作还处于起步阶段,应对PFASs的生成、迁移转化和毒性分析等方面进行全方位的研究和探讨。首先,针对于PFASs浓度较高的工业区进行进一步的筛选和排查,运用现代的科学技术手段进行溯源追踪,坚持源头治理,综合整治,并结合出台的相关政策及法律法规对PFASs的主要排放来源进行确定和遏制。其次,应以相关的毒理学实验作为依托,及时制定和完善其毒理学的评价标准和方法,尤其对人体健康风险评价及在人体内的富集转化等方面予以重视并作为相关毒理学研究的主要攻克方向。最后,还应全面、深入地开展对PFASs家族之间以及无机、有机或重金属与PFASs的联合污染行为的研究,应用化学计算模型对污染物的迁移转化规律进行模拟和预测,为PFASs的防控提供思路和正确方法。同时更重要的是结合我国目前的污染现状和总体形势,尽快出台切实可行的相关措施和方案并做好污染防治的措施与准备。 ◆1 不同环境介质中PFASs的污染现状(Pollution status of PFASs in different environmental media)
1.1 大气中PFASs污染现状
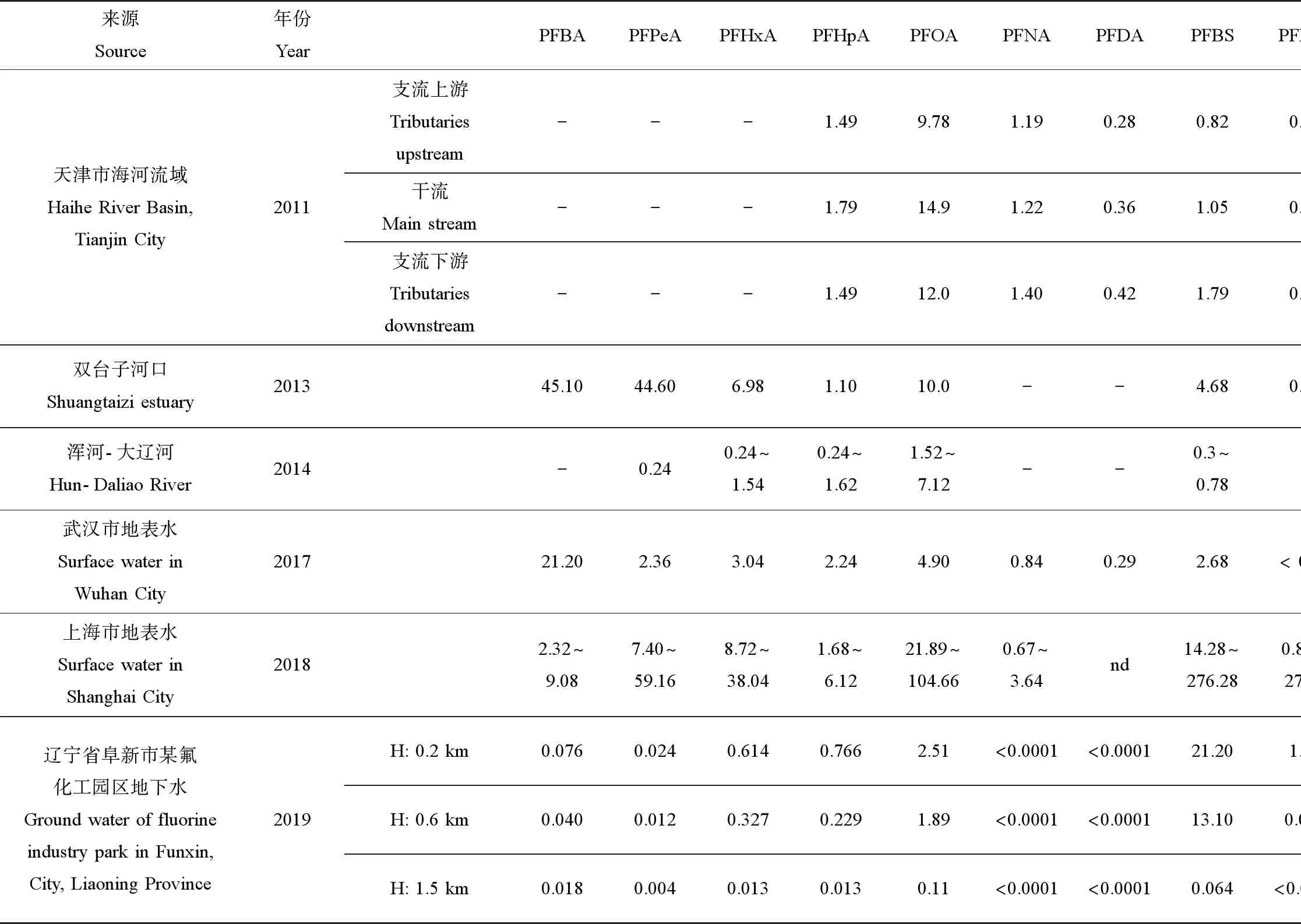
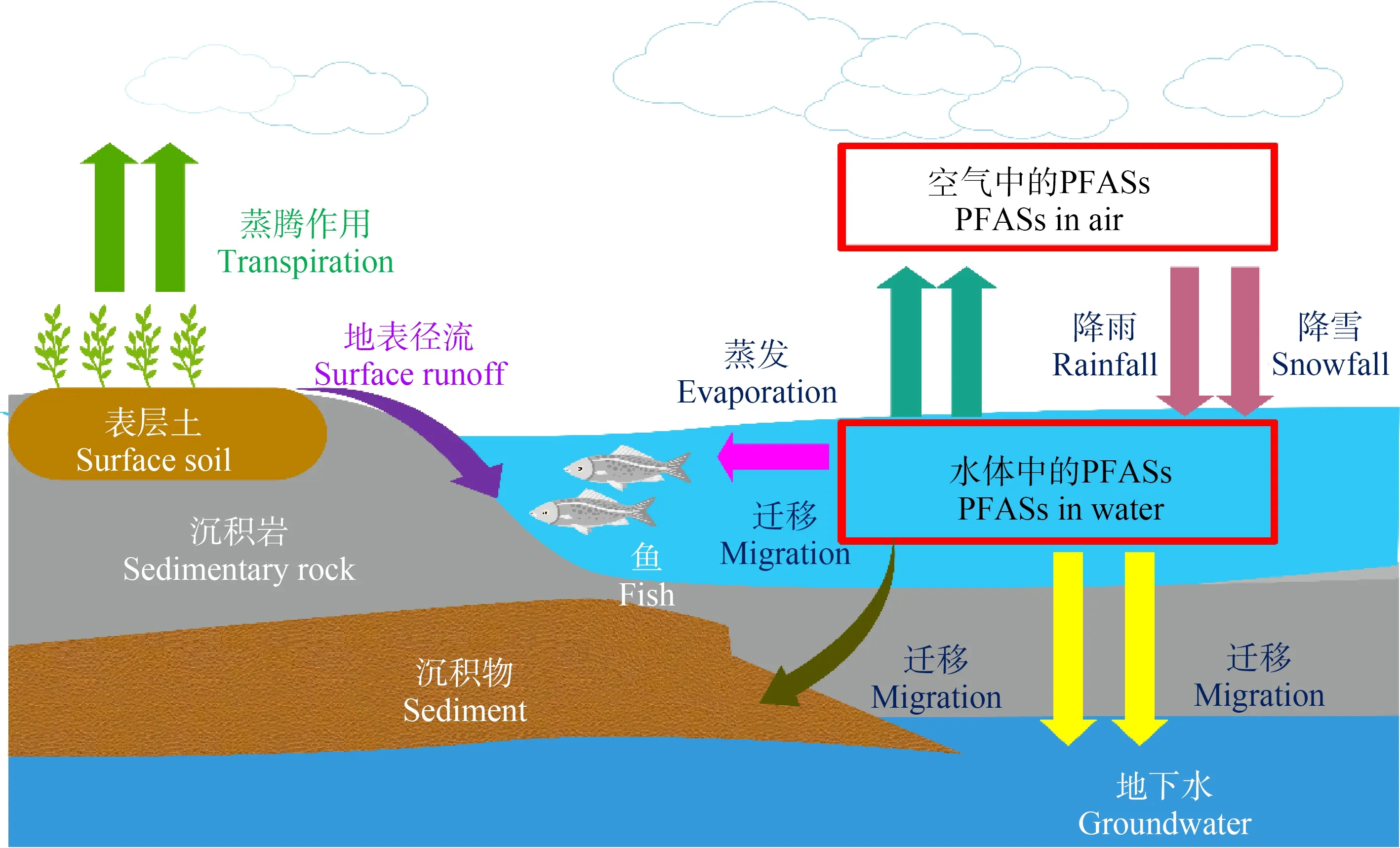
1.2 水体中PFASs污染现状
1.3 沉积物与土壤中PFASs污染现状

1.4 植物中PFASs污染现状

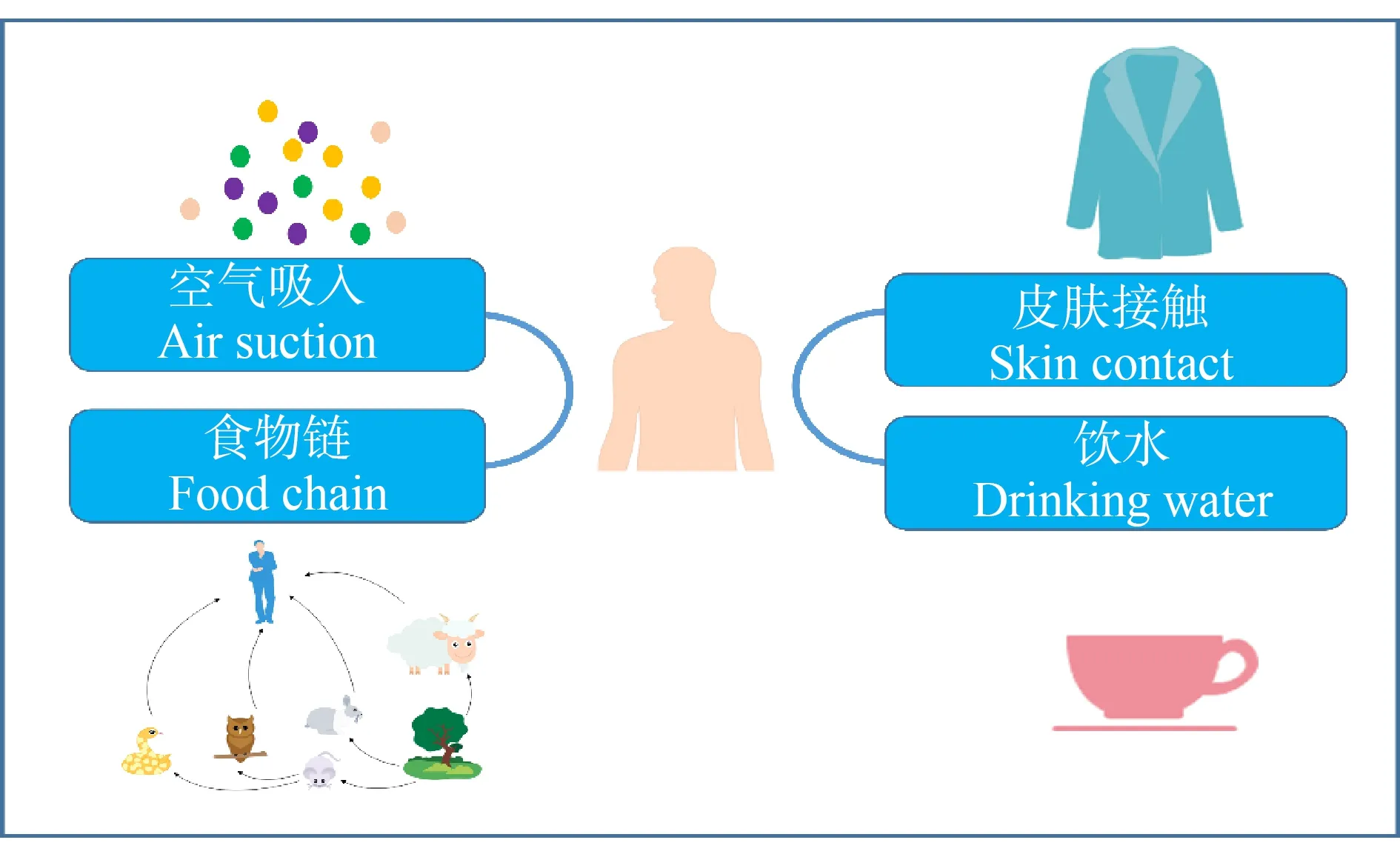
1.5 动物和人体中PFASs污染现状
2 PFASs对生物毒性作用研究(Study on the biological toxicity of PFASs)
2.1 单一PFASs对生物的毒性研究
2.2 多种PFASs对生物的联合毒性研究

2.3 PFASs与其他有机污染物对生物的联合毒性研究

3 总结与展望(Summary and prospect)

