量子点对秀丽隐杆线虫的毒性效应及其调控机制的研究进展
程锦,季倩倩,王瀚,吴添舒
环境医学工程教育部重点实验室,东南大学公共卫生学院,南京 210009
随着纳米技术的快速发展,量子点(quantum dots, QDs)作为一种新型的纳米荧光探针和纳米载体,由于其独特的性质,如优异的耐光漂白性、相对较长的荧光寿命、修饰后良好的生物相容性等被广泛应用于各个领域[1],但是现有研究发现,许多类型的量子点可以渗透到组织和细胞中,并导致生物体内的生化损伤。因此,明确量子点的毒性效应及其毒作用调控机制是控制量子点毒性的关键之一。秀丽隐杆线虫作为一种经典的模式生物,具有诸多优点,包括良好的生物学基础,较短的生长周期和较大的繁殖规模,已被广泛应用于毒理学领域,尤其是环境毒理学[1]。并且,秀丽隐杆线虫基因组中约有40%基因与人类基因组同源,因而外源化学物对秀丽隐杆线虫的毒性效应很大程度上可以反映毒物对脊椎动物,甚至是人体的损伤。在此研究背景下,本文总结分析了新近发表的文献,旨在阐述量子点对秀丽隐杆线虫的毒性效应及其调控机制的研究进展。
1 量子点在生物体内的ADME(absorption, distribution, metabolism, excretion)过程(The ADME process of quantum dots in organisms)
1.1 量子点被机体的吸收
量子点主要的暴露方式有短期暴露和长期暴露[2]。硫化锌外壳修饰的碲化镉量子点(CdSe/ZnS)和碲化镉量子点(CdTe)是生物成像中最常用的2种纳米粒子,一些研究表明,把与CdTe量子点、CdSe/ZnS量子点混合后的大肠杆菌喂食给秀丽隐杆线虫,短期暴露12 h后,大量量子点与大肠杆菌一起通过消化道被摄入,并填满咽腔,以极短的速度经过肠道,许多量子点保留在肠的初始部分,在中间肠中与大肠杆菌分离。同时,大多数量子点通过肛门和外阴排出体外,仅有少数量子点残留在消化系统和生殖系统中,并未进入卵中[3]。暴露24 h后,发现肠道内的CdSe/ZnS量子点的ZnS外壳被破坏,CdSe核被氧化[4]。暴露16 d,量子点在消化系统中不断积累,被肠细胞大量吞噬。除量子点以外,相关研究表明其他的荧光纳米材料也具有相似的吸收过程[5-6]。
1.2 量子点在机体内的分布
相关研究表明,大多数类型的量子点,无论在无机核和有机稳定剂中的组成如何,都在秀丽隐杆线虫中表现出相似的生物分布[3]。进入机体的量子点在线虫体内各个系统中均有分布,主要分布在肠道系统。吴添舒等[7]的研究表明,当线虫暴露于不同浓度的CdTe量子点24~72 h后,被摄取的量子点主要聚集于肠道中。线虫头部也有量子点的分布[8],可能是通过肠道生物膜而进入相邻的头部细胞。而较长的暴露时间(72 h)也导致了量子点在体内更多的集聚。相关研究表明在线虫前部的肌肉中也有适量的CdTe量子点聚集[8]。
在消化系统中,量子点主要分布在咽部和小肠[9],长时间暴露后,内化的CdTe量子点可以散布在咽、肠腔和肠细胞中,并且累积程度随量子点暴露浓度递增。附着在咽侧壁上的量子点提示其与咽壁细胞可能存在特殊相互作用[10]。
已有研究表明,CdTe量子点和CdSe/ZnS量子点等大小和组成不同的纳米材料可能会从消化系统中易位并影响生殖系统,暴露时间的长短也对生殖系统的作用有重要影响。在CdTe和CdSe/ZnS量子点中短时间暴露(12 h)后,大多数量子点通过肛门和外阴排泄到外部,并且在生殖系统中仅观察到少量量子点,而没有进入卵。暴露12 h~3 d时后,量子点从消化系统转移出来,线虫还未观察到明显的不良反应。然而,继续暴露到16 d时,大量量子点转移并积聚在线虫子宫和外阴,从而对生殖系统产生不利影响并损害卵子[3]。胚胎死亡率和产卵缺陷的增加可能归因于运动神经元中跨神经突触的传递受阻[11]。
在神经系统中,也观察到量子点的分布。Wu等[11]研究了线虫中氧化石墨烯量子点在线虫中的易位和生物分布。从L1幼虫到成虫第8天长期暴露于1 mg·L-1的氧化石墨烯量子点后,仍可以在咽中检出标记的氧化石墨烯量子点,大量氧化石墨烯量子点转移到了咽周围的头部大多数神经元所在的位置以及性腺和线虫中的某些胚胎中。此外,与咽、性腺和胚胎中累积的氧化石墨烯量子点相比,更多的氧化石墨烯量子点在线虫的肠和尾巴中积累。推断氧化石墨烯量子点可能在慢性暴露后通过线虫中主要目标器官的屏障转移到次要目标器官中,例如性腺和神经元。一些研究表明[8,12],长期暴露后,CdTe量子点沿着肠的生物屏障易位到RMEs运动神经元(RMEs motor neurons,包括RMED、RMEV、RMEL和RMER)中,尤其是在线虫头部。而CdTe/ZnS量子点主要分布在肠道中,没有在RMEs运动神经元中观察到CdTe/ZnS量子点的荧光信号,表明ZnS涂层可以防止CdTe量子点穿过肠屏障并转移到RME运动神经元中。
线虫的排泄系统由4种独特的细胞类型组成,它们参与渗透/离子调节。当排泄系统受损时,线虫会因过量的液体膨胀而迅速形成“杆状”致死表型,很容易识别[13]。排便是在神经系统的控制下,并通过节律性激活肌肉收缩循环来实现[14]。Wu等[8]研究发现,长期暴露于浓度为5~20 mg·L-1的CdTe量子点,显著降低了线虫的泵吸率,增加了线虫的平均排便周期,可观察到线虫肠道内脂肪存储量增加。Wu等[11]通过检测氧化石墨烯量子点与大肠杆菌(EscherichiacoliOP50,E.coliOP50)在线虫体内的共定位,发现氧化石墨烯量子点暴露第8天时,可以在成年线虫的前部区域和后部区域,尤其是尾部的排便结构区域,观察到氧化石墨烯量子点与OP50的共定位和OP50的非正常过度积累,推断的线虫的正常排便行为可能受到了石墨烯量子点干扰。
进入到生物机体内的量子点还可能进一步进入并在细胞内环境中分布和聚集。Wang等[15]的研究表明,一些量子点可以进入临近的肠细胞,到达细胞内溶酶体并被其保留,并且量子点大小差异似乎并不影响量子点的亚细胞定位。
1.3 量子点在机体内的代谢和排泄
随着暴露时间的延长,量子点可以在消化系统中积累,并在消化微环境中整合新陈代谢。Qu等[3]的研究表明,由于内部硒的氧化作用,CdSe/ZnS量子点降解,发生荧光猝灭,导致有毒金属离子(Cd和Se)的释放。Xu等[16]在研究中同样观察到碳量子点在线虫体内的荧光猝灭现象。Tian等[17]的研究表明,CdSe量子点随细菌被摄入后,从口腔、咽部腔、肠道最终到达线虫的直肠,部分量子点从线虫的肛门中排出。量子点暴露6 h后,肠腔中的量子点明显增多;暴露12 h后,量子点在肠道内腔中变得更加丰富,研究者同时观察到CdSe量子点向Se和Na2SeO3的部分转化。在此过程中,一些分散的量子点甚至进入到了邻近的肠细胞。
2 量子点对秀丽隐杆线虫的主要毒性效应(The main toxic effects of quantum dots on Caenorhabditis elegans)
根据量子点进入生物体后的分布和情况,研究者预测量子点可能对线虫的多个组织系统产生毒性效应。得益于多种分子生物学技术和转基因线虫的应用,量子点导致线虫毒性效应的分子调控机制也能得到很好的研究。将线虫用于量子点毒性研究的相关规划总结在图1中。
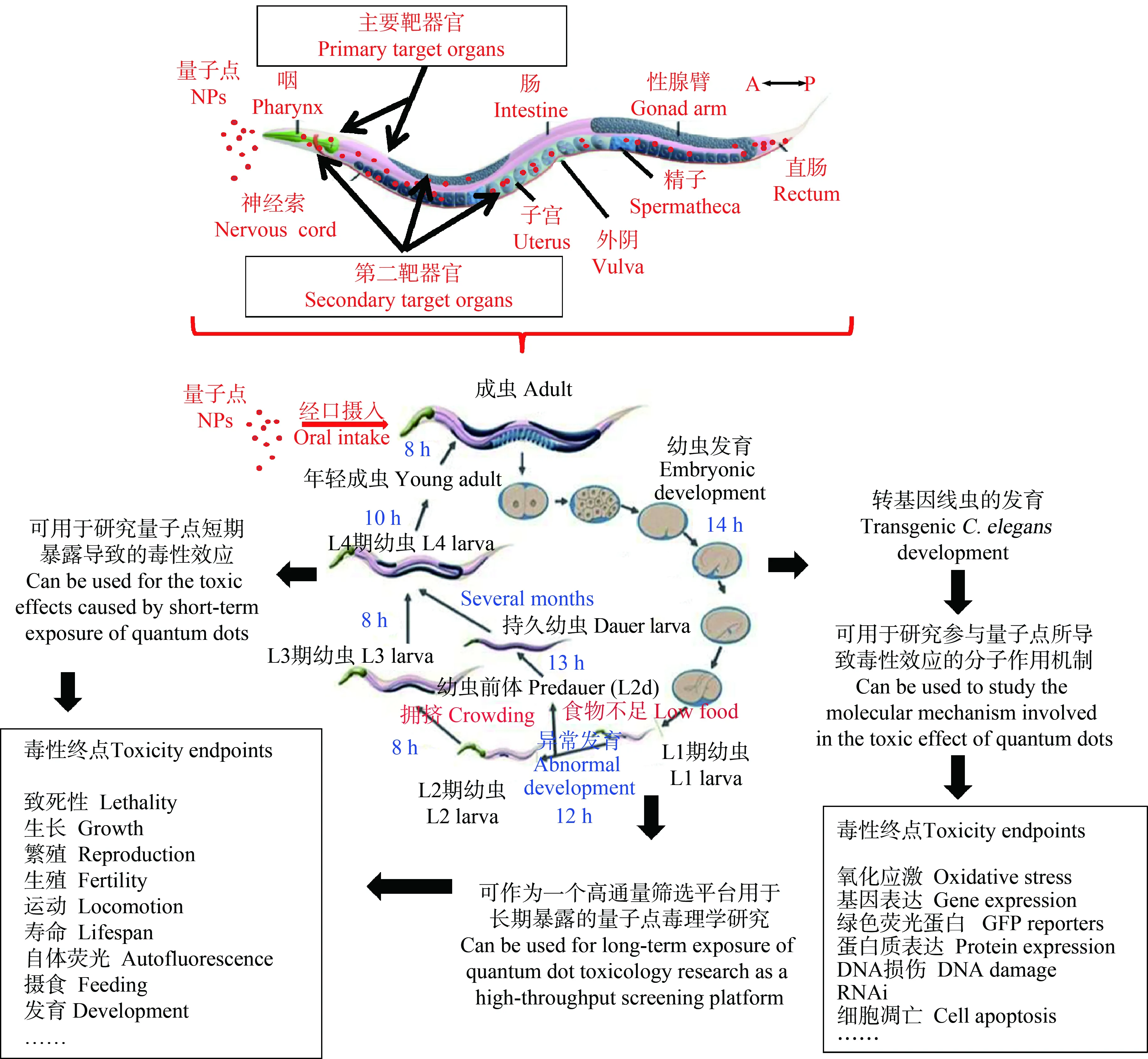
图1 将秀丽隐杆线虫应用于量子点(QDs)毒理学研究的示意图Fig. 1 Schematic diagram of using nematodes C. elegans in the toxicology study of quantum dots (QDs)
2.1 肠道毒性
肠屏障是线虫阻止某些二维碳基工程纳米材料进入线虫的次要靶向器官的重要生物屏障。Liu等[18]的研究表明,当线虫暴露于氧化石墨烯量子点时,肠道屏障的生理功能状态发生失调。长时间接触氧化石墨烯量子点会导致肠屏障处于高渗透状态,导致平均排便周期长度增加、肠道脂肪增加等病理改变,肠道发育和排便行为所需的基因也会发生改变[2]。氧化石墨烯量子点还能进一步在肠道微绒毛消失的情况下转移到肠细胞中,并分布在细胞内线粒体附近或周围。
2.2 神经系统毒性
成年秀丽隐杆线虫有302个神经元和7 000个突触,属于2个不同且独立的神经系统。Zhao等[12]研究发现,长期暴露于0.001 μg·L-1和0.01 μg·L-1的CdTe量子点不会引起线虫异常的觅食行为,而线虫的觅食行为通常由特定神经元控制。当CdTe量子点浓度增加到0.1 μg·L-1和1 μg·L-1时则诱导秀丽隐杆线虫异常觅食行为的形成。长期暴露于一定浓度的CdTe量子点中可引起RMEs运动神经元的发育和功能障碍。
除了含镉量子点,Zhang等[19]研究发现,氧化石墨烯量子点可以减少线虫寿命,并减缓线虫的运动行为。寿命和运动行为的改变反映了氧化石墨烯量子点对线虫的神经毒性。张从芬等[20]的研究表明,CdS/ZnS量子点暴露对秀丽隐杆线虫的体长、头部摆动以及身体弯曲等生物行为有不同程度的抑制作用。吴添舒等[7]的研究表明,CdTe量子点暴露可以抑制线虫的运动行为、咽泵运动和排便,降低学习和记忆能力,表现出一定的神经毒性。而量子点的神经毒性作用可能与其影响神经递质谷氨酸、五羟色胺和多巴胺的转运体和受体相关。Wu等[11]研究发现,长期暴露于1 mg·L-1氧化石墨烯量子点显著降低了线虫体内控制排便行为的AVL和DVB神经元细胞体的相对荧光强度,并观察到氧化石墨烯量子点与AVL和DVB神经元共定位,推断氧化石墨烯量子点可能对AVL和DVB神经元造成了直接损害,从而导致线虫排便周期的延长。
2.3 免疫系统毒性
秀丽隐杆线虫不存在高等生物的适应性免疫,只能靠先天免疫发挥作用。其中,DBL通路、DAF-2/DAF-16通路、丝裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)通路、Toll样受体(Toll-like receptor, TLR)信号通路以及一系列免疫相关基因构成的复杂的信号网络,调控着线虫的先天免疫[21]。免疫反应的损害为量子点在正常条件下对秀丽隐杆线虫的影响提供了至关重要的基础。Wu等[11]研究发现,慢性氧化石墨烯量子点暴露可诱导编码抗微生物肽的F08G5.6、pqm-1、K11D12.5、prx-11、spp-1、lys-7、lys-2、abf-2、acdh和nlp-29等基因表达水平显著降低,并改变编码p38 MAPK激酶信号转导通路中关键基因的表达,导致线虫对病原体的免疫应答能力下降,从而出现寿命下降等一系列毒性效应。周炎烽[22]研究发现,CdTe量子点可以引发线虫发生细胞自噬,进入秀丽隐杆线虫体内的量子点可以诱导线虫体内形成明显的自噬体,同时上调自噬相关基因、降解自噬底物,表明纳米颗粒诱导自噬的能力与它们对膜状亚细胞结构造成损伤的能力相关。
2.4 生殖系统毒性
线虫分为雌雄同体和雄性,其中,雄性比例极低,一些研究表明量子点的暴露对雌雄同体线虫存在生殖毒性。Hsu等[23]的实验表明,雌雄同体线虫暴露于浓度为1 μmol·L-1的CdSe/ZnS量子点时会导致成虫子宫内胚胎数量增多并出现过早产卵,产卵死亡率上升,增加产卵缺陷表型,其机制可能与量子点破坏了控制线虫产卵活性收缩的特定运动神经元(hermaphrodite-specific neurons, HSNS)相关。Qu等[3]的研究表明,CdTe量子点暴露12 h和3 d时,雌雄同体生殖系统的不同部分通过上皮、基底层或性腺鞘与消化系统和假体分开,与鞘细胞相比,量子点很容易穿透上皮,因此在性腺中几乎没有观察到量子点。但是长期暴露16 d时,大量量子点转移并积聚在子宫和外阴,对卵造成一定的损伤,导致野生型雌雄同体线虫的繁殖力下降。这说明,量子点慢性暴露依然存在生殖毒性。Qu等[10]的实验表明,排除CdTe量子点释放出的Cd离子造成的影响后[24],长期暴露于CdTe量子点颗粒(≥50 mg·L-1)会导致野生型线虫生殖能力缺陷,生殖细胞的增殖和分化失调,减数分裂异常,受精卵的生成和排出减少,育雏量和产卵率下降,导致卵子发生失衡。Contreras等[25]研究了暴露于CdTe和CdTe/ZnS量子点中的秀丽隐杆线虫的多代适应性和耐受性。与溶解的Cd暴露相比,未涂覆的CdTe量子点暴露会对秀丽隐杆线虫产生类似的急性影响,例如寿命缩短和育雏尺寸减少,而未观察到CdTe/ZnS量子点的影响。在研究量子点暴露对雄性线虫的生殖系统影响时,Qu等[3]观察到在量子点短期暴露时,雄性线虫外阴增大,可能导致其在交配过程中性腺无法正常受精。
2.5 细胞毒性作用
多年来的毒理学研究已经明确了CdTe量子点的细胞毒性[26],而进入到线虫体内的量子点同样有可能导致生物机体内细胞的损伤。Wang等[15,27]的实验结果表明,量子点破坏了线虫肠道细胞的内吞循环和营养储存功能,可能是导致秀丽隐杆线虫的生长状态恶化和寿命缩短的主要原因。量子点暴露诱导了线虫细胞自噬体形成、自噬相关基因上调和自噬底物降解[27],并且观察到大量的内体聚集,内体聚集的严重程度与生长抑制和寿命缩短的严重程度一致,这表明量子点对秀丽隐杆线虫发育和寿命的毒性可能是由细胞内吞作用的破坏引起的[15]。根据暴露后肠道脂滴数量的变化,发现量子点可以导致严重的营养剥夺,这可能是抑制线虫生长激素分泌的最终原因[15]。
3 量子点导致秀丽隐杆线虫毒性的调控机制(The regulatory mechanism of the toxicity of Caenorhabditis elegans caused by quantum dots)
秀丽隐杆线虫作为一种良好的模式生物,对环境毒物敏感性较高,且具有生命周期短、实验操作便捷等优点,近年来被用于研究包括量子点在内的多种纳米材料的毒性响应机制。其中,主要的毒性机制包括氧化应激损伤、影响细胞自噬、离子通道门控改变损伤、影响分子信号通路、炎症反应损伤和重金属离子释放导致的毒性等。
3.1 氧化应激损伤
氧化应激损伤是量子点诱导秀丽隐杆线虫毒性的重要机制之一,当生物体受到外来刺激产生的大量自由基不能被及时清除时,体内的氧化还原平衡被打破,未被清除的活性氧簇(reactive oxygen species, ROS)会对细胞大分子和细胞功能产生严重损伤。研究表明,ROS造成的氧化损伤最早作用于细胞内线粒体,使其结构和通透性被破坏,进而导致细胞出现损伤[28]。
3.2 细胞自噬
自噬是细胞降解的重要生物学过程,电镜分析表明秀丽隐杆线虫也具有自噬的生物学功能,且该功能在线虫的生长发育、延长寿命、调控程序性细胞死亡、调控神经退行性疾病等多方面起着重要作用。
目前,量子点已经被发现具有诱导细胞自噬的能力。Wang等[15]通过基因水平的实验发现碳量子点能够引起线虫的自噬反应。代慧[33]通过RNA干扰(RNA interference, RNAi)实验证实了氧化石墨烯诱导的线虫自噬过程。此外,虽然正常细胞的自噬可能导致一系列严重的健康伤害,但是量子点诱导细胞自噬的能力提示了其在抗肿瘤和癌症治疗等方面具有一定的应用价值。Chen等[34]通过小鼠实验证实氧化石墨烯量子点可以加速肿瘤细胞的死亡以抑制肿瘤发展。钟文英等[35]通过细胞实验证实CdTe量子点可作为自噬增敏剂用于逆转肿瘤细胞的耐药性,为增强已有药物的药效提供了新的思路。
3.3 离子通道门控改变
离子通道的正常开放与关闭是机体正常生命活动的重要基础,其中,钙离子既参与细胞的分化又介导细胞的死亡过程,控制多种生命活动;而钠离子通道在神经系统的正常运转中发挥着重要作用,是兴奋细胞中动作电位的重要生理基础。
唐明亮[36]采用钙成像等实验方法发现了量子点的急性暴露可以长时间提高细胞内钙水平,最终导致细胞坏死和凋亡。此外全细胞膜片钳的实验结果也显示,在量子点的刺激下,Ca2+既可以通过钙通道进入胞内,也可以通过钠通道流入胞内,再加上另一部分通过钠通道流入胞内的Na+,共同使得神经系统失调。
3.4 影响分子信号通路
磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B, PI3K-Akt)信号通路和MAPK信号通路均参与突触可塑性,且与炎症反应和细胞凋亡密切关。Zhang等[37]通过体外细胞培养的实验发现,CdTe量子点可以通过激活PI3K-Akt信号通路进而促进细胞凋亡。郝明路[38]通过分子、细胞核动物实验综合分析发现,疏基丙酸修饰的CdTe量子点可以诱发细胞凋亡,这与MAPK信号通路的激活密切相关。此外,通过对大鼠海马体进行转录组测序得出的PI3K-Akt信号通路和MAPK信号通路只是目前已经被证实的信号通路[39],并不排除Toll样受体通路中存在其他与量子点毒性作用效应相关的信号通路。
3.5 释放重金属离子
目前广泛使用的半导体量子点通常含有如Cd、Hg和As等重金属成分,且在紫外光照射等因素作用下会释放出游离的重金属离子,因而重金属离子释放也是量子点产生毒性的重要机制之一。Derfus等[40]的实验研究表明,被硫基乙酸修饰的CdSe量子点可以释放Cd2+,进而导致肝细胞死亡。此外,最新的研究发现,硫化物源可通过清除自由基的方式以抑制量子点中重金属离子的释放,并起到缓解细胞毒性的作用[41]。
4 量子点对秀丽隐杆线虫毒性大小的影响因素(Factors affecting the toxicity of quantum dots to Caenorhabditis elegans)
4.1 染毒浓度和染毒时间
近年来,多项实验结果表明,染毒浓度与量子点浓度有着直接的关系且细胞的活性随着CdTe量子点浓度的增加而逐渐降低[39]。此外,在相同实验条件下,细胞活性也随着染毒时间的增加而逐渐下降[39]。
4.2 尺寸和粒径大小

4.3 表面电荷
有研究表明量子点的表面电荷同样会影响细胞的活性,Feswick等[42]通过模拟纳米颗粒在不带电、带正电荷和带负电荷的3种CdTe/ZnS量子点暴露下的吸收情况,发现带负电荷CdTe/ZnS量子点暴露下的纳米颗粒吸收程度更大。
5 总结与展望(Conclusion and prospect)
秀丽隐杆线虫作为体内模型已经成功地应用于评估量子点的潜在毒性,但是鉴于线虫本身特色和纳米毒理学的复杂性,应用秀丽隐杆线虫进行量子点毒理学研究的优势以及局限性总结在表1中。总体来说,量子点的毒性大小与量子点的暴露方式、尺寸和修饰材料、表面电荷息息相关,此外,在评估秀丽隐杆线虫中量子点的生物安全性时,需要考虑一些关键因素。在进行遗传分析时,重要的是选择2个或更多个候选物作为参考基因,其可以为秀丽隐杆线虫中的纳米毒理学研究产生更可靠的结果。总体而言,使用秀丽隐杆线虫模型作为多重灵活平台不仅用于监测量子点的体内结果,而且还用于模拟体内环境。秀丽隐杆线虫的研究结果提供了有助于了解量子点潜在风险的信息,特别是在环境水平上。不仅仅是量子点,其他纳米材料的毒性也将以秀丽隐杆线虫为模型获得更加确切的体内毒性评估结果。

表1 应用秀丽隐杆线虫进行ODs毒性研究的优劣势Table 1 The strengths and weaknesses of applying nematodes C. elegans in studying toxicity of QDs
◆

