磷酸三苯酯经miRNA介导的人肝细胞脂类代谢干扰作用
何春桃,严骁,付惠玲,庄僖,郑晶,*,麦碧娴,杨中艺,于云江
1. 中山大学农学院,深圳 518107 2. 生态环境部华南环境科学研究所,国家环境保护环境污染健康风险评价重点实验室,广州 510530 3. 湖南工学院安全与环境工程学院,衡阳 421002 4. 中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广州 510640
磷酸三苯酯(triphenyl phosphate, TPhP)是在多溴联苯醚(polybrominated diphenyl ethers, PBDEs)限制使用后的重要替代阻燃剂,作为Deca-BDE的替代剂被广泛应用于电子产品中。环境调查指出TPhP广泛存在于水体、空气与室内灰尘等环境介质中[1-2],在人发等生物样品中也存在较高检出[3]。TPhP具有神经毒性[4]、发育毒性[5]等多种生物毒性,其中,TPhP的脂类代谢干扰作用受到广泛关注。过去研究指出TPhP作为过氧化物酶增殖激动剂受体γ(peroxisome proliferation active receptor gamma,PPARγ)的潜在配体,能激活PPAR信号通路,并改变脂类代谢通路相关基因的表达水平[6]。已有研究报道TPhP暴露能够引起前脂肪细胞的脂质积累效应[7]。然而,TPhP经microRNAs (miRNAs)对PPAR信号通路的调控作用目前仍为空白。
过去研究发现环境污染会诱导人体白细胞、呼吸道上皮细胞和胃等不同组织中miRNA表达水平发生改变[8-10]。Wang等[11]发现全氟辛烷磺酰基化合物暴露能够使大鼠肝脏中调控PI3K/AKT信号通路的miR-451表达下调,调控细胞凋亡、DNA损伤修复和促癌基因激活等通路的miRNAs表达上调。部分污染物的暴露会使影响生物中负责某一功能的多个miRNAs的表达改变,如四氯二苯并-p-二噁英(tetra-chloro-dibenzo-p-dioxins, TCDD)暴露下胎鼠胸腺细胞中负责细胞凋亡调控的多个miRNAs(如let-7e、miR-18b、miR-23a、miR-181c等)均表达下调,说明细胞凋亡是TCDD暴露下miRNA调控介导的主要毒性作用[12]。鉴于miRNA在环境压力响应过程中发挥的重要调控作用,miRNA作为环境污染物暴露的潜在生物标志物的可行性日益受到关注[13]。然而针对环境污染物暴露对miRNAs表达调控作用的研究仍然比较匮乏。
肝脏是有机污染物解毒的重要场所,也是污染物暴露的毒害靶器官。因此,肝脏相对于其他器官对污染物的敏感性更高,对于污染物的肝脏毒性研究是污染物毒性评价的重要范畴。本研究将通过探讨不同TPhP暴露条件下人肝细胞miRNAs表达的改变情况,明确人肝细胞对TPhP的应答机制、筛选潜在的TPhP暴露风险生物标志物。
1 材料与方法(Materials and methods)
1.1 试验材料
磷酸缓冲盐溶液、1640基本培养基、胎牛血清、胰蛋白酶及抗生素(penicillin/streptomycin)均购自Gibco(Invitrogen,美国),二甲基亚砜(dimethyl sulphoxide, DMSO)购自Sigma-Aldrich (Poole,英国)。6孔细胞培养板、96孔细胞培养板、15 mL无菌离心管等细胞培养器皿购自康宁公司(中国);细胞计数板购自达科为生物技术有限公司(中国)。试验溶剂均为HPLC级纯,购自Sigma-Aldrich(Poole,英国)。
1.2 细胞培养与处理
人肝正常细胞(HL-7702(L-02))购自武汉普诺赛生命科技有限公司(中国)。L-02细胞系是普通人肝上皮细胞转化而来的稳定细胞系,相对于常用的肝癌细胞系,其细胞形态更接近于普通人肝上皮细胞,适用于对TPhP胁迫下人肝细胞miRNA响应特征的研究。细胞培养于含10%胎牛血清的1640完全培养基中(37 ℃、5% CO2)。细胞以30%的密度接种后,次日进行细胞染毒。替换细胞孔内旧培养液为不同浓度TPhP(TPhP溶解于DMSO,总体积不超过培养基总体积0.5%)的新培养基。细胞活性检测试验中,L-02细胞接种于96孔细胞壁,处理时间为48 h,TPhP处理浓度为0.5、2、5、10和20 μg·mL-1,设置溶剂对照组(V(DMSO)∶V(培养基)=0.5∶100)、对照组(无处理)和空白(未接种细胞),每个处理设4个重复,细胞活性检测重复2次。用于TPhP检测和miRNA提取的细胞接种于6孔培养板中,设置对照组(V(DMSO)∶V(培养基)=0.5∶100)、TPhP(5 μg·mL-1)暴露3 h和48 h,分别为CK、TPhP-3 h和TPhP-48 h,每个处理设置4个重复。
1.3 细胞活性检测
细胞活性采用Cell Counting Kit-8(CCK-8)(Donjido,日本)试剂盒进行检测,按照说明书进行操作。孵育结束后,用多功能酶标仪测定在450 nm处的吸光值。细胞活力的计算公式如下:
细胞活力=[(As-Ab]/(Ac-Ab)]×100%
式中:As为试验孔(含有细胞的培养基、CCK-8和有机污染物)的吸光值,Ac为溶剂对照孔(含有细胞的培养基、CCK-8和DMSO)的吸光值,Ab为空白孔(不含细胞和毒性物质的培养基、CCK-8)的吸光值。
1.4 TPhP检测
样品提取与检测参考Su等[14]的方法,培养结束后,收集培养基与细胞,分别加入1 mL甲醇于50 ng TPhP-d15内标至样品中,对细胞样品超声提取30 min。转移提取液至新的离心管中,样品提取后用氮吹仪吹干,重新定容于300 μL甲醇后,经0.22 μm聚四氟乙烯(polytetrafluoroethylene, PTFE)膜过滤后待进样。
样品定量采用三重四极杆液相色谱质谱联用仪(triple quadrupole LC/MS/MS mass spectrometer of API 4000+, AB Sciex Instruments)进行分析,色谱系统采用Agilent 1260 G1311B-1进样泵与Agilent 1260 G1316A-1柱温箱。以甲醇作为流动相A,水作为流动相B,以流速0.3 mL·min-1洗脱目标化合物。质量控制采用DMSO处理组作为对照组,设置溶剂组作为流程空白组,TPhP在对照组与空白组均低于检出限。以TPhP-d15作为内标进行回收率矫正。TPhP清除率检测计算公式如下:
TPhP清除率=(cspiked-cremained)/cspiked
式中:cspiked为处理前TPhP的总量(μg),而cremained为处理结束后培养基与样品中TPhP的量(μg)。
1.5 miRNA测序与生物信息学分析
细胞RNA和miRNA的提取参照Allprep组织/细胞RNA/DNA/Protein/miRNA分提试剂盒(RN36,艾德莱,中国)说明书进行。含miRNA的总RNA用Agilent 2100 BioAnalyzer (Agilent 2100 RNA 6000 Nano kit)检测RNA样品完整性与浓度后用于cDNA文库构建。cDNA文库构建用T4 RNA ligase先后在miRNA 3’端与5’端加上接头。利用反转录随机引物和反转录酶合成cDNA第一链。通过两端的接头引物进行PCR扩增,对PCR产物进行分离纯化,并进行质量检测。在Illumina HiSeqTM2000测序平台上进行单末端测序程序(SE50),得到50 bp的单端测序reads。
测序获得每个样品的原始测序数据(raw reads),按照测序质量对这部分raw reads进行过滤。去除低质量(包括存在5’端接头污染的、缺乏3’端接头序列或包含polyA/T/G/C、没有插入片段等情况)的reads。过滤后的数据为miRNA的tag序列。对miRNA的tag序列进行注释。鉴定样品中的miRNA的tag序列组成,将tag序列比对到人类基因组、genebank、Rfam数据库、外显子的内含子、重复序列和已知的miRNAs中,并在此基础上对tag进行分类注释。按照优先级rRNAetc > exist miRNA > exist miRNA edit > known miRNA > repeat > exon > novel miRna > intron的顺序对tag序列进行分类,tag没有比对上任何的注释信息的标记为unann,其中注释为miRNA前体的miRNAs用mir命名,如mir-16。对各个样品所鉴定的miRNAs计算TPM(tags per million)作为其表达量,最终获得各样品全部miRNAs的表达谱,并在此基础上对miRNAs进行表达差异进析。样品间miRNAs表达量变化2倍以上并且P值<0.05的差异表达miRNAs为差异显著。采用Mireap (https://sourceforge.net/projects/mireap/)、Miranda(http://www.microrna.org/-microrna/home.do)和Targetscan(http://www.targetscan.org/)[15-16]3个软件根据miRNAs序列信息对差异表达miRNAs进行靶基因预测,取三者预测结果的交集作为miRNAs靶基因预测的最终结果。对差异表达的miRNAs的靶基因进行GO功能聚类分析和KEGG Pathway分析。对预测的miRNAs靶基因与转录组差异表达基因进行比对,预测靶基因与差异表达基因的交集为差异表达miRNAs的潜在调控对象,进一步对差异表达miRNAs与差异表达基因的表达量进行Pearson相关性分析,筛选获得相关系数>0.9的miRNA-靶基因对[17],使用Cytoscape software(http://www.cytoscape.org/)构建miRNAs与差异表达基因的关系网络图。
1.6 荧光定量PCR
cDNA合成及荧光定量PCR采用All-in-one miRNA qRTPCR detection Kit (GeneCopoeia,美国),参照说明书操作。荧光定量PCR所涉及的基因与引物购自All-in-one miRNA qRTPCR detection Kit(GeneCopoeia,美国)。每个样品每个基因设置3个技术重复,采用Roche LightCycler480实时荧光定量PCR仪(Roche,德国)及其配套软件对目标基因表达进行相对定量,各目标基因相对表达量以目标基因表达量/U6表达量表示。
1.7 数据统计与分析
本试验数据采用SPSS 18.0(SPSS, Inc.)进行统计分析。数据正态分布检验采用Shapiro-Wilk非参数方法,不符合正态分布的统计数据在计算前进行对数转换。单因素方差分析(One-way analysis of variance, ANOVA)用于比较不同处理浓度中细胞活性的差异。Pearson’s相关性检验转录组测序与荧光定量PCR的基因表达情况进行相关性分析,置信水平为P=0.05,置信区间取95%。
2 结果(Results)
2.1 TPhP胁迫条件下细胞活性差异
在48 h处理条件下,TPhP染毒后,人肝细胞细胞活力随着浓度上升呈先上升后下降的趋势,在5 μg·mL-1处理条件下达到最大值,并在10 μg·mL-1处理浓度下明显下降。而在20 μg·mL-1处理条件下,细胞活力受到显著抑制(P<0.05),仅为26.3%,半数效应浓度(EC50)为15.25 μg·mL-1(46.7 μmol·L-1)(图1)。
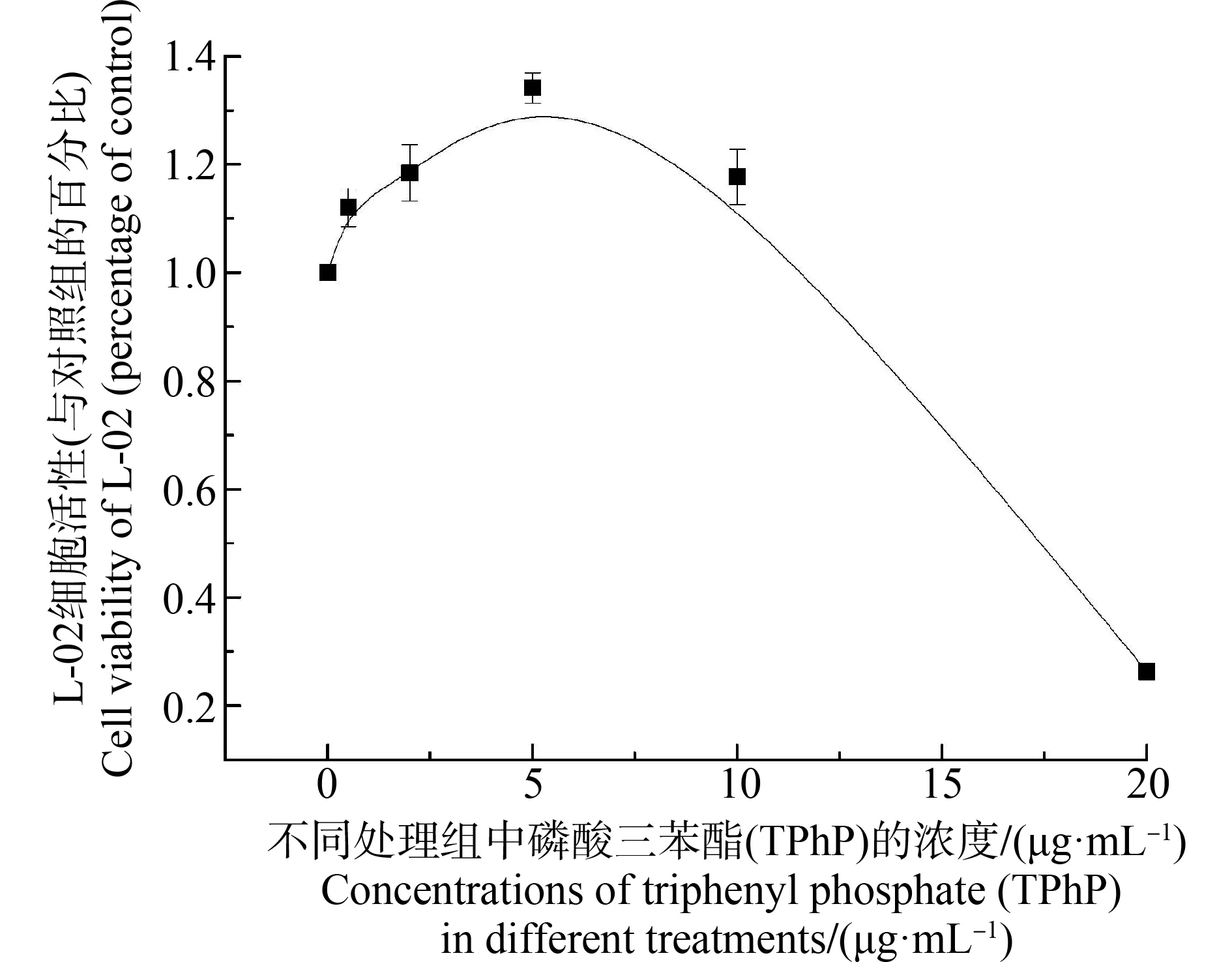
图1 在48 h后不同浓度磷酸三苯酯(TPhP)处理组中人肝细胞的存活率曲线Fig. 1 Survival curves of hepatocyte after 48 h triphenyl phosphate (TPhP) treatments of different concentrations
2.2 TPhP胁迫3 h与48 h后TPhP含量分析
在5 μg·mL-1TPhP暴露3 h和48 h后,处理体系中人肝细胞与培养基中残留的TPhP总量如图2所示,培养基中的TPhP总量显著高于细胞(P<0.05)。在肝细胞暴露3 h后,细胞中的TPhP总量为0.08 μg,培养基中TPhP总量为1.23 μg,培养体系中清除率为73.9%。肝细胞暴露48 h后,细胞中的TPhP含量显著上升,而培养基中的TPhP含量显著下降(P<0.05)。细胞中的TPhP总量为0.14 μg,培养基中TPhP总量为0.60 μg,培养体系中清除率为85.1%。
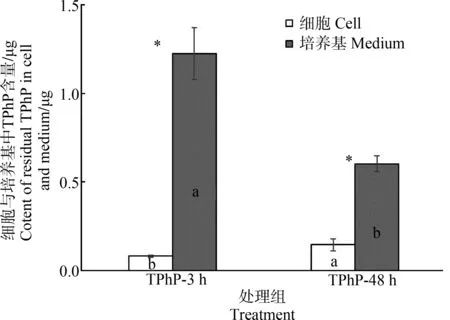
图2 暴露3 h和48 h后不同TPhP处理组中细胞与培养基中TPhP的含量注:*代表相同处理下细胞与培养基中的TPhP含量差异显著,小写字母代表细胞或培养基中不同处理组的TPhP含量差异显著。Fig. 2 The contents of residual TPhP in hepatocyte and medium after different TPhP treatment for 3 h and 48 hNote: *represents the significant difference between the TPhP contents in hepatocyte and medium under the same treatment while the different letters represent the significant difference between different treatments for hepatocyte or medium.
2.3 差异表达miRNAs的表达趋势与富集
以定量PCR的方法检测9个随机选取的差异表达miRNAs的表达情况,以验证microRNA-Seq测序结果。相关性分析表明,同一样品在microRNA-Seq与qPCR的表达情况显著相关(r2=0.8068)(图3),说明microRNA-Seq的表达结果可靠。
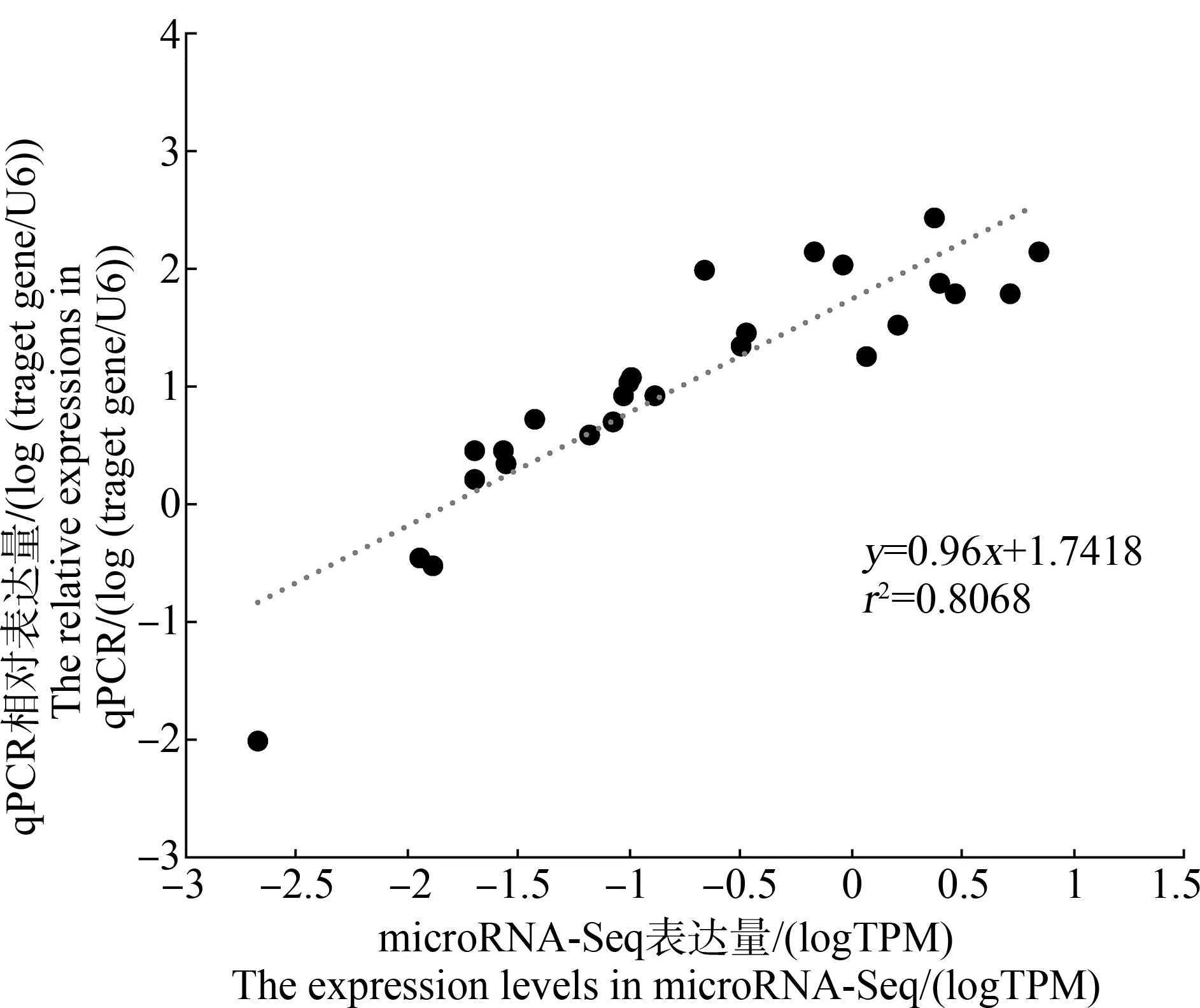
图3 microRNA-Seq与qPCR中miRNAs表达结果的相关性Fig. 3 The correlation between miRNAs genes’ expression assessed by microRNA-Seq and qPCR
为了初步分析不同样品miRNAs表达的变化情况,对样品中表达量TPM>1的差异表达的miRNAs进行趋势分析(图4),在CK、TPhP-3 h及TPhP-48 h这3个样品中差异表达的miRNAs显著富集于2个趋势(profile 3和profile 5)。其中,富集于profile 3的差异表达miRNAs共有72个,表现为在3 h与对照组无显著差异,在48 h暴露后表达显著下降。富集于profile 5的差异表达miRNAs共118个,在3 h暴露后显著上升,而在48 h暴露后与对照组无显著差异。其他差异表达miRNAs的富集表达趋势包括保持平缓后上升、上升后保持平缓、持续上升、下降后保持平缓及持续下降,富集均不显著。

图4 差异表达miRNAs在3个不同处理时间的主要富集趋势Fig. 4 Differential expressed miRNAs significantly enriched in patterns across three time points
通过GO分析发现,profile 3中miRNAs所调控的靶基因主要分布于细胞内部(intracellular part)、细胞质(cytoplasm)、细胞液(cytosol)和细胞器(organelle)中;所参与分子功能以结合活性为主包括离子结合(ion binding)、酶结合(enzyme binding)、蛋白质结合(protein binding)及DNA结合(DNA binding)等,另外也具有酶调节活性(enzyme regulator activity)及转移酶活性(transferase activity)等催化功能;富集于profile 3的miRNAs调控的靶基因主要参与了生物合成(biosynthesis)、代谢过程(metabolic process)、生物调节(biological regulation)、信号转导(signal transduction)、刺激响应(response to stimulus)、细胞分化(cell differentiation)等生物过程(图5)。富集于profile 5中的miRNAs所调控的靶基因除了分布于profile 3中富集的细胞内部(intracellular part、intracellular)、细胞质(cytoplasm)、细胞液(cytosol)及细胞器(organelle)几种细胞组分,也显著富集于细胞质膜泡囊(cytoplasmic membrane-bounded vesicle)、高尔基体(Golgi apparatus)及细胞核(nucleus)等细胞组分,可能参与蛋白质分泌等功能。所参与分子功能与profile 3中miRNAs的靶基因类似,包括离子结合(ion binding)、酶结合(enzyme binding)、蛋白质结合(protein binding)等结合活性、酶调节活性(enzyme regulator activity)、分子功能调节(molecular function regulator)等调节功能及转移酶活性(transferase activity)、激酶活性(kinase activity)、连接酶活性(ligase activity)等催化功能;所参与生物进程与profile 3类似,以生物合成(biosynthesis)、代谢过程(metabolic process)等生物进程为主。

图5 显著富集于profile 3(P3)和profile 5(P5)的差异表达miRNAs的靶基因的GO富集显著情况(P value)Fig. 5 The P value of significantly enriched GO term for target genes of miRNAs from profile 3 (P3) and profile 5 (P5)
Profile3与profile 5富集的miRNAs的靶基因显著富集的通路相似,包括代谢通路、生物合成通路及癌症相关的通路。生物合成通路包括类固醇合成(steroid biosynthesis)、萜类骨架生物合成(terpenoid backbone biosynthesis)、脂肪酸生物合成(fatty acid synthesis)等,其中类固醇的生物合成是profile 3所富集的miRNAs靶基因的主要富集通路。此外,脂肪细胞因子信号通路(adipocytokine signaling pathway)、Jak-STAT信号通路、ErbB信号通路、胰岛素信号通路(insulin signaling pathway)及Hedgehog信号通路(Hedgehog signaling pathway)等信号通路也是富集于profile 3趋势的miRNAs所调控的靶基因富集通路(表1)。

表1 Profile 3与profile 5差异表达miRNAs靶基因KEGG通路富集情况Table 1 Significantly enriched KEGG pathways for target genes of miRNAs from profile 3 and profile 5
2.4 脂类代谢相关的miRNA-mRNA关联分析及调控网络
miRNAs以抑制或降解等形式对靶基因进行负调控,对差异表达miRNAs与其关联差异表达基因进行关联分析能够从miRNA水平上探索TPhP对miRNAs与基因表达调控网络的影响。结合差异表达miRNAs的靶基因富集通路与差异表达基因富集通路分析可知[17],TPhP胁迫条件下,类固醇合成等脂类代谢通路相关基因的转录组表达水平改变受到miRNAs的调控作用。多个miRNAs通过调节脂类代谢相关的基因表达影响脂质合成。胰岛素信号通路、PPAR信号通路、脂肪酸代谢、类固醇合成等与脂类代谢相关的差异表达显著的关键基因受到多个miRNAs的调控,miRNA-靶基因对约160对。而miR-4484-y、miR-34c-5p、miR-301a-5p和miR-7-5p分别对脂质代谢相关通路中5个关键基因具有显著的调控关系。关联分析结果显示,PPAR信号通路中,PPARα与PPARγ这2个核受体、ACSL(long-chain acyl-CoA synthetase)、CYP27A1(cytochrome P450 family 27 subfamily A member 1)、HMGCS1(3-hydroxy-3-methylglutaryl-CoA synthase 1)和SCD(stearoyl-CoA desaturase)等参与脂肪酸合成过程,类固醇合成通路中的CYP51A1(cytochrome P450 family 51 subfamily A member 1)、DHCR7(7-dehydrocholesterol reductase)、LSS(lanosterol synthase)和MSMO1(methylsterol monooxygenase),以及胰岛素信号通路中影响脂类平衡的ACACA(acetyl-CoA carboxylase/biotin carboxylase)、PRKAA2(5’-AMP-activated protein kinase)等基因均受到一个或多个miRNAs调控(图6)。

图6 脂类代谢相关的miRNA-mRNA调控网络注:绿色和蓝色的节点为miRNAs,粉色、橙色和红色的节点分别为参与胰岛素信号通路、类固醇合成通路及PPAR信号通路的靶基因。Fig. 6 The miRNA-RNA regulation network of lipid metabolismNote: The green and blue nodes represent the differential expressed miRNAs; the pink, orange and red nodes represent target genes involved in insulin signal pathway, steroid synthesis pathway and PPAR signal pathway respectively.
3 讨论(Discussions)
从人肝细胞在不同浓度TPhP暴露下的细胞活性变化可知,低浓度TPhP胁迫不会引起人肝细胞的凋亡。在5 μg·mL-1的处理条件下,细胞活性存在轻微的上升,可能与PIK3CD(phosphatidylinositol-4,5-bisphosphate 3-kinase catalytic subunit)参与的Jak-STAT signaling pathway信号通路所介导的细胞凋亡与增殖过程的调控作用相关。中国仓鼠细胞在TPhP处理24 h后计算的50%最大抑制效应浓度(50% of the maximal inhibitory effect concentration, IC50)为37 μmol·L-1[18]。Su等[14]对鸡胚胎细胞开展的TPhP毒性研究中,鸡胚胎肝细胞在TPhP处理36 h后,LC50为(47±8) μmol·L-1,与本研究中人肝细胞以TPhP染毒48 h后的LC50剂量基本一致,高于TPhP对中国仓鼠细胞的细胞毒性的IC50。这可能与2种肝细胞对于TPhP的代谢会降低其毒性有关。而高浓度TPhP存在明显的急性细胞毒性,LC50基本在40 μmol·L-1左右,意味着对其开展环境监测的必要性。
由3 h和48 h细胞内残留TPhP总量可知,人肝细胞对TPhP的代谢效率较高。TPhP在人肝细胞微粒中和S9的肝微粒组分中孵育1 h后,清除率分别为41%(其他磷系阻燃剂清除率为7%~81%)和19%(其他磷系阻燃剂清除率为13%~68%)[19],相对于其他磷系阻燃剂,TPhP代谢速率处于中等水平,略高于磷酸三(2-氯乙基)酯和磷酸三(2-氯丙基)酯。鸡胚胎肝细胞对TPhP暴露36 h后,TPhP清除率高达99.8%[14],远高于本研究中48 h处理组的TPhP清除率,这种差异可能与细胞的不同物种来源有关。值得注意的是,TPhP在鸡胚胎肝细胞的代谢特征显示,在12 h暴露后细胞与培养基中的TPhP总量相当(46%/53%),在36 h处理后所有残留的TPhP均存在于细胞中[14]。这与本研究中随着处理时间延长,TPhP在细胞中分配比例逐渐加大的趋势相一致。由此我们推测在体外试验的细胞培养体系中,细胞的TPhP吸收速率高于其代谢速率并引起细胞中的TPhP积累,随着胁迫时间的延长,细胞中的TPhP可能逐渐完全清除。
TPhP暴露条件下,差异表达的miRNAs靶基因主要富集于profile 3 (TPhP胁迫48 h后表达下降)和profile 5(在TPhP胁迫3 h表达上调,而在48 h后表达与对照组一致)。2个趋势的靶基因主要富集于类固醇合成与脂类代谢有关的功能与通路,意味着脂质代谢干扰是TPhP对miRNAs调控的主要毒性。而过去的研究指出斑马鱼在7 d的TPhP暴露后,其肝脏脂类代谢基因表达异常,血液中葡萄糖、甘油三酯、胆固醇和高密度脂蛋白胆固醇等指标显著上升[20]。TPhP对斑马鱼胚胎的脂类代谢干扰作用通过对PPAR信号通路途径的调控实现[21]。骨髓基质细胞BMS2细胞系在在10 μmol·L-1的TPhP暴露7 d后,脂质积累显著增加,并可能是潜在的PPARγ激活剂[6]。虽然过去研究在体外试验与动物试验中均发现了TPhP的脂类代谢干扰作用,但是这个过程中是否存在miRNAs的参与及其所扮演的角色尚不明确。过去的研究已鉴定了多个与脂类代谢相关的miRNAs[22-23],而本研究也发现多个已报道脂类代谢相关的miRNAs,如miR-34c、miR-301a和miR-7。作为介导TPhP脂类代谢干扰的主要靶位点,PPAR主要受miR-34c调控,与本研究中miR-34c差异表达对PPAR信号通路中ACSL和DHCR7的表达调控作用相似,与过去文献报道中miR-34c能够通过调控ACSL1的表达水平参与小鼠的肝脏纤维化相一致[24]。而miR-301a对胰岛素信号通路中ACACA及PRKAA2这2个基因具有调控作用则与miR-301a在糖尿病及胰腺癌的发生发展过程具有调控作用的调控功能相类似[25-26]。miR-7对神经质瘤、乳腺癌及肝癌的发生有着重要作用,Fang等[27]通过筛选发现,PIK3CD是miR-7的调控靶基因,miR-7的过表达会导致PIK3CD表达显著下调,而且影响PI3K/Akt信号转导。本研究中miR-7对PIK3CD的表达同样具有显著负调控关系,而PIK3CD所参与的胰岛素信号通路能对下游脂肪酸合成过程中数个关键基因的表达水平具有调控作用,从而对脂类平衡产生影响。与上述3个脂类代谢相关的miRNAs不同,针对miR-4484脂类代谢调控作用的研究并不多。Zhang等[28]发现乳腺导管乳腺癌与乳腺管内头状瘤病人分泌乳汁中的miR-4484的表达水平存在显著差异,miR-4484可作为潜在的乳腺癌指示物。Byun等[29]发现,miR-4484对于口腔炎症反应具有重要调控作用,并且是口腔扁平苔藓疾病的潜在miRNAs生物标志。受结核杆菌H37Ra株系感染的巨噬细胞THP-1中,miR-4484的表达相对于未感染细胞显著上调约20倍,对于预测结核杆菌感染情况具有重要参考意义[30]。然而本研究中miR-4484对ACACA、ACSL和SCD等参与了脂肪酸/类固醇合成代谢通路基因的调控作用是首次报道。除了已知miRNAs,本研究鉴定的novel-m0022-5p等新miRNAs对类固醇合成通路中的LSS、PPAR信号通路中的PPARγ和CYP27A1具有调控作用,novel-m0323-5p则对胰岛素信号通路中的ACACA、PPAR信号通路中的ACSL4及类固醇合成通路中的MSMO均有调控作用。但是在此前的研究尚未对这些新miRNAs功能开展研究,其具体调控机理仍待探讨。
本研究通过关联分析发现的脂类代谢相关的miRNA-mRNA调控关系与过去的研究有所差别。miR-122被认为是肝脏中表达丰度最高的miRNAs,其表达能够调控肝脏FASN(fatty acid synthase)、ACACA及SCD等一系列脂肪酸合成酶的基因表达[31]。但是在本研究中,miR-122表达水平偏低,并且与FASN、SCD等基因的表达水平无显著相关。与miR-122的情况类似,miR-378/378*能够通过调控FABP-4(fatty acid-binding protein)、FASN和SCD-1等脂质代谢相关基因影响脂肪细胞的脂质积累[32],然而在本研究中miR-378在不同处理间差异表达并不显著。过去针对脂类代谢调控的miRNAs主要关注人体在自然条件下高胆固醇疾病的情况对miRNAs及脂类代谢的影响,与本研究中TPhP暴露所引起的脂类代谢干扰有所差异。稀有鮈鲫肝脏在TPhP暴露14 d后参与类固醇合成的HGMCoA与FASN酶活显著高于对照组并引起胆固醇的积累,然而其差异诱导的miRNAs靶基因主要富集于代谢通路[33],与本研究中差异表达miRNAs主要富集于PPAR信号及其下游脂类代谢通路的情况并不一致。我们推测,本研究所发现的差异表达miRNAs可能特异性地在早期胁迫下通过调控PPAR信号通路,加强类固醇合成相关通路基因的表达,并在长期胁迫中表达恢复正常表达水平,预示着miR-4484和novel-m0022-5p等miRNAs作为潜在的生物标记对于TPhP早期暴露指示具有可行性。
miRNAs在疾病发生过程中发挥重要调控作用,同时也是多种疾病的潜在生物标记物[34]。随着miRNAs在环境污染物暴露过程中所发挥的调控作用的深入,miRNAs作为环境污染物暴露生物指示物的可行性受到关注[35]。本研究发现在TPhP暴露条件下,人肝细胞miR-4484、miR-3617和miR-7等miRNAs受TPhP诱导差异表达,并调控多个参与脂类代谢过程的目标基因,预示着这些miRNAs是TPhP暴露条件下潜在的敏感生物标记。然而,在生物体中,miRNAs的表达除了受到环境污染物的影响,还受到生物体年龄、生活习惯和身体健康情况等多个因素的影响,miRNAs直接作为人群对环境污染物暴露健康风险评价的生物指示物准确度有待提高。因此,通过进一步系统研究,上述对TPhP暴露诱导的脂类代谢具有调控作用的差异表达miRNAs将有可能应用于环境中污染物典型的潜在生物标志物,为指示环境污染对生物体健康情况的影响提供参考。
◆

