基于脂类代谢的DHFR—CHO细胞培养过程开发与优化
蒋金龙 范里 谭文松

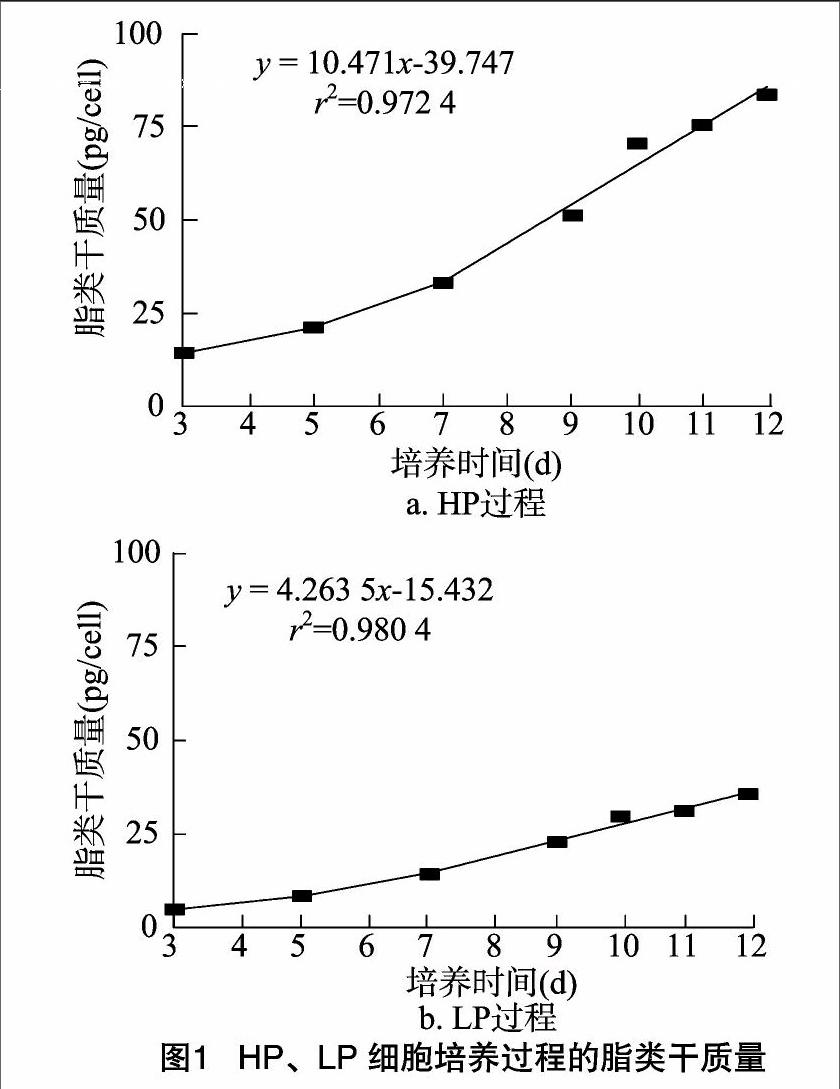
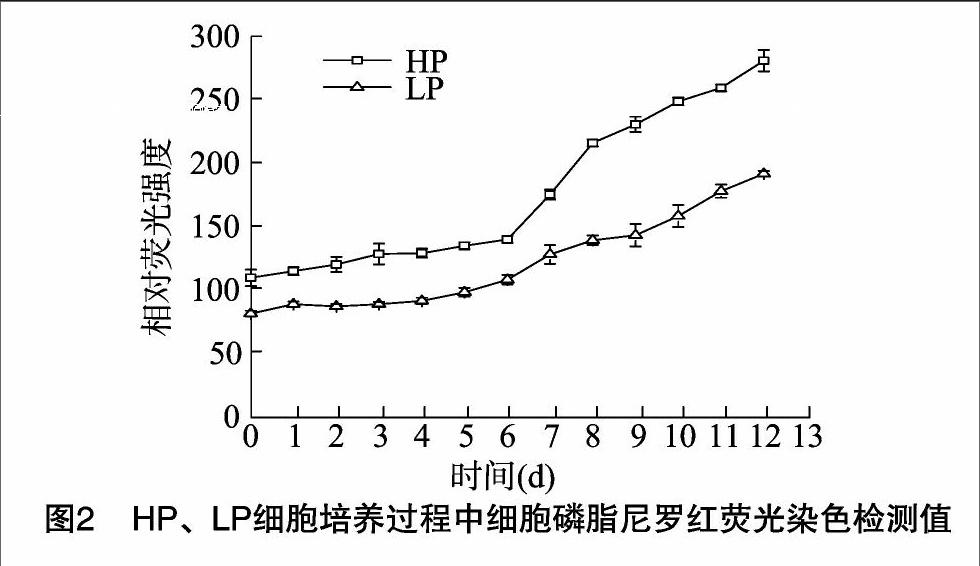
摘要:通过对抗体高产(HP)、低产(LP)2个细胞培养过程进行研究发现,2个过程中脂类代谢差异明显。结果表明,HP中脂类干质量远大于LP过程,且其增速也较快,HP中最大脂类干质量达到(83.70±0.04)×10-9mg/cell,是LP的2.35倍;进一步通过细胞磷脂尼罗红荧光染色检测细胞磷脂含量发现,HP、LP细胞培养过程中细胞磷脂差异显著;随后对3种重要磷脂——磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(Ps)的合成前体A(氯化胆碱)、B(乙醇胺)、C(丝氨酸)、D(胞苷)4种因子通过2水平全析因试验设计进行分析,发现组分A对细胞生长、抗体表达影响极显著(P<0.01);最后通过正交试验对培养基中组分A进行浓度优化,以找出基础培养基和流加培养基中组分A的最适浓度。结果发现,基础培养基中组分A最优浓度为95.38 mg/L,流加培养基中最优浓度为189 mg/L;最终活细胞密度对时间累积积分(IVCC)达到79.16×109cells·d/L,提高了74.29%;抗体产量为2.04g/L,增加了1.83倍;抗体比生成速率为34.07 mg/(109 cells·d),提高了18.71%。基于脂类代谢分析,建立了高效经济的细胞培养过程,并为培养基的优化提供了依据,可为后续大规模单克隆抗体工业化生产奠定基础。
关键词:脂类;细胞生长;DHFR-CHO;单克隆抗体;中国仓鼠卵巢细胞
中图分类号:S188;Q952.6 文献标志码:A 文章编号:1002—1302(2016)01—0032—04
随着单克隆抗体药物市场的迅速发展,以及对单克隆药物要求越来越高,对于利用动物细胞培养技术生产单克隆抗体药物来说既是机遇又是挑战。如何在保证细胞高密度培养的同时生产出高产量、高质量的单克隆抗体,将成为细胞培养技术的重点研究课题。作为细胞培养的关键技术环节,培养过程和培养基的开发、优化尤为关键。脂类作为细胞膜、线粒体膜等构成的生物膜系统的主要组成部分,对于保证细胞及亚细胞结构的完整性和生物活性有着极其重要的作用,细胞正常运转和存活的先决条件就是这些亚细胞结构具有独立的空间。抗体的合成、分泌需要线粒体提供合成原材料和能量,内质网提供合成场所和相关酶,分泌则与高尔基体有关。Sakai等在研究脂对产hIFN-γ的CHO细胞在无血清培养基中产量的影响时发现,加入磷脂酸(磷脂合成前体)使重组蛋白hlFN-γ产量提高了2.4倍。
为此笔者通过检测抗体产量差异显著的高产(HP)、低產(LP)细胞培养过程中细胞脂类、细胞磷脂含量,进一步通过对几种关键磷脂前体[A(氯化胆碱)、B(乙醇胺)、C(丝氨酸)、D(胞苷)]的2水平因子设计析因试验,发现磷脂合成前体组分A对细胞生长、抗体表达有显著影响。最后分别在基础培养基、流加培养基中设计4个添加浓度梯度进行正交试验,考察了基础培养基、流加培养中组分A浓度对细胞生长、抗体表达的影响,确定了基础培养基、流加培养基中组分A的最佳添加浓度。基于脂类代谢的研究开发高效细胞培养过程,可为抗体的大规模生产、培养基优化和工艺优化提供有力的理论基础和数据支持,对于单克隆抗体工业化发展和其他动物细胞培养生产单克隆抗体药物工业化具有重要意义。
1材料与方法
1.1细胞株
试验所用细胞株为表达单克隆抗体的DHFR-CHO细胞株。
1.2培养基
基础培养基:传代、种子细胞培养基为商业无血清培养基Hycell(购自Thermo Scientific);试验所用培养基为笔者所在实验室自主开发的无血清培养基XP1-CM15。使用的基础培养基根据试验要求配制。
流加培养基:采用笔者所在实验室自主研发的无血清流加培养基,主要含有葡萄糖、维生素、氨基酸、磷酸盐、金属离子等物质的浓缩液。
1.4.3细胞组成测定 细胞脂类含量、细胞干质量均采用Xie等的方法测定。
1.4.4细胞磷脂测定 采用GENMED细胞磷脂尼罗红(Nile)荧光染色试剂盒测定,收集100万个细胞,1500 r/min离心5 min,弃上清,加入500μLPBS清洗2遍。具体操作参照说明书。
2结果与分析
2.1高产、低产细胞脂类、磷脂检测
本试验选取抗体产量差异较大的2个细胞培养过程进行检测,其中抗体产量高的产量达到了1.59g/L,是抗体产量低的3倍。分别在培养3、5、7、9、10、12 d检测抗体产量差异明显的2个细胞培养过程中脂类干质量。由图1可以看出,随着培养时间的延长,HP、LP细胞脂类含量一直增加;HP脂类含量明显高于LP,最高脂类含量是LP的2.35倍;在抗体合成阶段,HP的脂类合成速率是LP的2.43倍。结果表明,在抗体合成差异明显的细胞培养过程中,其细胞脂类含量差异明显。
在HP、LP细胞培养过程中,通过细胞磷脂尼罗红荧光染色试剂盒检测细胞磷脂含量。由图2可见,随着培养时间增加,细胞磷脂含量一直增加,HP细胞磷脂含量明显高于LP,其最大磷脂含量是LP的1.46倍;在抗体合成阶段(从培养6 d到结束),HP磷脂合成速率是LP的1.32倍。说明在抗体合成差异明显的细胞培养过程中,细胞磷脂合成差异明显。
综上可知,在抗体产量差异明显的HP、LP细胞培养过程中,细胞脂类代谢(磷脂代谢)表现出明显差异。Sakai等研究也发现,脂类物质在细胞生长和抗体表达中有重要作用,如细胞磷脂可作为细胞信号分子介导调控多种细胞生长增殖,促进抗体表达分泌。推测磷脂在细胞生长、抗体表达中有显著影响,因而进一步对3种重要磷脂的合成前体组分A(氯化胆碱)、B(乙醇胺)、C(丝氨酸)、D(胞苷)进行析因分析。
2.2 2水平因子设计试验
试验选取3种重要磷脂(磷脂酰乙醇胺、磷脂酰胆碱、磷脂酰丝氨酸)合成前体A、B、C、D 4种试验因子,采用高(1)、低(-1)2个水平浓度进行2水平全析因试验设计,进行主效应因子析因试验。表1为2水平全析因试验设计,以IVCC、抗体产量为响应值。可以看出,4种因子对细胞生长的IVCC值影响差别不大,但对抗体产量的影响差异明显。根据方差分析(表2)可知,组分A的P值<0.01,说明组分A为极显著影响因子。图3为2水平因子设计试验残差的正态分布。点越偏离图中的线,说明影响效应越显著。可以看出,4种因子中只有组分A为显著影响因子。
2.3组分A对细胞生长、抗体表达的影响及浓度优化
通过在基础培养基(0~200 mg/L)、流加培养基(0~756 mg/L)中分别设计4个浓度两两正交来考察组分A对细胞生长、抗体表达的影响,并搜寻出组分A的最优浓度。试验设计见表3。
从表4、图4可以看出,在培养0~10 d期间,细胞生长大致一样;但在培养10、12 d的2 d内,A1(基础培养基、流加培养基中均没有添加组分A)细胞密度迅速下降,细胞大量死亡,从5.32×106 cells/mL降低到0.26×106 cells/mL,下降了95.11%。
除A1外,在其余試验中细胞生长差异不大,说明细胞前期生长可能对胞外组分A的需求不大或者不需要胞外组分A;但从培养10 d开始,由于组分A的缺失,导致细胞开始表现出不能正常生长增殖,因此对细胞后期生长维持来说,组分A是不可或缺的,此时必须有组分A的补充。
随着组分A浓度的增加,细胞生长差异不大,但对抗体表达、抗体比生成速率却有明显的影响。从图4中可以看出,抗体产量最高的是C2处理(基础培养基中组分A添加浓度为100 mg/L,流加培养基中组分A添加浓度为189 mg/L)。抗体产量高于1g/L的处理大部分集中在中间(B、C 2组),A组(除A2、A3处理外)、D2组产量较低,特别是在D组,其抗体产量普遍偏低,说明当组分A浓度不足或过高时,对细胞抗体表达是有抑制作用的。
通过计算分析,最终得出基础培养基中组分A最优浓度C0pt=95.38 mg/L,流加培养中组分A最优浓度C′0pt=189 mg/L。
2.4组分A最优浓度验证
在2 L生物反应器中对组分A的最优浓度进行验证,从图5可以看出,在最优浓度条件下,细胞最高活细胞密度达到7.16×106 cells/mL,细胞后期维持也比较好,到培养结束时,活细胞密度仍有4.78×106cells/mL,细胞活性仍在80%以上,细胞IVCC达到79.16×109 cells·d/L。抗体表达非常理想,最高抗体产量达到2.04 g/L;抗体表达阶段qAntibody达到34.07 mg/(109cells·d)。与之前流加培养基没有添加组分A的反应器细胞培养相比,细胞IVCC是其1.74倍,抗体产量是其2.83倍,qAntibody是其1.19倍。
3结论
利用动物细胞培养技术大规模开发高产的单克隆抗体药物,已经成为当今生物制药的主流,具有强劲的市场竞争力。但是抗体类药物开发成本高、周期长,远不能满足日益增长的市场要求。基于细胞代谢研究,比较抗体表达差异显著的2个细胞培养过程,分析培养过程中有显著差异的物质代谢,考察培养过程中脂类对细胞生长、抗体表达的影响并优化培养基中脂类合成前体浓度。结果表明:(1)抗体表达差异显著的2个细胞培养过程中,细胞脂类含量(磷脂含量)差异显著,通过2水平全析因试验,最终发现磷脂合成前体组分A对抗体表达具有显著影响。(2)当培养基中缺乏组分A浓度,细胞生长受到较大影响,当培养至10 d时细胞密度急剧下降,死细胞大量增加;培养到12 d时,细胞成活率已降为50%以下;随着组分A浓度的进一步增加,细胞生长所受影响不大。(3)适当提高组分A浓度对抗体表达具有明显促进作用,当基础培养组分A浓度为95.38 mg/L时,流加培养基中组分A添加浓度在189 mg/L时,IVCC提高了0.74倍,抗体产量提高了1.83倍。
本研究基于脂类代谢的研究,建立了高效的细胞培养过程,实现了培养基营养成分的合理设计和浓度优化,为细胞培养基的开发和优化提供了一种新的方法和依据,对后续抗体类药物大规模生产具有重要意义。

