微囊藻毒素及其与其他环境污染物的联合毒性研究进展
万翔,薛庆举,顾毓蓉,谢丽强,*
1. 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,南京 210008 2. 中国科学院大学,北京 100049
由于人类活动的加剧,特别是化工、医药和农药等生产工业的迅速增长,导致生活用水量和工业用水量迅速增加,同时造成污染物的产量和种类不断增加,当这些携带多种污染物的水体进入湖泊等地表水后,引起了多种严峻的水环境污染问题,最终造成了水体复合污染的特征[1]。一方面,富营养化和气候变化加剧了蓝藻水华在全球淡水生态系统的不断扩张,蓝藻水华的大规模暴发及其产生的蓝藻毒素已经成为很多国家面临的主要的水环境问题[2]。另一方面,水生态系统正在面临着多种其他有毒污染物的环境问题,目前受关注较多的有重金属、持久性有机物污染物以及各种新型污染物等[3-4]。在众多蓝藻毒素类型中,由于微囊藻毒素(microcystins, MCs)具有肝毒性且可促进肿瘤的活性,它被认为是最普遍且毒性最大的一种藻类毒素[5]。在大量蓝藻衰亡期间,高浓度的MCs与其他环境污染物共存于水环境并可能发生相互作用,进一步影响彼此在生物体内的转化代谢和毒性效应,甚至对生物造成更严重的毒性作用。因此,环境污染物的毒性研究不能仅局限于传统单一污染物急性毒理学研究所得到的结果,而应更多地关注多种污染物在环境相关浓度暴露下生物体在组织、细胞和分子水平上的响应[6-7],研究MCs与共存环境污染物复合污染的生态效应是完善蓝藻水华风险评价的重要环节。
1 微囊藻毒素的产生和危害(The production and hazards of microcystins)
MCs可以由多种蓝藻产生,主要包括微囊藻(Microcystis)、鱼腥藻(Anabaena)、颤藻(Oscillatoria)、念珠藻(Nostoc)、束丝藻(Aphanizomenon)和浮丝藻属(Planktothrix)等。MCs是由7个氨基酸组成的单环七肽,它的结构如图1所示。由于X和Y这2个位置的氨基酸可以由不同的氨基酸组成,因此目前已发现超过200种不同构型的MCs[8],而当X和Y这2个位置分别由亮氨酸(Leu)和精氨酸(Arg)取代时,构成了水体中最为常见的MC-LR。由于MCs的环状和间隔双键的结构特性,在自然水体中,它的物理化学性质都相对稳定,且传统的水处理方法不能有效地去除MCs,因此MCs的存在对饮用水的安全构成了潜在的威胁[9]。
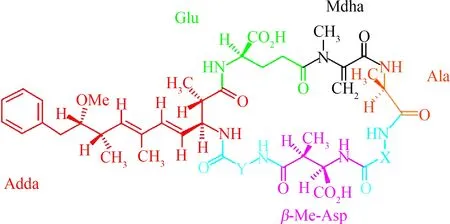
图1 微囊藻毒素的通用结构体Fig. 1 The chemical structure of microcystins
MCs主要以胞内毒素形式存在,但是当大量藻细胞死亡衰败时,胞内MCs也会释放到水体中,对水生生物和人体健康造成潜在的威胁。近20年来,国内外因MCs引起的水生动物、鸟类和畜类甚至人类染毒事件频繁发生[10-13]。MCs的致毒机理有多种,其中MCs对真核生物的最主要的机理是其能够强烈并特异性地抑制丝氨酸和苏氨酸蛋白磷酸酶1和2A的活性,进一步引起细胞内蛋白磷酸化和去磷酸化的失衡,最终导致细胞蛋白的过磷酸化[14]。此外,MCs还能够引起生物体活性氧的(reactive oxygen species, ROS)的大量增加,导致脂质过氧化,甚至会造成DNA损伤和细胞凋亡[15-16]。通常人类暴露于MCs的主要途径包括皮肤接触、饮用受MCs污染的水源以及摄食了富集MCs的水产品,如鱼类和贝类等[17]。人体接触含MCs的水会出现皮肤过敏、眼睛不适等症状,长期饮用受MCs污染的水会导致肠胃炎、糖尿病等疾病的患病率增加,甚至诱发肝癌[18-20]。我国东南沿海地区高原发性肝癌发病率被证实与长期饮用含MCs的水有关[21]。MCs引起的最严重的人类中毒事件发生在1996年的巴西,由于当地的一个血液透析中心的透析液被蓝藻毒素污染,最终导致126例患者出现亚急性肝脏毒性症状、约60例患者死亡的严重事故[22]。2014年夏季,北美五大湖之一的伊利湖暴发严重的蓝藻水华,饮用水源被蓝藻毒素污染,导致邻近该湖的美国俄亥俄州托莱多市遭遇停水危机,美国俄亥俄州及密歇根州约40万居民受影响[23]。因此,为了保障饮用水安全,世界卫生组织(WHO)针对成人推荐的饮水中的MC-LR标准限值为1.0 μg·L-1,人均摄入MC-LR的限值为0.04 μg·kg-1·d-1[24]。
2 微囊藻毒素的污染现状(Current status of microcystins contamination)
2.1 水体
MCs在全球淡水水体中广泛分布(表1)。我国是一个湖泊众多的国家,然而富营养化和蓝藻水华的问题十分突出。一些大型湖泊中均能普遍检出MCs的存在,其中我国太湖、巢湖和滇池MCs含量水平较高。Su等[25]于2013—2014年对我国太湖的研究发现,太湖胞内MCs(IMCs)最高可达10.93 μg·L-1,其中MC-LR和MC-RR是主要的毒素异构体。余丽等[26]对我国巢湖研究发现,巢湖IMCs和胞外MCs(EMCs)分别为0.12~6.45 μg·L-1和0.69~1.92 μg·L-1,MC-RR和MC-LR比例较高。Wu等[27]调查了我国滇池EMC-LR的含量,其最高浓度可达1.02 μg·L-1。我国通江湖泊鄱阳湖也检测到MCs的存在,其中IMCs和EMCs最高可达2.30 μg·L-1和1.22 μg·L-1[28]。Xue等[29]研究发现,我国洪泽湖MC-LR的最高含量可达0.08~1.25 μg·L-1。万翔等[30]在我国洱海的研究表明,洱海各个湖湾均普遍检出MC-LR,其胞内最高含量达2.17 μg·L-1。此外,夏季蓝藻水华高发季,MCs在我国长江中下游等诸多淡水湖泊、水库中均能普遍检出[31]。国外蓝藻水华引起的MCs污染问题同样十分普遍。日本Suwa湖IMCs和EMCs最高分别可达184 μg·L-1和3.61 μg·L-1[32]。Loftin等[33]于2007年对美国全国1 161个湖泊调查发现,其中32%的点位均能检出MCs,其平均浓度能达到3.0 μg·L-1。Orihel等[34]对加拿大246个水体、405个点位调查分析发现,41%的湖泊已经超过WHO推荐的饮用水中MC-LR的浓度限值1 μg·L-1,其中检出的IMCs浓度最高达到2 153 μg·L-1。Frank[35]对德国西南的众多湖泊调查发现,其中25个湖泊IMCs最大值超过10 μg·L-1,而其中某湖泊IMCs甚至高达566 μg·L-1。印度MCs污染问题尤为突出,Singh等[36]对印度2个严重富营养的湖泊调查发现,Sankuldhara湖的IMCs最高可达39.60 μg·L-1,而Lakshmikund湖的IMCs水平更高,最高可达126.24 μg·L-1。可以看出,大多数淡水系统中MCs通常低于10 μg·L-1,但是当大量蓝藻死亡时,水体中的MCs也能达到mg·L-1的级别[5,37],这将对水生态系统以及人类健康造成严重的威胁。

表1 全球部分水体中微囊藻毒素(MCs)的最大含量比较Table 1 A comparison of the maximum microcystins (MCs) concentration in some water bodies worldwide
2.2 沉积物
水华暴发后期,水体中的大量蓝藻会下沉进入沉积物中,从而在沉积物中度过漫长的冬季休眠期[38],不少研究也发现沉积物中存在MCs的污染。总体而言,相比于水体中MCs分布、归趋的研究,沉积物中MCs的相关工作开展相对较少。一般而言,蓝藻水华频繁暴发的水体,沉积物中MCs含量也相对较高。Chen等[39]调查发现,我国太湖梅梁湾表层沉积物中MCs含量随深度增加而降低,MCs的含量在20.4~168.1 ng·g-1之间。Jiang等[40]对我国上海淀山湖研究发现,淀山湖沉积物中MCs含量呈逐年升高趋势,近年其含量已高于4 000 ng·g-1。国外的一些水体沉积物中也有报道MCs的检出,Zastepa等[41]对加拿大7个地理条件相似、营养级不同的湖泊研究发现,富营养化程度越高的水体,沉积物中MCs含量也越高,含量介于10~829 ng·g-1之间。Efting等[42]对美国3个湖泊研究发现,MC-LR最早在1832年已被发现,MC-LR的含量范围为2~226 ng·g-1。土耳其某水源地沉积物中检出的MC-YR含量于7.0~17.6 μg·g-1之间[43]。沉积物中MCs的来源除了水体中沉降的蓝藻之外,最近的研究发现多种底栖蓝藻也会产生MCs[5],因此,开展对底栖蓝藻群落的研究将有助于我们了解MCs在沉积物中的归趋行为。
3 微囊藻毒素单一毒性及其与其他污染物共存的联合毒性(Single toxicity of microcystins and its combined toxicity with other pollutants)
鉴于MCs在水环境中的广泛分布,不少学者开展了MCs与其他环境污染物对不同生物体的联合毒性的研究,然而相关研究主要以浮游动物和鱼类等水生生物为受试体,缺乏对其他水生生物以及陆生生物的研究。从污染物的组合上看,包括MCs联合其他蓝藻代谢物、农药、重金属、不同形态氮和其他有毒物质。在表2中综述了MCs与其他环境污染物的联合毒性以及联合毒性相互作用的类型。

表2 MCs与其他污染物的联合毒性Table 2 Combined toxicity of MCs and other environmental pollutants
3.1 对水生生物的影响
3.1.1 浮游动物
浮游动物是水生态系统的初级消费者,它们往往因为直接摄食有毒蓝藻而受到毒害作用。MCs对溞等浮游动物的急性毒性及对其生活史影响的研究已有不少报道,研究发现纯化的MC-LR对不同枝角类蚤状溞(Daphniapulex)和大型溞(Daphniamagna)的48 h半致死浓度(48 h-LC50)在6.5~20.3 mg·L-1不等[46-47],MCs对溞的毒性作用与溞的种属、生长时期密切相关。此外,研究发现相比纯化的MCs,环境浓度的产毒藻类对Daphniamagna表现出的毒性更强,这可能是由于蓝藻产生的其他代谢物(比如脂多糖类、多肽和生物碱等)的作用及其与蓝藻毒素的相互作用[48]。环境浓度的MCs或蓝藻水华暴露的研究表明,MC-LR能够显著推迟拟同形溞(Daphniasimiloides)首次怀卵和产卵时间以及导致总产卵数的减少[49],然而,Yang等[50]研究发现,10~300 μg·L-1的MC-LR对短钝溞(Daphniaobtusa)首次怀孕和产卵时间均没有显著影响,因此不同溞对MCs的毒性抗性也存在明显差异。Smutná等[48]将大型溞暴露在8种蓝藻水华的野外水体中,发现蓝藻水华对大型溞具有强烈的急性和慢性毒性(抑制繁殖能力)。
随着对蓝藻衍生物危害研究的深入,不少学者发现MCs与蓝藻死亡分解时释放的大量氨氮和亚硝酸盐能够发生相互作用。Cao等[49]研究了氨氮和MC-LR对Daphniasimiloides生活史的复合作用,发现MC-LR的存在可以缩短高浓度氨氮导致的大型溞首次怀卵和产卵时间的推迟。Yang等[50]研究了亚硝酸盐和MC-LR对Daphniaobtusa生活史的复合作用,发现2种污染物仅在溞首次怀卵和产卵时间2种指标上存在相互作用,具体表现为MC-LR的存在能够缓解亚硝酸盐对大型溞造成的生殖毒性。此外,Cerbin等[51]开展了铜绿微囊藻和杀虫剂西维因对Daphniapulicaria生活史的复合作用,发现2种污染物对溞生长和繁殖均表现出显著的负面影响,且2种污染物复合暴露时的抑制作用更明显。Hochmuth等[52]研究了5种有产毒能力的蓝藻和铜(Cu)对大型溞的联合毒性,发现不同蓝藻与Cu的复合暴露对大型溞均没有明显的协同作用,两者复合污染的风险有限。Pires等[53]研究了2种有产毒能力的藻类联合另一种蓝藻代谢物细菌脂多糖(LPS)对盔形溞(Daphniagaleata)生活史的影响,发现LPS与高产毒能力藻类复合暴露能够显著降低溞的标准含碳量,而与低产毒能力藻类复合暴露时未出现上述现象。
3.1.2 鱼类

3.1.3 水生植物和底栖动物
MCs是一种起自我强化机制作用的生态生长调节素,高浓度MCs可以影响水生植物的多样性以帮助产毒蓝藻获得竞争优势直至形成水华[65]。MCs对植物的毒性作用机制主要是其诱导生物体ROS升高引起氧化应激反应。研究发现,高浓度的MC-RR能够显著抑制细长聚球藻(Synechococcuselongatus)的生长,诱导氧化胁迫,导致MDA含量显著升高[66]。此外,已有研究证实水中的MC-LR能够被沉水植物金鱼藻(Ceratophyllumdermesum)、苦草(Vallisnerianatans(Lour.))和狐尾藻(MyriophyllumspicatumL.)吸收,并诱导植株ROS水平和GST活性升高,而GSH在水生植物对MCs解毒过程发挥着重要的作用[67]。类似地,Jiang等[68]的研究也表明,环境浓度的MC-LR亚急性暴露也可以显著诱导苦草叶片ROS产生,造成叶肉细胞超显微结构如叶绿体和线粒体等结构受到损伤,MDA含量显著上升。
相较而言,MCs联合其他污染物对浮游植物的毒理学研究相对缺乏。Contardo-Jara等[69]研究发现,球藻(Aegagropilalinnaei)同时暴露在MC-LR和另一种藻类毒素β-N-甲氨基-L-丙氨酸(BMAA)下,MC-LR能够显著提高球藻对BMAA的吸收,并引起抗氧化酶GST和过氧化氢酶(CAT)的活性升高。Pinheiro等[70]研究了MC-LR和柱胞藻毒素(CYN)对小球藻(Chlorellavulgaris)的联合毒性作用,发现即使高浓度(>37 mg·L-1)单一MC-LR暴露条件下,小球藻的生长速率受到抑制均不显著;但是在与CYN的同时暴露下,较低浓度的MC-LR(0.4~16.7 mg·L-1)却能够显著抑制小球藻的生长。
一些学者开展了MCs联合其他环境污染物对高等水生植物的研究。Wang等[71]研究了MC-LR与线性烷基苯磺酸盐(LAS)复合暴露对浮萍(Lemnaminor)生长和生化指标的影响,发现2种污染物能够协同抑制浮萍的生长,导致叶绿素a浓度降低,以及超氧化物歧化酶(SOD)和GSH增加,但是两者之间协同作用会随2种污染物浓度增加而减弱。而MC-LR与LAS之间协同作用发生的机制可能是LAS改变浮萍细胞膜的通透性,导致生物体对共存污染物MC-LR富集的增加。Wang等[72]进一步研究了MC-LR和Cu复合暴露对沉水植物苦草生长和抗氧化系统的影响,发现两者在低浓度时表现为协同作用,而高浓度时则表现为相加或者拮抗作用,而两者联合毒性的机制可能是因为MC-LR的—O和—N官能团作为配位体与Cu等重金属发生络合反应,从而改变了它们在生物体内的运输方式。Li等[73]开展了2种藻类毒素(MC-LR和anatoxin-a)对苦草的联合毒性研究,发现2种藻类毒素的联合毒性表现为拮抗作用,然而复合暴露能够导致苦草叶片生物膜中微生物群落丰度和结构的更显著的变化。
MCs对底栖动物的单一毒性作用已有很多报道,例如,MCs能够导致底栖动物存活个体的减少、抑制摄食、麻痹、动物行为的改变以及GST和蛋白磷酸酶活性的改变等[74]。而底栖动物同时暴露在MCs与其他环境污染下可能受到更显著的毒害作用。Lance等[75]开展了除草剂草甘膦和产毒蓝藻(PMC 7502)复合暴露对底栖动物静水椎实螺(Lymnaeastagnalis)的联合毒性作用,发现草甘膦促进了椎实螺对MCs的吸收,导致GST活性受抑制更显著,而这种酶对MCs的代谢具有重要作用,因此导致生物体内MCs富集显著增加并表现出更强的毒性。
3.2 对陆生生物的影响
水体中MCs可以通过灌溉、河岸渗滤等途径从而直接对种植的陆生植物的生长造成影响,不少学者开展了MCs对陆生生物尤其是农作物的毒理学研究。MCs可以在生菜、菠菜等蔬菜体内富集并对人类健康造成潜在风险[76],同时,MCs同样能够对陆生植物造成毒害作用,例如造成其产量和质量的下降,导致植物抗氧化酶活性的改变[77]。近期的研究还表明,MCs与重金属的同时暴露能够对陆生植物产生联合毒性,詹晓静等[78]研究了MC-LR和重金属铬(Cr)复合污染对白菜种子发芽的影响,发现不同浓度的2种污染物组合对白菜发芽率均无显著抑制作用,但对白菜种子根伸长和芽伸长存在相互作用,低浓度MC-LR与高浓度Cr组合表现为拮抗作用,而高浓度MC-LR与低浓度Cr组合表现为加和,甚至协同作用。Cao等[79]研究了MC-LR和Cu对生菜(Lactucasativa)的联合毒性作用,发现2种污染物在低浓度下表现为协同作用,复合暴露下生菜体内MC-LR的富集显著增加。此外,Wang等[80]研究了MC-LR与LAS对Lactucasativa种子发芽和幼苗生长的影响,发现LAS可以显著促进生菜对MC-LR的吸收,从而协同抑制幼苗生长,导致SOD、CAT活性的增加。
近年来,有不少研究发现鸟类疑似因为蓝藻毒素而死亡的事件[13],同时还有研究表明,日本鹌鹑(Coturnixcoturnixjaponica)同时暴露在蓝藻毒素、铅(Pb)以及Newcastle病毒等多种胁迫下,会导致鸟类肝脏中MCs的富集水平显著提高,同时诱导鸟类抗氧化和解毒系统响应的更加显著的变化[81-82]。总体看来,由于MCs来源于水体且直接作用于水生生物,相较而言,关于MCs对其他陆生生物(尤其是陆生动物)的单一及联合毒性研究仍然较为缺乏。
3.3 对人类等哺乳动物的影响
迄今为止,很多MCs对哺乳动物的急性毒性研究结果显示,哺乳动物对MCs的抗性远低于鱼类、枝角类等水生动物[65]。此外,长期环境浓度MCs暴露会导致人类脂肪肝和糖尿病等患病风险的增加[20,83]。近期的研究表明,MCs与其他环境污染物以及病毒共同暴露能够增加人类等哺乳动物肝脏损伤的风险。Liu等[84]开展了MC-LR与另外2种肝毒素(黄曲霉毒素、肝炎B病毒)联合暴露的流行病学研究,发现3种肝毒素的联合暴露会提高人群肝脏损伤的风险。Ma等[85]研究了MC-LR、雌二醇和莱克多巴胺3种污染物对肝癌细胞HepG2的联合毒性作用,发现高浓度的3种污染物任意组合均表现为协同作用。邱斐斐和刘冉[86]的研究发现高剂量MCs与甲基硝基亚硝基胍对食管癌EC109细胞的联合毒性表现为协同效应。王红兵等[87]研究发现,MCs单独暴露不能诱发叙利亚地鼠胚胎细胞恶性转化,但可明显促进水体中低剂量有机污染物启动的胚胎细胞恶性转化。
4 总结与展望(Summary and prospects)
笔者通过对文献的总结发现超过半数的研究中MCs与其他环境污染物之间的相互作用表现为协同作用,从而对水环境造成更严重的负面影响。现有的研究表明,水体中的MCs与其共存污染物能够在通过细胞膜过程中发生相互作用;影响生物体与污染物代谢相关酶的活性,进一步影响共存污染物在生物体中的扩散、转化和代谢方式,最终改变污染物的行为和毒性。尽管不少学者开展了MCs联合其他环境污染物对生物体的毒性研究,但是涉及其机制的探讨却相对缺乏。针对目前的研究现状不足,提出以下几点展望和建议。
(1)目前对于MCs与环境污染物对水生生物的联合毒性的研究仍然较为缺乏,而开展多种污染物共存对不同营养级水生生物的影响的研究对于水体复合污染风险评估具有重要意义,因此复合污染的生态毒理效应与机制,尤其是对联合毒性发生的分子机制研究是今后一个重要方向。
(2) 现有的环境污染物风险评价的方法主要是针对单一污染物存在的情况,而多种污染物联合毒性相互作用的评价方法比较缺乏,甚至不同方法评价结果差异较大。另外,复合污染的相互作用与污染物种类和剂量密切相关,且随着复合污染物种类的增加(3种甚至以上),通过开展实验来研究它们的联合毒性和相互作用方式将会愈加困难。因此针对多种污染物的风险评价和定量表征的方法,以及对联合毒性预测模型的开发还有待更深入的研究和发展。
(3)考虑到富营养水体中MCs与其他污染物普遍共存的现状和联合毒性发生的可能性,开发环保、高效的复合污染处理技术对于湖泊等水体复合污染风险综合防控与治理具有重要的意义。
◆

