RTCA与CCK-8法用于检测柴油废气颗粒物致支气管上皮细胞毒性的比较研究
谢文静,凌敏,梁婕,范姿,唐萌,#,卞倩,*
1. 东南大学公共卫生学院,南京 210009 2. 江苏省疾病预防控制中心,南京 210009 3. 南京医科大学公共卫生学院,南京 211166
空气污染是一个日益严重的公共卫生问题,造成在世界范围内超300万人过早死亡,这其中的死因包括肺癌、慢性阻塞性肺疾病等相关呼吸系统疾病[1-2]。柴油废气颗粒物(DEP)是空气污染物重要来源之一,由固体碳颗粒物和灰颗粒、挥发性有机化合物和硫化物组成[3]。有证据表明,DEP与呼吸系统相关疾病发生和肺功能损伤有关[4]。也有研究进一步证实,DEP暴露致细胞线粒体功能[5]及氨基酸转运体过表达[6]等。在受到DEP的外来刺激后,支气管上皮细胞(HBE)是第一道接触屏障,产生细胞毒性,引发炎症反应,甚至对细胞存活率产生影响[7]。因此,在DEP致呼吸系统相关疾病的机制研究中,细胞毒性实验是研究的基础和关键。
在检测细胞毒性的方法中,由于实验易于操作且结果易于标准化,通常将2种常规测定方法用于体外细胞毒性评估:Cell Counting Kit-8(CCK-8)法和实时无标记细胞分析系统(real-time cell analysis system, RTCA)[8]。CCK-8法是一种检测细胞存活和生长情况的经典方法,试剂内的WST-8在电子耦合试剂存在的情况下,可以被线粒体内的一些脱氢酶还原生成橙黄色的甲臜,细胞毒性越大,则颜色越浅,吸光度值越小,对于同一细胞,吸光度值和细胞数目呈线性关系,是常用的检测颗粒物致细胞毒性的传统实验方法。RTCA是一种检测细胞毒性的新技术,是一种建立在阻抗基础上的瞬时细胞电感应连续记录系统,电阻和细胞是否黏附、数量、体积大小及形态变化密切相关,通过检测电阻值进而实时动态监测细胞毒性反应[9-10]。已有文献报道过CCK-8法检测DEP致细胞的毒性[11],但未见RTCA法检测DEP致肺相关细胞毒性的相关报道。在研究细胞毒性机制方面,RTCA克服CCK-8法定时检测的局限,可以实时监测细胞的状态。因此将这2种方法进行比较,分析RTCA是否能替代传统的CCK-8法。
在本研究中,我们探讨了CCK-8检测DEP致支气管上皮细胞(HBE)的细胞存活率的变化,RTCA法检测DEP致HBE细胞在标准化细胞指数(NCI)值变化,比较2种方法检测结果的差异,并用细胞凋亡实验对结果进行验证。比较这2种方法检测DEP致HBE细胞毒性的结果灵敏度,以及适用范围和局限性,这对接下来研究DEP致呼吸系统相关细胞毒性的机制提供基础。同时,比较了2种DEP致HBE细胞毒性的差异,分析产生差异的原因,为后续的机制研究提供支持。
1 材料与方法(Materials and methods)
1.1 药品与试剂
HBE细胞购自中国科学院上海细胞生物学研究所(中国)。柴油废气标准参考颗粒物(货号:Standard Reference Material 1650b (SRM 1650b); Standard Reference Material 2975 (SRM 2975))购自美国国家标准与技术研究院。CCK-8试剂购自上海碧云天公司(中国)。细胞凋亡Annexin V-FITC/PI试剂盒购自南京诺维赞公司(中国)。DMEM培养基、胎牛血清、青霉素和链霉素购自美国Gibco公司。
1.2 仪器设备
RTCA仪器(xCELLigence RTCA,Agilent,美国);酶标仪(SpectraMax Paradigm,Molecular Devices,中国);流式细胞仪(Accuri C6,BD,美国)
1.3 细胞培养及处理
HBE细胞在37 ℃、5%CO2的条件下培养,培养基为含有10%胎牛血清,1%的青霉素和链霉素的DMEM完全培养基。每2天以1∶3的比例传代细胞。实验使用对数生长期细胞。
1.4 DEP悬液制作
将2种DEP标准品SRM 1650b和SRM 2975在高精度微量天平上称重,分别用Hanks缓冲液混悬制成2 g·L-1的储备悬液。将储备悬液超声处理20 min,制备200 mg·L-1的使用悬液。体外细胞刺激实验前,超声处理使用悬液20 min,并用DMEM培养基稀释至不同的染毒浓度,分别是0、3.5、7、14、28和56 mg·L-1。
1.5 CCK-8法检测细胞毒性
用CCK-8试剂进行评估细胞毒性的测定。将HBE细胞以1×105cells·mL-1的细胞密度接种到96孔板中,每孔加入细胞悬液100 μL后,放置在37 ℃、5%CO2的条件下培养24 h。然后吸出孔内培养液,分别加入不同浓度的SRM 1650b和SRM 2975(0、3.5、7、14、28和56 mg·L-1),每孔100 μL,以Hanks缓冲液为对照,分次孵育6、12、24和48 h。每个浓度设置3个复孔。最后,向每个孔中加入10 μL CCK-8,在培养箱内孵育2 h,用酶标仪在450 nm处测定吸光度值。细胞存活率=DEP组吸光度值/Hanks对照组吸光度值×100%。细胞存活率越低,说明DEP对细胞的损伤程度越大。
1.6 细胞种植实验
通过微阵列的电极设计,RTCA测量细胞电极阻抗的变化,将测定的电阻抗实时转化为细胞指数(cell index, CI),在相同培养条件下,电极上的细胞数量越多,则CI值越大,CI值可实时反映细胞生长状态,进而对细胞状态进行定量。在E-Plate孔板中每孔加50 μL培养基,置RTCA仪器上检测基线,确保所有孔的CI均<0.1。在孔中加100 μL充分混匀的不同浓度的细胞悬液,细胞悬液浓度分别为0.6×105、0.8×105、1×105和1.2×105cells·mL-1。将培养板于超净台中静置30 min,转至37 ℃、5% CO2培养箱中的RTCA仪器上,开始检测,每组3个复孔。
1.7 RTCA法检测细胞毒性
在E-Plate的每孔中加50 μL培养基,置RTCA仪器上检测基线。HBE细胞密度为2×105cells·mL-1,每孔加入细胞悬液50 μL接种于E-Plate孔板中。将孔板放置于RTCA检测仪器20~24 h后,分别加入配制好的SRM 1650b和SRM 2975染毒液50 μL,使每孔最终染毒浓度分别为0、3.5、7、14、28和56 mg·L-1,于72 h后停止检测,每组3个复孔。比较各组之间的标准化细胞指数(normalized cell index, NCI)。NCI计算方法为将所有组数据在暴露的时间点的CI值设置为分母,所有的CI值为分子,相除得出的值就是NCI值[12],这可避免各组之间因细胞种板数的差异影响结果。NCI值越低,说明DEP对细胞的损伤程度越大。
1.8 细胞凋亡实验
HBE细胞以1×105cells·mL-1的细胞密度接种到六孔板,每孔加入的悬液体积为2 mL。细胞贴壁后,吸出孔内培养液,分别向每孔加入2 mL的28 mg·L-1SRM 1650b和7 mg·L-1SRM 2975悬液,将HBE细胞暴露其中6 h;加入2 mL的14 mg·L-1SRM 1650b和7 mg·L-1SRM 2975悬液,将HBE细胞暴露其中12 h;加入2 mL的14 mg·L-1SRM 1650b和3.5 mg·L-1SRM 2975悬液,将HBE细胞暴露其中24 h;加入2 mL的7 mg·L-1SRM 1650b和3.5 mg·L-1SRM 2975悬液,将HBE细胞暴露其中48 h。用不含EDTA的胰酶消化细胞,终止消化后收集细胞,进行Annexin V-FITC/PI染色,样品在1 h内用流式细胞仪检测。
1.9 统计学分析

2 结果(Results)
2.1 CCK-8实验结果
分别用0、3.5、7、14、28和56 mg·L-1的SRM 1650b和SRM 2975染毒HBE细胞6、12、24和48 h后,进行CCK-8测定。由图1(a)可知,暴露6 h后,与对照组相比,染毒浓度为56 mg·L-1的SRM 1650b组,测得的细胞活性率低于对照组,差异有统计学意义(P<0.05);暴露12 h和24 h后,与对照组相比,染毒浓度为28 mg·L-1和56 mg·L-1的SRM 1650b组,测得的细胞活性率均低于对照组,差异有统计学意义(P<0.05);暴露48 h后,与对照组相比,染毒浓度为14、28和56 mg·L-1的SRM 1650b组,测得的细胞活性率均低于对照组,差异有统计学意义(P<0.05)。由图1(b)可知,暴露6 h和12 h后,与对照组相比,染毒浓度为14、28和56 mg·L-1的SRM 2975组,测得的细胞活性率低于对照组,差异有统计学意义(P<0.05);暴露24 h和48 h后,与对照组相比,染毒浓度为7、14、28和56 mg·L-1的SRM 2975组,测得的细胞活性率均低于对照组,差异有统计学意义(P<0.05)。
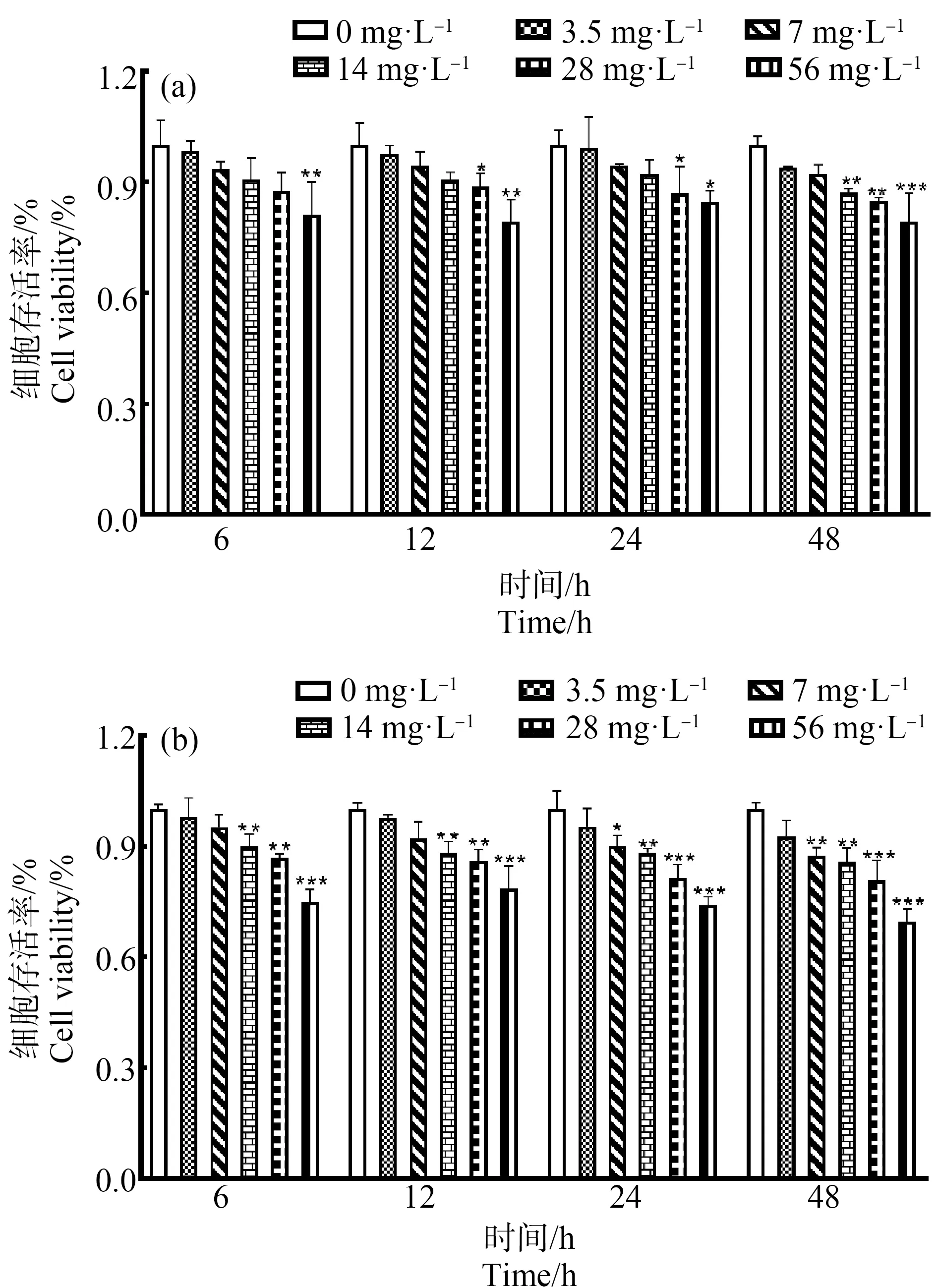
图1 Cell Counting Kit-8 (CCK-8)法检测柴油废气颗粒物(DEP)致支气管上皮细胞(HBE)细胞存活率的变化注:(a)和(b)分别为CCK-8法检测柴油废气标准参考颗粒物(SRM 1650b和SRM 2975)染毒HBE细胞6、12、24和48 h后致细胞存活率变化;*P<0.05,**P<0.01,***P<0.001,与对照相比。Fig. 1 The cell viability of human bronchial epithelial (HBE) cells induced by diesel exhaust particles (DEP) was measured by Cell Counting Kit-8 (CCK-8) assayNote: (a) and (b) show that after DEP Standard Reference Material (SRM 1650b and SRM 2975) induced HBE cells, the changes of cell viability were detected by CCK-8 assay for 6, 12, 24 and 48 h; *P<0.05, **P<0.01, ***P<0.001, compared with the control.
2.2 RTCA实验结果
2.2.1 细胞种植实验
将HBE细胞接种于E-Plate 16板中,每组细胞密度分别设为0.6×104、0.8×104、1×104和1.2×104cells·孔-1,设3个复孔,由RTCA实时监测细胞培养72 h的增殖状况。由图2可知,a期为细胞种植后黏附期,b期为对数增长期,c期为平台期,其中整个实验的暴露时间需在对数增长期内。在暴露时间72 h中,细胞密度为0.6×104cells·孔-1和0.8×104cells·孔-1的HBE细胞增长相对平缓,细胞密度为1.2×104cells·孔-1的HBE细胞在60 h后CI值增幅降低,表明细胞生长进入平台期,因此考虑后续实验需要,选用1×104cells·孔-1为实验条件。

图2 实时无标记细胞分析系统(RTCA)检测出不同密度HBE细胞培养的细胞指数(CI)曲线注:a. 细胞种植后黏附期;b. 快速分裂期;c. 平台期。Fig. 2 Real-time cell analysis system (RTCA) detected Cell Index (CI) of HBE cells at different densitiesNote: a. Cell adhesion period after planting; b. Rapid fission stage; c. Plateau stage.
2.2.2 RTCA法测SRM 1650b和SRM 2975致HBE细胞毒性实验结果由图3(a)和3(c)可知,将HBE细胞接种于E-Plate 16板后,在20 h时分别向每孔加入SRM 1650b和SRM 2975悬液,RTCA实时监测NCI的变化。由图3(b)可知,暴露6 h后,与对照组相比,染毒浓度为28 mg·L-1和56 mg·L-1的SRM 1650b组,测得的NCI值低于对照组,差异有统计学意义(P<0.05);暴露12、24和48 h后,与对照组相比,染毒浓度为14、28和56 mg·L-1的SRM 1650b组,测得的NCI值均低于对照组,差异有统计学意义(P<0.05)。由图3(d)可知,暴露6、12、24和48 h后,与对照组相比,染毒浓度为3.5、7、14、28和56 mg·L-1的SRM 2975组,测得的NCI值均低于对照组,差异均有统计学意义(P<0.05)。

图3 RTCA检测SRM 1650b和SRM 2975染毒HBE细胞的标准化细胞指数(NCI)值变化注:(a)和(c)是RTCA实时监测SRM 1650b和SRM 2975染毒HBE细胞的NCI值,(b)和(d)为RTCA法检测SRM 1650b和SRM 2975染毒HBE细胞6、12、24和48 h后NCI值变化;*P<0.05,**P<0.01,***P<0.001,与对照相比;attack表示DEP开始对HBE细胞进行暴露处理。Fig. 3 The normalized cell index (NCI) of HBE cells induced by SRM 1650b and SRM 2975 was monitored by RTCANote: (a) and (c) show that RTCA monitored NCI of SRM 1650b-exposed and SRM 2975-exposed HBE cells; (b) and (d) show that after SRM 1650b and SRM 2975 induced HBE cells, the changes of NCI were monitored by RTCA at 6, 12, 24 and 48 h; *P<0.05, **P<0.01, ***P<0.001, compared with the control; attack means the HBE cells started to be exposed to DEP.
2.3 细胞凋亡实验测不同浓度不同时间段SRM 2975和SRM 1650b致HBE细胞毒性实验结果
将HBE细胞接种于六孔板后,在6 h时分别向每孔加入28 mg·L-1SRM 1650b和7 mg·L-1SRM 2975悬液,在12 h时分别向每孔加入14 mg·L-1SRM 1650b和7 mg·L-1SRM 2975悬液,在24 h和48 h时分别向每孔加入14 mg·L-1SRM 1650b和3.5 mg·L-1SRM 2975悬液。由图4(b)~(e)可见,在暴露的不同时间点,与对照组相比,SRM 1650b和SRM 2975组中测得的细胞凋亡率均高于对照组,差异有统计学意义(P<0.05)。

图4 不同浓度不同时间段SRM 1650b和SRM 2975致HBE细胞凋亡率的变化注:(a)是不同浓度不同时间段SRM 2975和SRM 1650b致HBE细胞凋亡的流式细胞术检测散点图;(b),(c),(d),(e)暴露时间分别为6、12、24和48 h;*P<0.05,**P<0.01,***P<0.001,与对照相比。Fig. 4 SRM 1650b and SRM 2975 resulted in the changes of apoptosis rate at different concentrations and exposure timesNote: (a) shows that the flow cytometry analyzed apoptosis rate of SRM 1650b-exposed and SRM 2975-exposed HBE cells at different concentrations and exposure times; for (b), (c), (d) and (e), the exposure times were 6,12, 24 and 48 h, respectively; *P<0.05, **P<0.01, ***P<0.001, compared with the control.
3 讨论(Discussion)
本研究发现,SRM 1650b和SRM 2975均可致HBE细胞损伤,产生细胞毒性,并呈现出剂量-效应相关性,且随着DEP暴露时间的增加细胞活性率下降更为明显,且在同一染毒浓度、暴露时间,与SRM 1650b相比,SRM 2975致HBE细胞毒性更强。DEP作为一种空气污染颗粒物,其物理化学特性高度依赖于燃料和发动机,是柴油机主要的副产物之一[13-14]。本研究使用的2种暴露物质DEP SRM,是在受控条件下生产的,分别代表了重型发动机(SRM 1650b)和轻型发动机(SRM 2975)排放的颗粒物[11],都可以诱发HBE细胞产生细胞损伤[15]。这2种颗粒物致HBE细胞毒性的差异可能与其理化性质有关。SRM 1650b在超纯水中平均粒径约为0.4259 μm,SRM 2975在超纯水中平均粒径约为0.2216 μm,提示DEP的粒径大小可能是影响毒性效应的因素之一[11]。小粒径DEP更容易穿透细胞膜进入细胞发挥毒性作用。
本研究发现,在RTCA实时监测中,低浓度的染毒组,比如暴露12 h后14 mg·L-1的SRM 1650b组已经表现出有统计学差异的细胞毒性,而相同时间条件下CCK-8法在28 mg·L-1才检测出显著的细胞活性下降,说明在细胞毒性检测水平上,RTCA法更加灵敏。且由细胞凋亡实验证实,RTCA法更能发现不同组之间的统计学意义差异。细胞毒性的检测是毒理学机制研究的基础,CCK-8法是检测细胞存活率的传统方法,被使用了很长时间,RTCA是检测细胞毒性的新技术,且本研究得出RTCA相比CCK-8法更适用于检测DEP致HBE毒性,RTCA灵敏度更高,实用性更高。但在其他研究方面,RTCA是否可以取代CCK-8法仍有疑问,因此本研究分析了2种方法的局限性。
CCK-8法是细胞毒性实验中的经典方法,该方法已被广泛用于一些细胞增殖试验、细胞毒性试验以及药敏试验,具有技术成熟、经济实惠等优点[16-17]。本研究在用CCK-8法检测DEP致HBE细胞的毒性实验中,也发现其局限性。①由于CCK-8试剂中含有的WST-8在1-Methoxy PMS的作用下被细胞中的脱氢酶还原为具有高度水溶性的黄色甲臜产物,化学过程受温度、时间等因素影响,造成系统误差,对实验结果造成影响。②操作步骤繁琐,从而对实验结果产生影响。③CCK-8法只能在已设计好的暴露时间点,检测DEP致HBE细胞毒性,不可反复多次测量,具有一次性。经本文验证,相较CCK-8法,RTCA法操作步骤简单,不需要多次吸出培养液加入DEP悬液进而影响细胞状态,保证实验细胞质量,组内差异小,其次RTCA是全自动、可实时连续动态监测,一次实验可以得出不同暴露时间的染毒结果。之前的研究同样表明,相对于传统方法,RTCA对细胞状态影响小,能够更好地继续进行其他的实验性研究[18]。
同时,本研究还发现RTCA法也存在一些局限性,包括:①悬浮细胞无法生长在细胞培养板底部,由于仪器设计原理,无法检测阻抗值的变化,只能检测暴露前被诱导为贴壁细胞的悬浮免疫细胞的NCI值,但这类悬浮细胞种类极少,因此在检测DEP致悬浮细胞活性时,更适合用CCK-8法;②RTCA不适用于气液暴露下DEP致任何细胞毒性的检测,RTCA无法和气液暴露装置联用,因此在本研究中,实验采用的是液液暴露的方式。由此可见,在检测DEP致悬浮细胞毒性的研究和气液暴露装置联用时,应继续采用传统的CCK-8法。有研究表明,在药物的细胞毒性评价方面需考虑这2种方法的适用性,CCK-8法不适合有色药物的细胞毒性评估,RTCA不适合含电活性成分的抗癌药物的细胞毒性评估[8]。
本实验旨在通过RTCA和CCK-8法检测2种DEP(SRM 1650b和SRM 2975)致HBE细胞毒性的研究,对2种方法进行比较。相对于CCK-8法,RTCA法更精准地检测DEP致HBE细胞毒性,与细胞凋亡实验的结果有高度的一致性,因而,可用作颗粒物染毒HBE细胞后检测细胞毒性的常规检测方法。但RTCA在其适用范围有更多的局限性,因此,RTCA如何检测悬浮细胞的活性率需继续研究。研究同时提示,轻型和重型发动机的DEP排放值得人们关注,本实验为进一步研究DEP对肺部损伤的毒性作用机制研究提供科学依据,但SRM 1650b和SRM 2975产生毒性作用的能力不同,可能与颗粒物的粒径、有机物的物质含量和理化特性等有关,在接下来的研究中有待证实。
◆

