连续性血液净化对脓毒症并发急性呼吸窘迫综合征患者炎症因子及血管内皮通透性影响
李秋红, 赵千文
郑州大学琼中医院/海南省琼中黎族苗族自治县人民医院 重症医学科,海南 琼中黎族苗族自治县 572900
脓毒症是感染引起全身炎症反应失控及免疫功能紊乱的急危重症,具有较高致残率和致死率,临床上往往并发多个器官损伤甚至功能衰竭,其中,以急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)较为常见[1]。脓毒症并发ARDS患者的致死率较单纯的脓毒症高,可达50%~90%[1]。目前,脓毒症并发ARDS的具体机制尚不清楚[2]。近年来,针对脓毒症并发ARDS制订了一系列的治疗措施和指导意见,但病死率仍未见明显下降。连续性血液净化可有效清除体内的炎性因子,控制炎症反应,调节免疫功能,从而保护器官功能,近年来在脓毒症并发多器官功能障碍的救治中得到广泛应用[3]。本研究旨在探讨连续性血液净化对脓毒症并发ARDS患者炎性因子及血管内皮通透性的影响。现报道如下。
1 资料与方法
1.1 一般资料 选取自2018年1月至2020年8月收治的86例脓毒症并发ARDS患者为研究对象。根据随机数字表法将患者分为常规治疗组和连续性血液净化组,每组各43例。常规治疗组:男性27例,女性16例;年龄范围30~71岁,年龄(45.83±4.81)岁;序贯器官衰竭评分(sequentialorgan failure assessment,SOFA)为(8.87±1.43)分,急性生理功能与慢性健康状况评分Ⅱ(acute physiology and chronic health evaluationⅡ,APACHEⅡ)为(17.02±3.13)分;肺部感染22例,胰腺炎9例,术后继发腹腔感染5例,多发性创伤4例,其他部位感染3例。连续性血液净化组:男性28例,女性15例;年龄范围29~72岁,年龄(46.74±5.17)岁;SOFA评分为(8.76±1.25)分,APACHEⅡ评分为(16.82±2.31)分;肺部感染21例,胰腺炎8例,术后继发腹腔感染6例,多发性创伤5 例,其他部位感染3例。两组患者的一般资料比较,差异均无统计学意义(P>0.05),具有可比性。纳入标准:脓毒症的诊断符合《2016 SSC指南》要求,同时,ARDS诊断亦符合2012年柏林会议规定的标准[4-5]。排除标准:(1)合并严重颅脑外伤、脑出血及大面积脑梗死;(2)慢性尿毒症及免疫缺陷;(3)慢性肺部疾病及恶性肿瘤;(4)合并急性心肌梗死;(5)孕产妇;(6)精神疾病患者;(7)年龄<18岁;(8)家属不配合研究。本研究经医院医学伦理委员会批准,患者或家属均知情同意。
1.2 研究方法 常规治疗组患者入院后积极治疗原发病,经验性抗生素抗感染,30 ml/kg液体量快速复苏,稳定机体内环境,肠内外营养支持及小潮气量保护性机械通气等常规治疗。连续性血液净化组患者在常规治疗的基础上采用金宝血液滤过机(Prismaflex 8.11版本)、M150配套进行连续性血液净化治疗,选择在床旁超声导引下穿刺左侧或右侧股静脉置管作为临时血管通路,以清除炎症因子为目标,设置连续性静脉-静脉血液滤过(continuous veno venous hemofiltration,CVVH)工作模式,血流速度设置在200~250 ml/min,以青山利康基础液为置换液,速度设置在50~60 ml/(kg·h)冲击治疗,前后置换液比为50%∶50%,根据置换液速度及血气分析结果设定碳酸氢钠及氧化钾的用量。调节脱水速度以达到液体出入量平衡需求,依照出血风险评估结果决定抗凝方式并严密监测跨膜压及静脉壶凝血情况,持续治疗24 h以上。
1.3 观察指标 分别于治疗前及治疗后24 h,采集患者肘静脉血,检测血清中的肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)及白细胞介素10(interleukin-10,IL-10)水平。用真空采血针抽取动脉血检测血气分析中的氧分压(partial pressure of oxygen,PaO2),并结合吸氧浓度计算出氧合指数(oxygenation index,OI);采用迈瑞监护仪加装的脉波指示连续心排血量(pulse wave indicates continuous cardiac output,PICCO)监测模块,动态监测肺血管通透性指数(pulmonary vascular permeability index,PVPI)、血管外肺水指数(extravascular lung water index,EVLWI)及血流动力学指标[平均动脉压(mean arterial pressure,MAP)、中心静脉压(central venous pressure,CVP)],计算SOFA及APACHEⅡ评分。
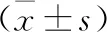
2 结果
治疗前,两组患者的TNF-α、IL-6及IL-10水平比较,差异均无统计学意义(P>0.05);治疗后,两组患者的TNF-α、IL-6水平均下降,且连续性血液净化组下降较明显,两组患者的IL-10水平均上升,且连续性血液净化组上升更明显,差异均有统计学意义(P<0.05)。见表1。治疗前,两组患者的PVPI、EVLWI及OI比较,差异均无统计学意义(P>0.05);治疗后,两组患者PVPI、EVLWI均下降,且连续性血液净化组下降的较明显,两组OI均上升,且连续性血液净化组上升更明显,差异均有统计学意义(P<0.05)。见表2。治疗前,两组患者的MAP、CVP、SOFA及APACHEⅡ评分比较,差异均无统计学意义(P>0.05);治疗后,两组患者的MAP、CVP均上升,但连续性血液净化组较常规治疗组上升更明显,SOFA、APACHEⅡ评分均下降,但连续性血液净化组下降更明显,差异均有统计学意义(P<0.05)。见表3。
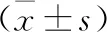
表1 两组患者治疗前、后炎症因子水平比较
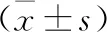
表2 两组患者治疗前、后血管内皮通透性指标比较
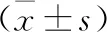
表3 两组患者血流动力学及病情严重程度评分比较
3 讨论
炎症因子的过度释放和激活在脓毒症并发ARDS的病理生理过程中发挥重要作用[6]。有研究表明,ARDS 主要在多种炎性因子共同作用下,肺血管内皮细胞受到严重损伤,通透性急剧增高,毛细血管内血浆成份外渗致血管外肺水快速增加,出现肺水肿,从而导致患者严重顽固性缺氧[7]。脓毒症并发ARDS患者体内存在大量TNF-α、IL-6及IL-10等炎症因子,其水平与病情严重程度及临床预后关系密切[8]。TNF-α是由单核吞噬细胞合成和释放的一种炎症因子,在脓毒症并发ARDS过程中扮演着启动炎症反应的角色,有增强中性粒细胞吞噬功能,在激活其他促炎因子的同时,抑制抗炎因子的合成[9-10]。IL-6是多种免疫细胞在内毒素等刺激下表达和释放的促炎因子,其与TNF-α可产生较强的协同促进效应,亦可激活自然免疫系统产生更多的炎症因子[11]。IL-10是一种在炎症反应过程中组织细胞合成和分泌的抑炎因子,对炎症反应起负调节作用,可降低体内TNF-α、IL-1及IL-6等促炎因子水平[12]。连续性血液净化是一种新型血液净化方式,其主要通过特殊材料制成的滤器装置产生吸附与对流作用,非特异地清除体内炎症因子,降低脓毒症患者的炎症反应,纠正组织器官低灌注状态,减少血管内皮细胞的损伤,从而起到保护组织器官的功效。因此,在脓毒症合并ARDS早期,给予恰当的血液净化控制炎症反应,降低血管内皮细胞通透性,减轻肺水肿,可能对改善临床预后起到积极作用。
本研究结果显示,两组患者治疗后TNF-α、IL-6水平均下降,且连续性血液净化组下降较明显,差异有统计学意义(P<0.05)。这表明,应用连续性血液净化治疗脓毒症并发ARDS能有效地清除患者体内的炎症因子,阻断炎症反应的级联放大,降低炎症反应水平,这与张彦[13]的研究结果相似。治疗后,连续性血液净化组患者的IL-10水平高于常规治疗组,差异有统计学意义(P<0.05)。这说明,连续性血液净化治疗在清除患者体内促炎因子水平的同时亦能促进内源性抗炎因子的合成和释放,重新建立体内抗炎-促炎因子的动态平衡,发挥有效保护组织器官功能的作用。治疗后,两组患者PVPI、EVLWI均下降,且连续性血液净化组下降的较明显,两组OI均上升,且连续性血液净化组上升更明显,差异均有统计学意义(P<0.05)。这可能是连续性血液净化抑制肺组织炎症反应后,肺毛细血管的内皮细胞得到有效保护,血管通透性亦因此而降低,有利于消除血管外肺水,减轻肺水肿,提高肺容积和顺应性,改善缺氧状态。CVP和MAP是评估血流动力学状态的关键指标,脓毒症并发ARDS患者通常出现心血管系统对血管活性药物反应性下降、外周血管阻力持续降低和组织器官低灌注等血流动力学异常改变[14]。本研究结果显示,治疗后,两组患者的MAP、CVP均上升,且连续性血液净化组较常规治疗组优越性更明显,差异有统计学意义(P<0.05)。这表明,连续性血液净化在治疗脓毒症并发ARDS患者的过程中除了清除炎症因子、降低肺血管内皮通透性之外还能改善血流动力学。SOFA和APACHEⅡ评分是反映脓毒症患者病情严重程度的可靠指标[15]。本研究结果显示,连续性血液净化组患者SOFA和APACHEⅡ评分均显著低于常规治疗组,差异有统计学意义(P<0.05)。这表明,采用连续性血液净化治疗后,患者的炎症反应状态、病情严重程度以及临床预后均得到有效改善。
综上所述,连续性血液净化治疗脓毒症并发ARDS,能清除患者机体炎症因子,重新建立促炎-抗炎反应稳态,阻断全身炎症反应,保护肺血管内皮细胞,降低肺血管内皮通透性,减少血管外肺水的产生,纠正缺氧状态,同时还可稳定血流动力学,减轻病情严重程度,有效改善临床预后。

