基于高通量测序的龙胆草根际土壤真菌群落结构分析
高嵩 孙文松 于春雷 李玲 张天静
摘要:为了探究药用植物种植年限对土壤根际真菌多样性的影响和根际群落结构的差异,从根系与土壤微生物关系角度为药用植物的生产实践提供理论基础,采用Illumina Miseq测序平台分析不同种植年限龙胆草根际土壤的真菌群落。结果表明,测序获得的1541个OUT分属于11门28 纲59目109科173属。与未种植龙胆草的土壤相比,龙胆草土壤根际真菌群落的丰度和多样性指数降低,并且随着种植年限的增加,多样性与生长年限呈负相关,根际真菌群落丰度和多样性指数的下降趋势明显。种植年限影响根际真菌群落结构的改变,种植2、3年龙胆草土壤根际真菌群落结构相似,与种植1年的根际真菌群落结构差距較大。随着种植年限的增加,根际真菌优势种群由未种植中小球腔菌属(Leptosphaeria)等有益菌属为主转变为种植3年的炭疽菌属(Colletotrichum)、镰刀菌属(Fusarium)等致病菌属。可以看出,种植龙胆草影响了根际真菌群落多样性和群落结构,随着种植的年限增加,有益菌属丰度下降,致病菌属丰度增加。
关键词:龙胆草;根际土壤;真菌群落;高通量测序;多样性
中图分类号: S154.37文献标志码: A
文章编号:1002-1302(2021)12-0190-06
收稿日期:2020-07-07
基金项目:国家中药材产业技术体系项目(编号:CARS-21);辽宁省科学事业公益性研究基金(编号:20180041);辽宁省农业科技自主创新资金(编号:2019DD144221)。
作者简介:高 嵩(1982—),女,辽宁大连人,博士,助理研究员,主要从事中药材道地性栽培生理研究。E-mail:gs_laas@126.com。
通信作者:孙文松,硕士,研究员,主要从事中药材种质收集保护、品种选育及标准化栽培研究。E-mail:sunwensong12@126.com。
龙胆草(Gentiana scabra Bunge)为龙胆科多年生草本植物[1],以其根茎入药,龙胆是我国传统的中药材,其味苦、性寒,归肝、胆经,有清热燥湿、泻肝胆实火的功效[2]。关龙胆是辽宁省抚顺市清原满族自治县的国家地理标志产品,其产量占全国北龙胆药材市场的83%[3]。
植物根际土壤中存在大量微生物,根系微生物通过植物根系分泌物、黏液和脱落的根细胞直接影响根系活力[4]。土壤微生物在土壤功能和植物健康中起着重要作用[5],土壤中的微生物多样性和群落组成与土壤传播的疾病高度相关[6]。土壤微生物区系的改变会影响土壤的生态功能和作物的生长[7-9]。土壤微生物是土壤生态系统的重要组成部分,被认为是土壤质量不可缺少的组成部分[10-11]。对于以根、根茎入药的药用植物,根际微生物对药用植物的产量与质量至关重要[12]。
目前,关于龙胆草药材的研究主要集中在化学成分、生理生化、药理药效及分子生物学等方面[13-17],有关龙胆草根际土壤微生物多样性的研究较少。本研究以辽宁省抚顺市清原满族自治县椽子沟村不同种植年限龙胆草的根际土壤为研究对象,采用Illumina Miseq高通量测序技术分析根际真菌群落的组成及多样性差异,试图挖掘龙胆草根际土壤中的有益真菌资源,为探讨种植年限对药用植物土壤微生物结构和群落多样性差异的影响提供参考,旨在从根系与土壤微生物互作关系方面入手为药用植物的生产实践提供理论基础。
1 材料与方法
1.1 研究区设置
本研究对象为辽宁省抚顺市清原满族自治县椽子沟村(125°06′73.71″N,42°08′93.48″E)山地的栽培龙胆,共选取3块样地,即当年种植龙胆草的样地(R1)、种植龙胆草2年的样地(R2)、种植龙胆草3年的样地(R3),以距离采龙胆草样品约50 m且未种植过龙胆草的土壤作为对照(CK)。该地区属中温带大陆性季风气候,年平均气温为5.3 ℃,无霜期为110~120 d,全年总日照时数为2 419 h,年平均降水量为806.5 mm。在耕作与植物生长过程中进行正常水肥管理。
1.2 根际土壤样品的采集
于2018年10月15日龙胆草盛花期在3块样地分别采集龙胆草根际土壤样品。根际土壤采用“抖根法”取样,先将植物根系从土壤中挖出,抖掉与根系结合松散的土壤,再用毛刷轻轻刷下根系表面土壤。按“S”形采样方法,随机选取5个点的样品后混合。根际土样用冰盒带回实验室并于 -80 ℃ 保存,用于土壤微生物DNA的提取及后续测试。
1.3 土壤DNA的提取和高通量测序
采用十六烷基三甲基溴化铵(CTAB)方法[18]提取土壤基因组DNA。使用Thermo fisher公司的Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,构建好的文库经Qubit定量和文库检测合格后进行上机测序。
1.4 菌群组成分析和差异分析
使用Qiime软件(Version 1.9.1)计算 Ace指数、Chao1指数、香农指数和辛普森指数等多样性指数;使用R软件绘制稀释曲线、Rank abundance曲线、物种累积曲线并使用R软件进行Alpha多样性指数的组间差异分析[19]。用Uparse软件对所有样品的全部Clean Reads进行聚类,默认按97%的一致性将序列聚类成为OTUs,同时选取OTUs的代表性序列,依据其算法原则,筛选OTUs中出现频数最高的序列作为OTUs的代表序列。用SPSS 2.0软件进行数据统计分析。
2 结果与分析
2.1 稀释曲线
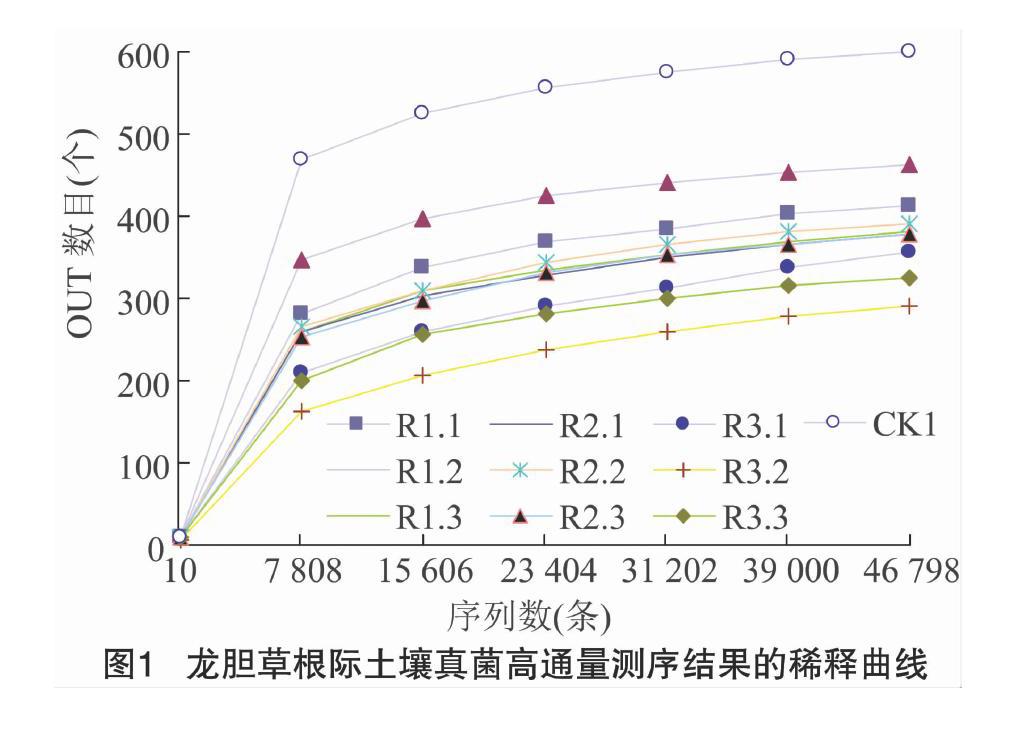
稀释曲线可直接反映测序数据量的合理性,并间接反映样本中物种的丰富程度。当曲线趋向平坦时,说明测序数据量满足试验要求,能够表征土壤样品中微生物的多样性[20]。分别随机抽取真菌测序样品的ITS1序列读数,以其属或种类数为纵坐标、ITS1序列读数为横坐标,获得真菌的稀释曲线。如图1所示,当测序量超过8 000读长时,仍然会有新OTUs出现,但是曲线逐渐趋于平缓,说明测试量达到饱和,真菌群落结构的置信度比较高,能够比较真实地反映根际土壤中真菌群落的多样性,即测序深度足以反映本试验样本所包含的真菌群落多样性。
2.2 真菌群落丰富度多样性统计分析
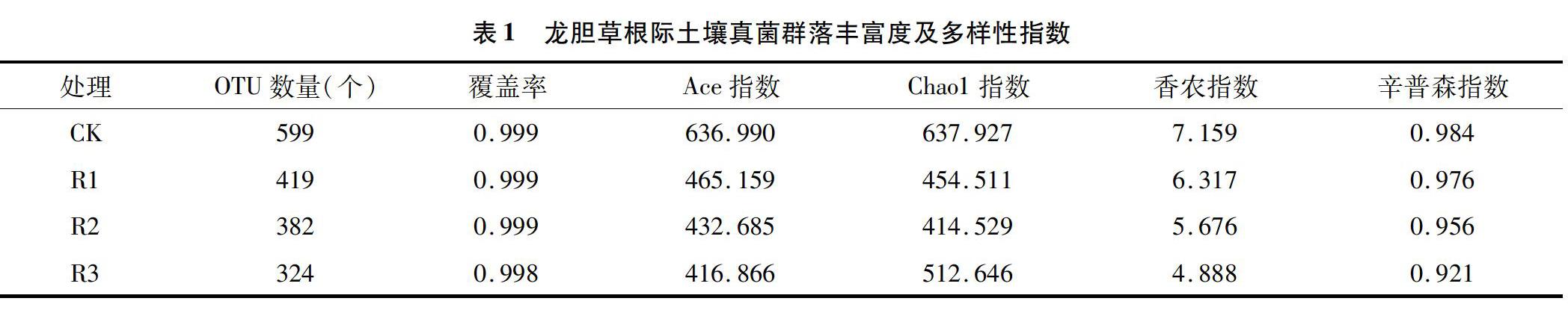
由表1可知,各样品测序深度指数覆盖率均在0.998以上,说明测序量足以覆盖样品的菌落组成。按97%相似性归并后,4组样品所含真菌OUT数量分别为599、419、382、324个,种植不同年限龙胆草的根际土壤OUT数量排序为CK(未种植)>R1(一年生)>R2(二年生)>R3(三年生)。利用Alpha多样性分析土壤中真菌群落的丰富度和多样性,得出不同种植年限龙胆草根际真菌群落丰富度(Richness)指数(Ace)、群落多样性(Diversity)指数香农指数和辛普森指数存在并呈现如下规律:CK>R1>R2>R3。结果表明,对照土壤中的真菌多样性比种植龙胆草的根际土壤丰富,可能是由于龙胆草根系对根际土壤真菌具有选择性;随着种植年限增加,多样性指数均呈现明显下降的趋势,说明种植龙胆草明显降低了土壤真菌的多样性,种植使土壤真菌群落的种类趋于单一化,且种类数量降低。
2.3 土壤真菌群落结构分析
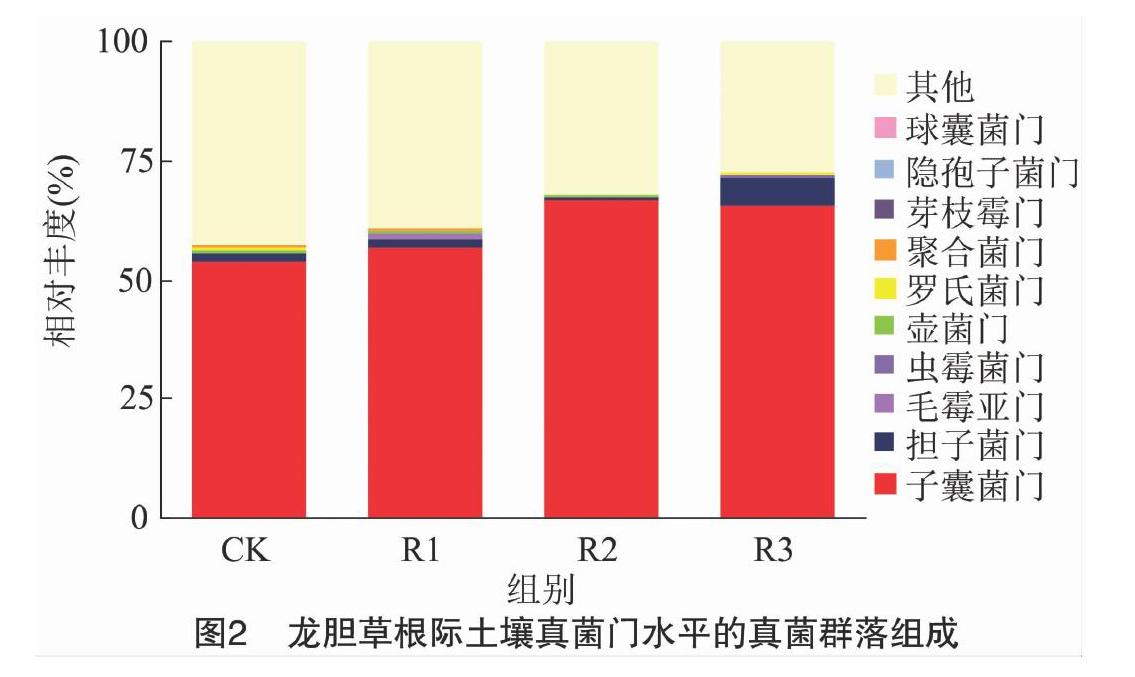
物种组成分析能够反映样品在分类学水平的群落结构。4个处理不同年限龙胆草根际土壤中的真菌分属于11门28纲59目109科173属。如图2所示,不同种植年限龙胆草根际土壤的最主要类群均为子囊菌门(Ascomycota),相对丰度排序为R2(66.38%)>R3(65.70%)>R1(56.53%)>CK(53.99%);其次是担子菌门(Basidiomycota),相对丰度在1%~5%之间。另外还有相对丰度约为30%左右的待定真菌(Fungi_unclassified)等类群在GenBank中没有被明确分类。如图3所示,散囊菌纲(Eurotiomycetes)、粪壳菌纲(Sordariomycetes)、圆盘菌纲( Orbiliomycetes)、座囊菌纲(Dothideomycetes)、锤舌菌纲(Leotiomycetes)等真菌组成了土壤群落中真菌纲的优势菌纲群,总相对丰度排序为R2(65.79%)>R3(65.26%)>R1(53.38%)>CK(50.95%);另外还有待定真菌(Fungi_unclassified)等类群在GenBank中没有被明确分类,其相对丰度排序为CK(46.96%)>R1(41.38%)>R2(33.06%)>R3(28.01%)。
2.4 不同年限土壤真菌菌群的分类学组成分析
使用R软件,选取土壤真菌菌群丰度排名前35的属,根据其在各个土壤处理中的丰度信息,从真菌菌群种类、土壤处理2个层面进行聚类,根据聚类结果对分类单元和样品分别进行排序绘制成热图。通过聚类,能够区分高丰度和低丰度的分类单元,红色、蓝色代表菌属的丰度,越偏向红色表明丰度越高,越偏向蓝色表明豐度越低。
对不同年限龙胆草根际真菌在属种水平上进行分析。如图4所示,根据进化关系,真菌群落OUT在纵向上可以聚类为两大类,根据变化趋势可分为4类,菌群I在R1组的丰度最高,R2、R3组次之,CK组最低;菌群Ⅱ在R3组的丰度最高,R2、R1组次之,CK组最低。菌群Ⅰ、菌群Ⅱ聚为一类。菌群Ⅲ中CK组的丰度显著高于其他3组,菌群Ⅳ在R2组的丰度最高。35个属中有2个担子菌门、1个毛霉门(Mucoromycota),其他均为子囊菌门。
随着龙胆草种植年限的增加,土壤环境随之改变,进而影响土壤真菌的种群数量及群落结构。由图4可以看出,菌群Ⅰ中赤霉菌(Gibberella)、砖隔腔菌(Capronia)、Acrophialophora、伞状霉属(Umbelopsis),菌群Ⅱ中炭疽菌属(Colletotrichum)、Saitozyma、拟球腔菌属(Paraphaeosphaeria)和木霉属(Trichoderma)均表现为随种植年限增加菌群丰度增加,并且在种植至3年时炭疽菌属成为优势菌属。炭疽属和拟球腔菌属中的部分真菌为致病菌。菌群Ⅲ中的菌属均表现为随种植年限的增加而菌群丰度显著减少,具体有小球腔菌属(Leptosphaeria)、螺旋聚孢霉(Clonostachys)、水生真菌(Tetracladium)、油脂酵母(Lipomyces)、Calophoma、Cutaneotrichosporon、链格孢属(Alternaria)、地丝霉属(Geomyces)、莫勒盘菌(Moellerodiscus)、漆斑菌(Myrothecium)、浅色尾孢属(Pallidocercospora)、青霉属(Penicillium)、棒束孢属(Isaria)、拟盾壳霉属(Paraconiothyrium)、异茎点霉属(Paraphoma)等。其中螺旋聚孢霉、异茎点霉属为有益菌属,具有抑菌作用。
为了寻找样本之间优势物种的差异,使用R软件vcd包ternaryplot命令进行Ternaryplot分析。选取不同种植年限龙胆草处理在种水平上平均丰度排名前10的物种,生成ternaryplot三元相图。图中3个顶点代表3个处理分组,圆圈代表物种,圆圈大小与相对丰度成正比,圆圈离哪个顶点越近,表示真菌群落种类在这个分组中的含量越高,以便直观地查看不同种植年限龙胆草与未种植龙胆草土壤根际真菌优势物种在种水平上的差异。如图5、图6所示,CK组的优势菌属为虫花棒束孢(Isaria_farinosa)、羊毛状青霉(Penicillium lanosum)和Mycosphaerella_polygoni-cuspidati,丰度较高,与R1、R2和R3组间差异显著;R3组的优势菌组为隐球菌(Saitozyma podzolica)、钩状木霉(Trichoderma hamatum),其丰度较其他组高。值得关注的是,在R2组到R3组2组数据的比较中,茄镰孢菌(Fusarium solani)表现为上升趋势,最终成为R3组的优势菌株,而茄镰孢菌(Fusarium solani)能够在多种作物中引发真菌病害。
2.5 Beta多样性分析
无度量多维标定法(non-metric multi-dimensional scaling,NMDS)[21]是基于Bray-Curtis距离进行分析的非线性模型,根据不同种植年限龙胆草土壤中包含的真菌群落信息,以点的形式反映在二维平面上。通过点与点间的距离,反映样本的组间、组内差异等。基于不同年限龙胆草根际真菌测序所得OTU水平的NMDS分析结果见图7,同一组样本使用同种颜色表示。当Stress小于0.2时,说明NMDS可以准确反映样本间的差异程度。在整体情况下,不同组间具有明显差异。CK组的位置与R1、R2和R3组之间的距离较远, 并且分布在不同象限内。各种植组内数据点间的距离较近,且在同一区域内,不同年限处理间的分布相对较均匀。以上结果说明,种植龙胆草能够改变土壤真菌群落结构,并且随着种植年限的增加,群落结构逐渐改变。
基于Unweighted Unifrac距离进行PCoA(Principal Co-ordinates Analysis)分析,选取贡献率最大的主坐标组合进行作图。处理间距离越接近,表示真菌群落组成结构越相似,因此群落结构相似度高的处理聚集在一起,群落差异很大的样本则远远分开。如图8所示,不同年限龙胆草根际真菌群落变化与NMDS分析结果一致,CK组的位置与R1、R2和R3组之间的距离较远。R3组表现出明显的组内聚集,表明同一处理的土壤样品具有极相似的真菌群落结构,并且二年生龙胆草土壤和三年生龙胆草土壤距离较近,说明二、三年生龙胆草土壤中的真菌群落结构具有较高的相似性。一年生龙胆草处理与二、三年生龙胆草处理各点距离较远,说明一年生和二、三年生龙胆草土壤细菌群落结构的相似性较低。
3 结论与讨论
本研究使用高通量测序技术从辽宁省抚顺市清原满族自治县不同年限龙胆草根际土壤中获得真菌ITS1序列分别隶属于11门28 纲59目109科173属,稀释曲线表明,测试量达到饱和,能够比较真实地反映根际土壤中真菌群落的多样性,测序深度足以反映该群落样本所包含的真菌群落多样性。
本研究通过对不同年限种植龙胆草和未种植龙胆草根际土壤真菌OUT数量及多样性指数比对发现,未种植龙胆草土壤CK组中的真菌多样性较种植龙胆草的根际丰富,而种植龙胆草土壤根系真菌群落多样性指数随年限增加呈明显下降趋势,种植3年的龙胆草多样性指数最低,且丰度最低。植物根系对根际微生物具有选择性将导致根际微生物群落组成和结构的显著差异[13]。植物根系对根际土壤真菌具有一定的选择性[22],没有种植苎麻的根际土壤真菌多样性较种植苎麻的土壤丰富,不同根型苎麻对根际定殖的真菌类群仍存在选择性[23]。研究结果表明,种植龙胆草年限增加影響了土壤真菌群落的多样性和丰度,趋势呈负相关,土壤真菌群落变得种类简单且丰度降低,与前人的研究结果一致。
根际微域内土壤微生物群落结构与根系活动关系密切[24],有研究发现,土壤根际真菌多样性及群落构成变化使真菌多样性指数显著降低,群落结构失衡,可能导致西洋参根腐病发生[25]。生物炭添加使马铃薯根际土壤中担子菌门数量呈下降趋势,这可能会对植物生长有益[26]。连作土壤微生物环境由细菌型转向真菌型[27-28],人参、三七作为药用植物中研究得较详细的作物,基于真菌ITS1测序分析对连续种植过程中根际土壤真菌群落结构和多样性的研究结果表明,根际微生物群落结构对于人参、三七可持续管理和生产至关重要[29-31]。随着地黄种植年限的增加,其根际致病真菌尖孢镰刀菌、木霉和黄曲霉等真菌种类和数量显著增加[32-33]。本研究结果表明,随着种植年限增加,龙胆草根际土壤真菌群落结构改变差异显著。差异分析结果显示,炭疽菌属和茄镰孢菌由未种植时丰度极低的装填转变成为优势菌属,其他种植3年的优势菌属Saitozyma、Paraphaeosphaeria和木霉属的丰度显著高于其他处理根际土样,炭疽菌属和茄镰孢菌在其他物种上已被证明为致病真菌,可能是龙胆草根腐病发生的病原菌,可能是由于这些真菌的积累导致药用植物的质量和品质下降,这几个属的真菌可能对龙胆草叶枯病的发生具有重要意义,在后续研究中应重点关注。
参考文献:
[1]何廷农. 中国植物志:第62卷[M]. 北京:科学出版社,1988:104-106.
[2]国家药典委员会. 中华人民共和国药典:一部[S]. 北京:中国医药科技出版社,2015:95-96.
[3]孙文松,李 玲. 辽宁中药材产业现状及发展建议[J]. 园艺与种苗,2018,38(11):71-75.
[4]Brimecombe M J,de Leij F A,Lynch J M. The effect of root exudates on rhizosphere microbial populations[M]//Pinton R,Varanini Z,Nannipieri P,et al.The rhizosphere biochemistry and organic substances at the soil-plant interface. New York:Marcel Dekker,2001:95-98.
[5]van Elsas J D,Jansson J K,Trevors J T. Modern soil microbiology[M]. Boca Raton:CRC Press,2007.
[6]Guo R Y,Chen Q,Li X L.The influence of soil microorganism community on the soil healthy and disease suppressiveness[J]. China Veg,2005,138:78-82.
[7]王 苗,孙 燕,刘清梅,等. 西洋参连作障碍产生原因及生物防治概述[J]. 中药材,2016,39(11):2665-2667.
[8]Hartmann A,Rothballer M,Schmid M. Lorenz Hiltner,a pioneer in rhizosphere microbial ecology and soil bacteriology research[J]. Plant and Soil,2008,312:7-14.
[9]Lauber C L,Strickland M S,Bradford M A,et al. The influence of soil properties on the structure of bacterial and fungal communities across land-use types[J]. Soil Biology and Biochemistry,2008,40(9):2407-2415.
[10]马 琨,张 丽,杜 茜,等. 马铃薯连作栽培对土壤微生物群落的影响[J]. 水土保持学报,2010,24(4):229-233.
[11]傅 佳,李先思,傅俊范. 重茬种植西洋参对其根区土壤微生物与土壤理化性质影响[J]. 微生物学杂志,2009,29(2):63-66.
[12]廖长宏,陈军文,吕婉婉,等. 根和根茎类药用植物根腐病研究进展[J]. 中药材,2017,40(2):492-497.
[13]Hartmann A,Schmid M,van Tuinen D,et al. Plant-driven selection of microbes[J]. Plant and Soil,2009,321(1/2):235-257.
[14]寧 愿,程玉鹏,马爱萍,等. 龙胆药理作用的研究进展[J]. 化学工程师,2017,31(6):47-49.
[15]李艳秋,赵德化,潘伯荣,等. 龙胆苦甙抗鼠肝损伤的作用[J]. 第四军医大学学报,2001,22(18):1645-1649.
[16]段 宇,王冬梅,潘英妮,等. GAP基地龙胆中多糖和龙胆苦苷积累动态与土壤因子的关系[J]. 沈阳药科大学学报,2014,31(12):998-1002.
[17]赵 露,孟 琦,江健梅,等. 龙胆草有效成分与表型性状的相关性分析[J]. 吉林农业大学学报,2017,39(6):687-694.
[18]Bachy C,Dolan J R,López-García P,et al. Accuracy of protist diversity assessments:morphology compared with cloning and direct pyrosequencing of 18S rRNA genes and ITS regions using the conspicuous tintinnid ciliates as a case study[J]. The ISME Journal,2013,7(2):244-255.
[19]Bulgarelli D,Garrido-Oter R,Münch P C,et al. Structure and function of the bacterial root microbiota in wild and domesticated barley[J]. Cell Host & Microbe,2015,17(3):392-403.
[20]Jolliffe I T. Principal component analysis[J]. Journal of Marketing Research,2002,25(4):513-515.
[21]Lozupone C A,Hamady M,Kelley S T,et al. Quantitative and qualitative β diversity measures lead to different insights into factors that structure microbial communities[J]. Applied and Environmental Microbiology,2007,73(5):1576-1585.
[22]Jocrgensen R G,Wichern F. Quantitative assessment of the fungal contribution to microbial tissue in soil[J]. Soil Biology and Biochemistry,2008,40(12):2977-2991.
[23]汤涤洛,涂修亮,付 聪,等. 基于高通量测序的苎麻根际土壤真菌群落结构[J]. 西南农业学报,2018,31(10):2160-2164.
[24]Jones R T,Robeson M S,Lauber C L,et al. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses[J]. The ISME Journal,2009,3(4):442-453.
[25]余 妙,蒋景龙,任绪明,等. 西洋参根腐病发生与根际真菌群落变化关系研究[J]. 中国中药杂志,2018,43(10):2038-2047.
[26]黃修梅,李 明,戎素萍,等. 生物炭添加对马铃薯根际土壤真菌多样性和产量的影响[J]. 中国蔬菜,2019(1):51-56.
[27]李振方,杨燕秋,谢冬凤,等. 连作条件下地黄药用品质及土壤微生态特性分析[J]. 中国生态农业学报,2012,20(2):217-224.
[28]汪其同,高明宇,刘梦玲,等. 基于高通量测序的杨树人工林根际土壤真菌群落结构[J]. 应用生态学报,2017,28(4):1177-1183.
[29]He J Z,Xu Z H,Hughes J. Analyses of soil fungal communities in adjacent natural forest and hoop pine plantation ecosystems of subtropical Australia using molecular approaches based on 18S rRNA genes[J]. FEMS Microbiology Letters,2005,247(1):91-100.
[30]董林林,牛玮浩,王 瑞,等. 人参根际真菌群落多样性及组成的变化[J]. 中国中药杂志,2017,42(3):443-449.
[31]Wu L K,Wu H M,Chen J,et al. Microbial community structure and its temporal changes in Rehmannia glutinosa rhizospheric soils monocultured for different years[J]. European Journal of Soil Biology,2016,72:1-5.
[32]Miao C P,Mi Q L,Qiao X G,et al. Rhizospheric fungi of Panax notoginseng:diversity and antagonism to host phytopathogens[J]. Journal of Ginseng Research,2016,40(2):127-134.
[33]Miadlikowska J,Kauff F,Hofstetter V,et al. New insights into classification and evolution of the Lecanoromycetes (Pezizomycotina,Ascomycota) from phylogenetic analyses of three ribosomal RNA-and two protein-coding genes[J]. Mycologia,2006,98:1088-1103.

