腹腔镜胃癌根治术对胃癌患者能量代谢外周血T细胞亚群和患者肠屏障功能机体炎性应激水平和免疫功能的影响
代梦霜,张 凤,贾婷婷,张泽玉,付再碧,敬利春,马银华
(四川省攀枝花市中心医院普外科,四川 攀枝花 617000)
胃癌在我国0~74岁的累积发病率可达到2.95%,累积死亡率达到1.91%,早期胃癌首选的治疗方法是根治性手术,随着医疗技术进步,患者术后5年生存率明显提高[1]。开腹手术操作空间大、难度小,切除病灶的效果好,但并发症多,应激反应严重,术后患者康复较慢[2]。腹腔镜手术创伤小、并发症少,术后恢复较快,但手术操作空间小对施术者技术要求较高[3]。手术的操作过程可能损伤免疫功能和肠道功能,不利于术后恢复,临床上需关注相关指标变化情况,并采取适当的干预措施[4]。本研究旨在探讨腹腔镜手术和开腹手术对胃癌根治术患者能量代谢、肠屏障功能、炎性应激水平和免疫功能的影响,现报道如下。
1 资料与方法
1.1一般资料:回顾性分析2017年6月至2020年6月我院收治的142例胃癌患者的临床资料。纳入标准:符合胃癌诊断标准[5];均为首次接受胃癌根治术治疗,术前未进行放化疗;影像学检查无远处转移;患者及家属均知情同意。排除标准:合并凝血功能障碍或其他恶性肿瘤者;合并严重脏器功能障碍或腹腔内严重粘连者;合并肠梗阻或因肠梗阻行急诊手术者;合并精神疾病者;存在手术禁忌症者;腹腔镜手术中途转开腹者;围术期使用激素治疗者;病例资料不完整者。根据手术方法将纳入的142例患者分为腹腔镜手术组(观察组,n=75)和开腹手术组(对照组,n=67)。
1.2治疗方法:两组患者均行远端(全胃)胃切除+D2淋巴清扫术。腹腔镜手术:①取脐孔上缘作弧形切口作为观察孔,建立13mmHg的CO2气腹;②置入腹腔镜进行探查,明确病变位置以及是否有腹腔淋巴结转移;③在左侧腋前线肋缘下作10mm切口为主操作孔,在脐左5cm偏上部位、右侧腋前线肋缘下、右锁骨中线平脐偏上部作5mm切口为副操作孔;④腹腔镜下结扎供血血管,剥离肠系膜、大网膜,清扫淋巴结;⑤切除胃体,重建消化道;⑥缝合切口,定期更换敷料,常规使用抗生素3d。开腹手术:①作上腹正中切口,入腹探查病灶位置;②结扎供血血管,剥离肠系膜、大网膜,清扫淋巴结,离断肝左叶三角韧带;③行胃全切术或胃大部切除术,重建消化道;④定期更换敷料,常规使用抗生素3d。术后护理:注意患者状态和变化,及时对患者呼吸道分泌物进行清理,并进行供氧支持,保证患者呼吸顺畅,观察患者术后创口变化,对创面状况及分泌物状况进行监护。
1.3观察指标:①能量代谢:术前、术后3d采集患者清晨静脉血,离心分离血清,用散射比浊法检测白蛋白(albumin,ALB)、前白蛋白(prealbumin,PA)、视黄醇结合蛋白(retinol binding protein,RBP)、转铁蛋白(transferrin,TRF)水平。②肠屏障功能:术前、术后3d采集患者清晨肘静脉血,离心分离血浆,用紫外比色法检测二胺氧化酶(DAO)水平,用比色法检测D-乳酸水平。③炎性应激水平:术前、术后3d采集患者清晨空腹静脉血3mL,离心分离血清,用散射比浊法检测C反应蛋白(CRP)水平,用ELISA法检测肿瘤坏死因子-α(TNF-α)水平,术前、术后1d采集患者清晨静脉血,离心分离血清,用ELISA法检测白介素-6(IL-6)水平。④外周血T细胞亚群:术前、术后3d采集患者清晨空腹静脉血5mL,用流式细胞仪测定T细胞亚群(CD4+、CD8+、CD4+/CD8+)水平。⑤免疫功能:术前、术后3d采集患者清晨空腹静脉血5mL,离心分离血清,用免疫比浊法检测免疫球蛋白(IgA、IgG、IgM)水平。

2 结 果
2.1一般资料比较:观察组患者男40例,女35例;年龄41~72岁,平均(50.36±10.59)岁;肿瘤位置:胃体29例,胃窦24例,贲门胃底22例;肿瘤TNM分期:Ⅰ期23例,Ⅱ期42例,Ⅲ期10例。对照组患者男36例,女31例;年龄40~70岁,平均(51.95±11.47)岁;肿瘤位置:胃体25例,胃窦23例,贲门胃底19例;肿瘤TNM分期:Ⅰ期21例,Ⅱ期37例,Ⅲ期9例。两组患者上述资料比较,差异无统计学意义(P>0.05)。
2.2手术前后能量代谢指标比较:术后3d,两组患者血清ALB、PA、RBP、TRF水平均较术前降低,观察组降低幅度低于对照组(P<0.05),见表1。
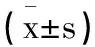
表1 手术前后能量代谢指标比较
2.3手术前后肠屏障功能指标比较:术后3d,两组患者血浆DAO、D-乳酸水平均较术前升高,观察组升高幅度低于对照组(P<0.05),见表2。
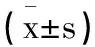
表2 手术前后肠屏障功能指标比较
2.4手术前后炎性应激水平比较:术后1d,两组患者血清IL-6水平较术前升高,观察组升高幅度低于对照组(P<0.05),术后3d,两组患者血清CRP水平较术前升高,观察组升高幅度低于对照组(P<0.05),TNF-α水平较术前降低,观察组降低幅度低于对照组(P<0.05),见表3。
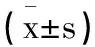
表3 手术前后炎性应激水平比较
2.5手术前后T细胞亚群水平比较:术后3d,两组患者外周血CD4+、CD4+/CD8+水平较术前降低,观察组降低幅度低于对照组(P<0.05),CD8+水平较术前升高,观察组升高幅度低于对照组(P<0.05),见表4。
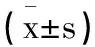
表4 手术前后T细胞亚群水平比较
2.6手术前后免疫球蛋白水平比较:术后3d,两组患者血清IgA、IgG、IgM水平较术前降低,观察组降低幅度低于对照组(P<0.05),见表5。

表5 手术前后免疫球蛋白水平比较
3 讨 论
我国胃癌发病率和病死率均较高,手术切除病灶是有效治疗手段,开腹手术创伤大、出血较多,而腹腔镜下手术视野清晰,施术者可准确观察腹腔内病变,进行精细操作,属于微创手术,对患者正常生理功能影响较小[6]。手术创伤导致患者出现应激反应,机体处于高代谢状态,表现为负氮平衡,且胃癌患者行根治术后肠道功能出现障碍,胃肠蠕动功能被抑制,导致营养吸收出现障碍。血清ALB、PA、RBP、TRF是反映机体营养和能量代谢情况的生化指标,也可反映胃癌患者术后转归情况[7,8]。本研究结果显示,两组患者上述指标均较术前降低,说明手术确实干扰了患者的正常能量代谢,而观察组降低幅度小则表明腹腔镜手术对机体损伤更小。DAO生理状态下在血液中含量不高,当肠道通透性增强时则由肠黏膜细胞进入到血液循环中,因此血浆中DAO水平与肠道屏障功能密切相关[9]。D-乳酸在生理状态下难以被人体吸收,但在肠道黏膜损伤的情况下可进入到血液循环中,其在血浆中水平越高则肠道屏障功能损伤越严重[10]。本研究中,观察组患者术后3d血浆DAO、D-乳酸水平均较术前升高,但上升幅度低于对照组,表明腹腔镜手术对肠道屏障功能的损伤更小。
外科手术后的免疫抑制可能增加术后感染几率,CRP是由IL-6诱导合成的急性时相反应蛋白,手术创伤越严重则血清中CRP、IL-6浓度越高,而TNF-α是具有抗肿瘤作用的炎症因子。本研究中,两组患者术后3d血清CRP、IL-6水平较术前升高,TNF-α水平较术前降低,其中观察组改变幅度小,说明腹腔镜手术导致的应激反应较小。既往研究认为[11],CD4+、CD8+作为T细胞参与肿瘤的免疫应答工作,发挥清除病毒和释放细胞因子的作用,CD4+/CD8+水平显著降低则有利于肿瘤细胞增生。IgA、IgG、IgM等免疫球蛋白则参与机体体液免疫,发挥抗肿瘤作用[12]。本研究结果显示,两组患者术后3d外周血CD4+、CD4+/CD8+水平以及血清IgA、IgG、IgM水平较术前降低,观察组改变幅度较对照组小,表明腹腔镜手术对免疫功能的损伤较小,有利于患者术后恢复。
本研究采取非随机对照的方式进行分组探讨,虽然一般资料有可比性,但实践中也发现腹腔镜手术患者术后进食时间相对较早,可能对本研究结果产生一定影响,发生结果偏倚,因此临床上考虑是否行腹腔镜手术与患者自身情况和意愿有关。腹腔镜的弱点在于操作空间有限,分离组织、清扫淋巴结、重建消化道等操作对术者的技术水平要求更高,且术中出现难以控制的大出血则需中转开腹手术,因此开腹手术无法被完全替代。医生在术前需向患者及家属说明腹腔镜手术适应证以及中转开腹手术的风险,不满足腹腔镜手术条件者则建议行开腹手术,得到同意后进行手术。
综上所述,与开腹手术比较,腹腔镜胃癌根治术对患者能量代谢、肠屏障功能、炎性应激水平和免疫功能的影响较小,有利于术后恢复,符合腹腔镜手术条件者建议首选此方式以减少创伤。

