耐高温工业酿酒酵母的筛选和发酵性能研究
张金伟,王小艳,张 颖,刘 辉,何太波,赵国淼,王泽兴,李 凡
(1.延安大学生命科学学院,陕西延安 716000;2.中粮营养健康研究院有限公司,北京 102209;3.中粮生化能源(肇东)有限公司,黑龙江哈尔滨 133010;4.河北环境工程学院,河北秦皇岛 066102)
液体燃料乙醇指以生物质为原料通过生物发酵等途径获得的可作为燃料用的乙醇,是近年来极为环保的可再生能源之一。随着我国“十四五”规划的提出,实现碳达峰、碳中和等目标也提上日程,液体燃料乙醇的开发和利用得到了更多的重视与研究[1-3]。酿酒酵母作为生产燃料乙醇最主要的发酵微生物,已形成了成熟的工业发酵技术体系,但在实际发酵过程中,乙醇产量和糖利用率很难达到理论水平,究其原因是由于工业发酵中的多重胁迫因素造成了酵母细胞的受损和生产性能下降,如发酵过程中温度升高造成的热胁迫,发酵底物造成的高糖渗透压,乙醇积累产生的细胞毒性等[4-5]。其中为控制发酵温度需要使用大量的冷却水,尤其在亚热带地区,过高的环境温度会极大地增加冷却水用量,增加发酵成本;此外不同的发酵原料带来的渗透压也有很大差异;实际工业发酵中,在保证乙醇产量不受影响的基础上,发酵温度每增加1 ℃都能节省大量的冷却水使用,因此对逆境耐受能力强的菌株能很大程度上降低发酵成本,产生可观的经济效益。
基因组的突变产生丰富的表型以适应环境的变化,这使得基因组具有极强的可塑性,为菌株的选育提供了基础[6-9]。酿酒酵母的菌株改造有很多方法,基于理性的基因组改造策略,如Luo 等[10]开发了一种能进行酵母染色体大量重排,诱导产生大的基因型多样性菌株的系统—ReSCuES,利用LoxP 序列的特异性重组结合营养缺陷型筛选得到环境胁迫条件下的耐受菌株。Mitsui 等[11]利用CRISPR/Cas9 编辑系统对转座子进行随机突变,成功地得到可以在39 ℃、低pH 值和高乙醇浓度下良好生长的耐热突变菌株T8-292。此外非理性策略如典型的实验室的适应性进化,通过缓慢改变外界环境模拟自然选择过程使得菌种自发突变朝着更适合生长的方向进行[12-13]。通过适应性进化的方法,Pereira 等[13]得到对3 种二元酸(戊二酸,己二酸和海松酸)有较强耐受性的酿酒酵母,Fletcher 等[14]提高了对有机酸和无机酸的耐受性。菌种的适应性进化被视为逆代谢工程的一种方法,通过积累有效的生物表型后再分析相应的分子基础也是工业微生物改造上的常见理念[2]。为了在短时间内通过实验室适应性进化获得耐受菌株,本实验通过基因组改造缩短了菌株实验室适应性进化所需时间,筛选获得了耐受能力较强的菌株,并对其发酵性能进行了评估。
1 材料与方法
1.1 材料、试剂
菌株:酿酒酵母为安琪公司的安琪超酒酵母,其最适生长温度为32 ℃。
主要试剂:酵母粉,Oxoid 公司;蛋白胨,Oxoid公司;氯化钠,北京化工厂;琼脂,Amresco 公司;琼脂糖,西班牙(上海分装);冰醋酸,北京化工厂;山梨醇,Amresco公司;Tris,Sigma公司。
YPD固体培养基:用于酿酒酵母和毕赤酵母的活化、培养及菌种保存,含有1 %酵母提取物,2 %蛋白胨,2 %葡萄糖,15 %琼脂,121 ℃条件下灭菌20 min。
1.2 基因组的改造
1.2.1 酵母的电击转化
取2 μg 左右基因片段或质粒轻轻加入一管感受态细胞中,注意加入体系不应超过感受态细胞体积的1/10。将加入转化片段或质粒的感受态细胞转入2 mm 预冷电转杯中,以1.5 kV,200 W,25 μF的条件电击5 ms。立即加入1 mL 无抗YPD 培养基,以30 ℃、170 r/min 摇床复苏1 h。取复苏后菌体以5000 r/min 离心5 min,弃去上清液,然后用500 μL 1 M 山梨醇重悬菌体,取1/10 涂布于YPD选择平板上,剩余接入含相应抗性的5 mL YPD 液体培养基中。于30 ℃恒温培养箱中培养2~3 d,平板进行转化子筛选。
1.2.2 基因组改造
基于重叠延伸PCR 技术[15],采用具有互补末端的引物RAD52-F&RAD52-MID-R 与RAD52-MID-F&RAD52-R,扩增获得L-Arm 与R-Arm 后将两条片段进行重组,将重组后的片段转化入酿酒酵母内,通过同源重组敲除RAD52 基因核心区域约890 bp达到酵母基因组的改造目的。
1.3 实验室的适应性进化与筛选
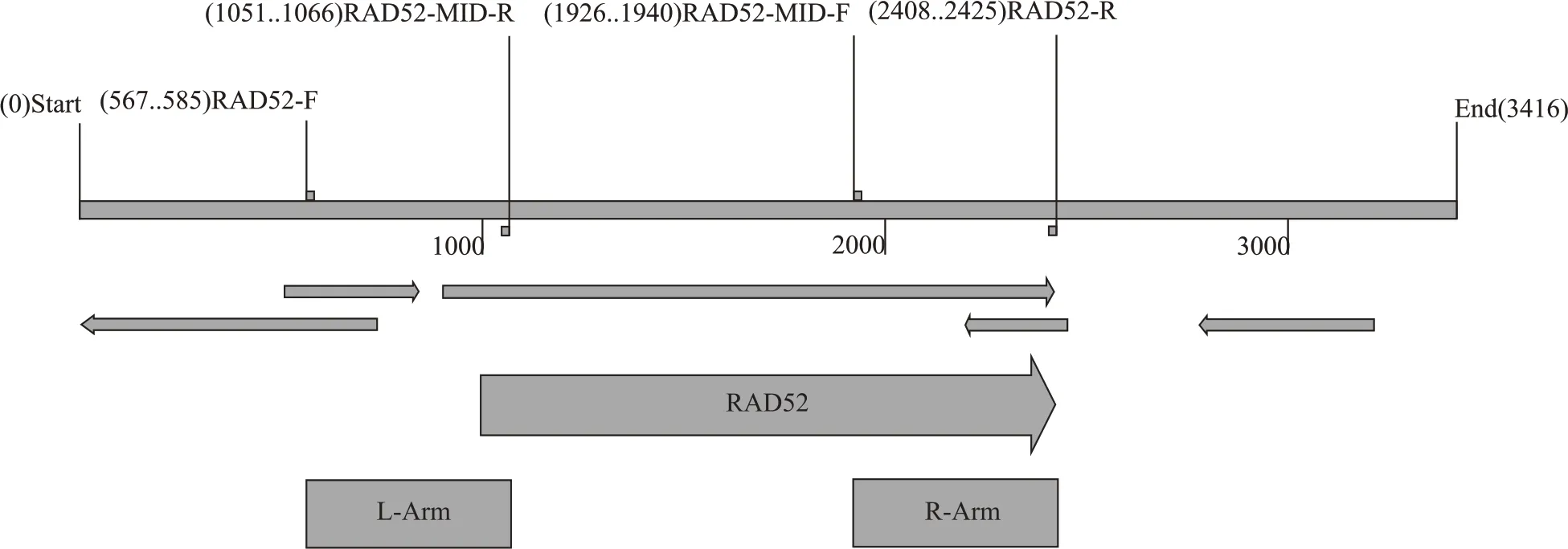
图1 RAD52基因的敲除
取原始工业菌株接种到YPD 液体培养基中于32 ℃下活化培养,不间断取样,测定其OD600nm处吸光值,待OD 值为10 左右,以10%的转接量转接至30%葡萄糖、2%乙醇、32 ℃下培养,期间不间断取样测定OD600nm处吸光值,OD 值为10 左右后完成一轮的适应性进化。第二轮以2 %转接量转至30 %葡萄糖、4%乙醇、34 ℃下培养,OD 值生长至10 左右再进行下一轮是适应性传代培养,每一轮依次增加2%的乙醇胁迫与2 ℃的温度,直至在30%葡萄糖、8%乙醇、40 ℃下生长至10 OD 后,取菌悬液涂布于30 %葡萄糖、8 %乙醇的YPD 固体平板于40 ℃生化培养箱中培养2~3 d。挑取较大的单菌落于32 ℃活化后接种液化醪,35 ℃摇瓶发酵验证其发酵性能。
1.4 发酵验证
取工业用液化醪,对筛选出的酿酒酵母进一步调整温度进行工业物料小试验证。工艺条件:工业用液化醪为底物,S.C D12 与对照菌株均接种于种子培养基(YPD 液体培养基)中,培养种子液至10 OD 左右,按0.125 亿/mL 液化醪计算用量,离心、水洗1 次,用生理盐水悬浮至2 mL,在1 L 摇瓶中加入350 g 液化醪中。发酵过程测试菌株试验组均进行温度调整(0~16 h、32 ℃,17 h、33 ℃,18 h、34 ℃,19~72 h、35 ℃),并加入对照菌株的空白试验组(不调整温度,一直控温32 ℃)进行对照。
2 结果与讨论
2.1 酵母菌生长曲线的测定
在进行实验室的适应性进化前,需要选择一个合适的转接和培养时间,一般来说菌株在对数生长的中后期具有较高的代谢活性并易于突变[16]。因此测定了菌株在30 %葡萄糖的YPD 中的生长曲线,如图2 所示在高糖浓度的YPD 中,菌株最高OD600可至20 左右,OD600为10 时正处于其对数生长中后期,因此选择OD600值在10左右时作为转接点,进行多轮的适应性进化。
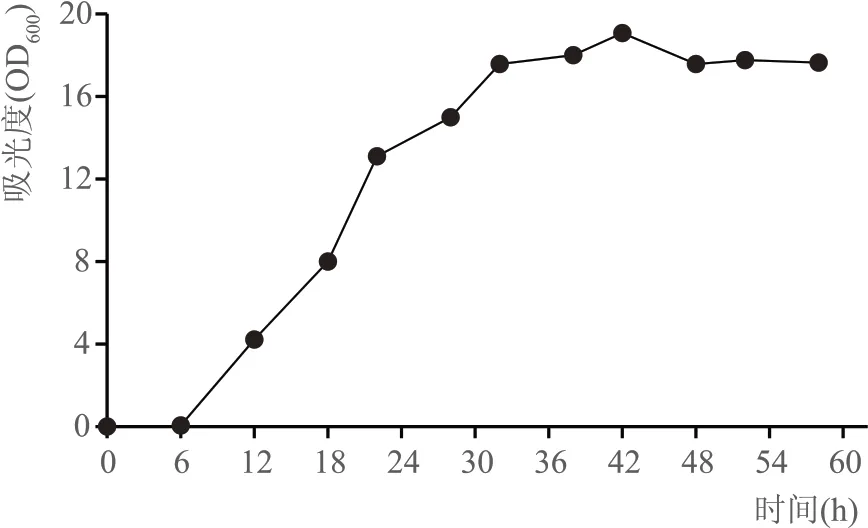
图2 出发菌株的生长曲线
2.2 基因组改造
基因组的改造是缩短实验室进化过程的基础,只有底盘宿主具有较高的突变率才能在胁迫环境下更快的发生突变产生有义突变表型。有研究表明,酿酒酵母RAD52 基因的缺失能导致宿主具有较高的突变能力[17],因此通过同源重组敲除宿主RAD52 基因后保证其具有较高的突变能力,能缩短实验室的适应性进化时间并筛选所需的多重抗逆工业酵母,RAD52 核心区域敲除后其结构如图3。

图3 RAD52基因改造后图谱
2.3 摇瓶验证(图4)
对筛选获得的5 株优势菌进行液化醪摇瓶发酵验证,使用肇东工厂生产线上的三期液化醪摇瓶发酵验证,35 ℃摇瓶发酵66 h,摇瓶发酵结果见图4,结果显示S.C D12 乙醇产量显著高于对照菌株,葡萄糖残留显著优于对照菌株。
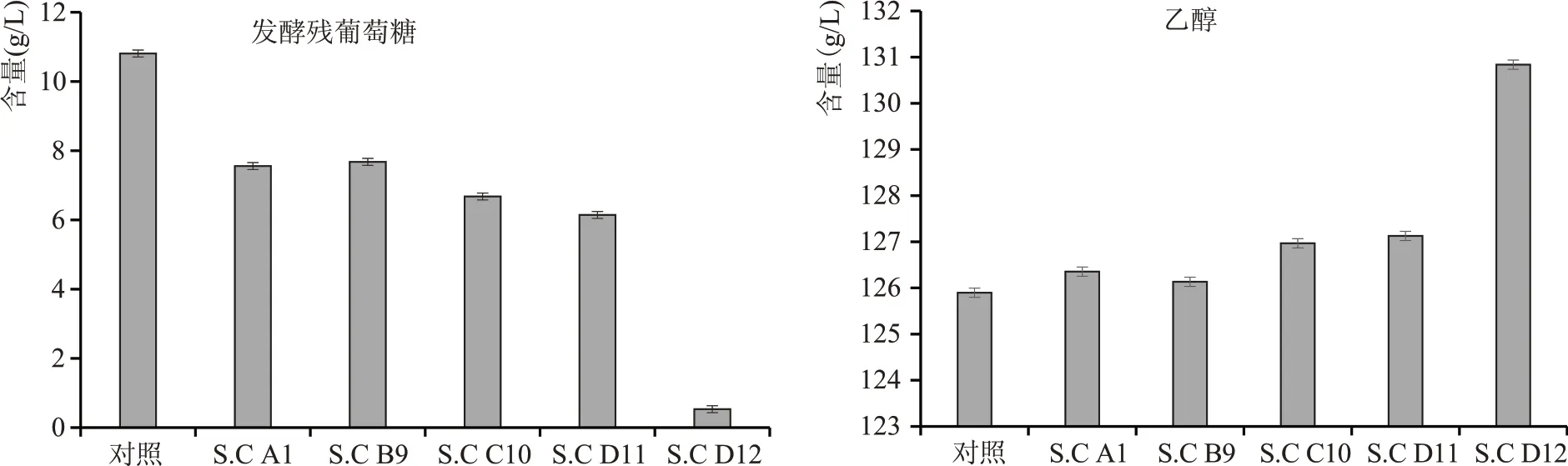
图4 发酵成熟醪残葡萄糖含量和乙醇含量
2.4 不同工业物料的摇瓶验证
为了验证S.C D12 在不同地区物料和不同配比物料中的发酵稳定性,我们选取了安徽地区工厂所用的糙米和小麦、广西地区工厂所用水稻和小麦进行了不同比例的混合和发酵验证,35 ℃摇瓶发酵66 h 后检测葡萄糖和乙醇,其结果如图5,可以观察到S.C D12 在不同地区物料和不同配比的情况下依然能保持良好的发酵性能,具有很强的稳定性。

图5 35 ℃不同地区物料与配比条件下的发酵成熟醪残葡萄糖和乙醇
2.5 工业物料小试验证
取肇东工厂生产线上的三期液化醪为发酵底物,对S.C D12与对照菌株进行发酵小试验证。发酵分为控温(32 ℃)和温度调整(0~16 h、32 ℃,17 h、33 ℃,18 h、34 ℃,19~72 h、35 ℃)。对照菌株分别使用控温和温度调整组进行发酵,S.C D12 使用温度调整组发酵并与对照菌株进行比较。发酵成熟醪酒精度如图6 所示,在温度调整的高温情况下(35 ℃),工程菌株S.C D12乙醇产量为12.50%vol,较出发菌株提升了0.53%vol,残总糖1.93 g/100 mL,较出发菌株降低了0.82 g/100 mL,S.C D12 在高温下与对照菌株在正常温度下的发酵性能相当,具有良好的稳定性。发酵产物HPLC 检测结果见表1,菌株S.C D12 在高温下的发酵各项指标均达到对照菌株正常控温条件下的发酵性能。
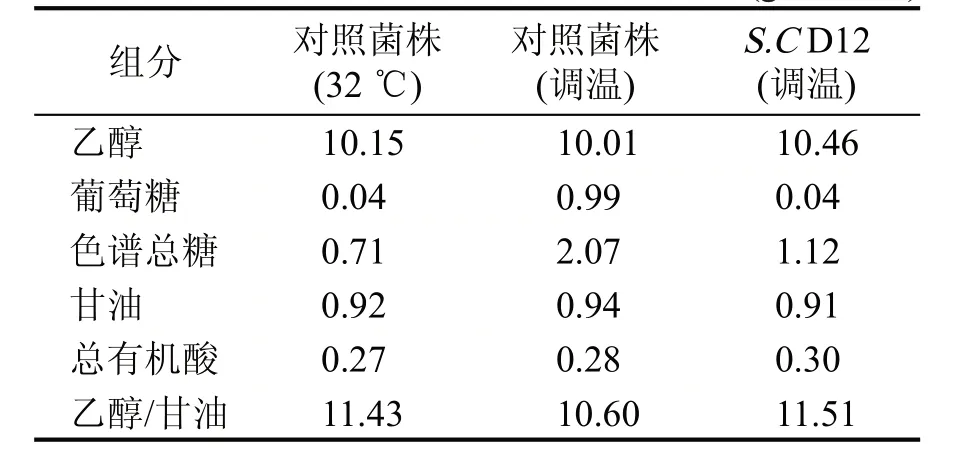
表1 S.C D12菌株与对照菌株发酵HPLC数据 (g/100 mL)
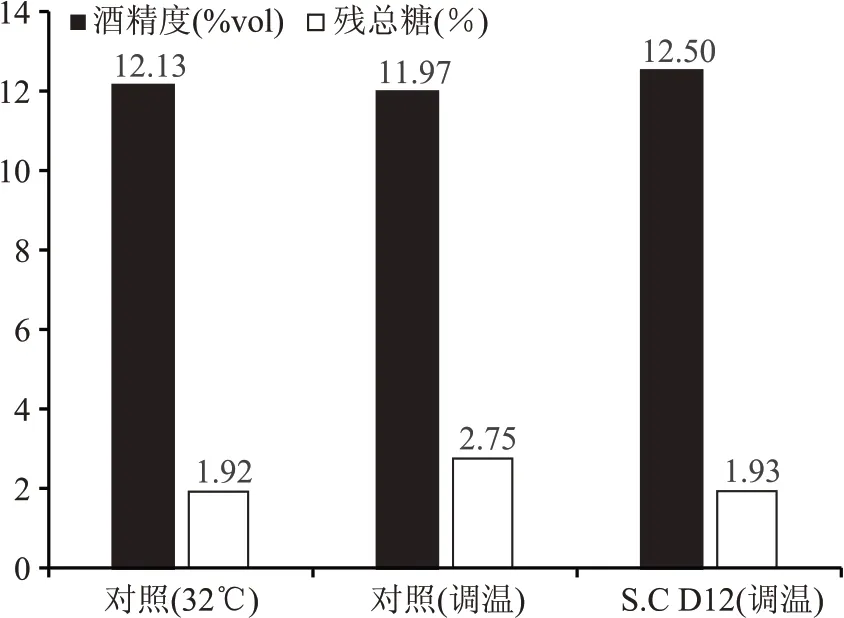
图6 S.C D12菌株与对照菌株发酵结果
3 结论
与传统的实验室进化方法相比,对基因组进行改造后的菌株能极大的缩短实验室适应性进化所需的时间,在数周内即可获得优良的工业酿酒酵母。本研究中就基于此方法筛选获得了1 株能高产乙醇的抗逆菌株S.C D12,工业物料小试发现,35 ℃高温下仍然能保持良好的乙醇产量和较低的残糖,且发酵性能与对照菌株在32 ℃下基本一致,适合于工业化生产,能极大的节约工业上冷却水的使用,降低发酵成本。

