长病程低疾病活动度系统性红斑狼疮患者心血管疾病危险因素分析
王硕林,李伟,李天方,刘升云
(郑州大学第一附属医院 风湿免疫科,河南 郑州 450000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及多系统的慢性自身免疫性疾病,系统性红斑狼疮疾病活动度评分2000(systemic lupus erythematosus disease activity index 2000,SLEDAI-2K)是评估SLE严重程度的重要指标之一,被广泛应用于评估SLE患者的疾病活动性,SLEDAI-2K≤4的患者被认为基本无疾病活动[1]。心血管疾病是SLE常见并发症之一,原因尚不明确[2]。研究表明,SLE患者死亡年龄呈现双峰特征,患者早期的死因是感染、神经系统疾病等,疾病进展至晚期阶段,患者大多死于心血管疾病[3]。然而,由于缺少对SLE患者心血管疾病风险的确切评估以及对其长期管理的不足,SLE患者的心血管疾病死亡率以及死亡模式长时间内并未改变。对于非SLE患者,Framingham评分是目前运用最广的心血管风险评估系统,其根据传统心血管危险因素评估患者10 a后患上心血管疾病的风险;QRISK评分于2007年于英国被开发出来后,广泛应用于评估患者10 a内患心血管疾病的风险,经过不断的迭代更新,形成了现在的第3代算法——QRISK3,该算法除传统心血管危险因素外,还纳入SLE、糖皮质激素使用等指标,这使得其更适用于SLE患者[4-5]。由于来源数据库及算法的不同,Framingham评分与QRISK评分在SLE患者中的评估效能尚未得到验证。本研究旨在比较Framingham评分及QRISK3预测模型在长期稳定的SLE患者中的应用效果,探究长病程低疾病活动度的SLE患者心血管系统的危险因素,为更好地长期管理SLE患者的心血管疾病风险以做到早期干预治疗提供理论依据。
1 对象与方法
1.1 研究对象以2020年6月至2021年1月郑州大学第一附属医院风湿免疫科门诊诊治的SLE患者为研究对象。(1)纳入标准:①符合1997年美国风湿病学会对SLE的分类标准[6];②年龄≥30岁(按照算法要求);③SLEDAI评分≤4分;④确诊时间≥5 a;⑤糖皮质激素(按泼尼松龙剂量换算)≤10 mg·d-1。(2)排除标准:①合并有肿瘤、神经精神症状等严重并发症;②肝、肾功能严重损伤;③肺炎等严重感染需要抗生素治疗;④既往或者现在诊断有心脏病;⑤病历资料不全。本研究符合医学伦理学标准,经医院医学伦理委员会批准(审批号:2020-KY-447)。所有患者均知情同意。
1.2 10 a内心血管疾病风险评估标准所有患者均接受QRISK3和Framingham评分体系的风险评分,分别依据QRISK3模型计算公式(https://qrisk.org/three/)及Framingham评分标准[4]获得。
1.3 分组方法QRISK3模型和Framingham评分大于10%定义为高风险人群,据此将患者分为QRISK3高风险组、QRISK3低风险组以及Framingham高风险组和Framingham低风险组。
1.4 观察指标收集并分析患者性别、年龄、身高、体质量在内的人口学资料,以及病程、血压、股骨头是否坏死、是否有雷诺现象、既往是否有心血管疾病等临床资料。血常规、尿常规、肝功能、肾功能、血糖、血脂、红细胞沉降率、C反应蛋白等实验室检查指标及目前治疗药物也被纳入分析。
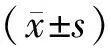
2 结果
2.1 一般资料共纳入92例患者,女86例(93.5%),男6例(6.5%),2例(2.2%)吸烟,8例(8.7%)肥胖[体质量指数(body mass index,BMI)>28 kg·m-2],24例(26.1%)合并高血压,23例(25.0%)有偏头疼,13例(14.1%)有心脏病家族史。此外,20例(21.7%)完全停用糖皮质激素,26例(28.3%)目前未接受免疫抑制剂治疗,12例(13.0%)除羟氯喹外未服用其他药物治疗SLE。患者中位年龄为36.0(32.0,47.0)岁,中位病程为10.0(8.0,13.0)a,18例(19.6%)合并代谢综合征。38例患者血脂异常,中位总胆固醇水平为4.2(3.5,5.0)mmol·L-1,甘油三酯水平为1.2(0.9,1.8)mmol·L-1,高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平为(1.3±0.3)mmol·L-1,低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平为2.4(1.8,2.8)mmol·L-1。
2.2 10 a心血管疾病危险因素根据Framingham评分系统被定义为高风险的患者有6例(6.5%),根据QRISK3模型被定义为高风险的患者有18例(19.6%)。被Framingham评分系统识别为高心血管疾病风险的患者均被QRISK3算法识别,未被Framingham系统识别为高风险而被QRISK3算法识别为高风险的患者有12例(13.0%)。Framingham指数报告的中位风险评分为2.4%(3.9%,1.5%),QRISK3算法报告的中位风险评分为3.9%(7.0%,1.7%)。非参数Wilcoxon秩和检验显示,QRISK3算法所得出的10 a心血管疾病风险大于Framingham评分,差异有统计学意义(P<0.001)。见图1、2。

图1 QRISK3与Framingham评分对92例系统性红斑狼疮
2.3 危险因素分析对92例SLE患者按照基于QRISK3算法的心血管疾病风险进行分组,高心血管疾病风险的患者年龄更大(P=0.001),总胆固醇(P=0.030)及甘油三酯(P=0.005)水平更高,代谢综合征发生率更高(P=0.001),羟氯喹日剂量更小(P=0.041),初诊时SLEDAI-2K更高(P=0.038)。见表1。

图2 QRISK3与Framingham评分对92例系统性红斑狼疮

表1 高危组与低危组SLE患者临床特征比较

表1(续)
3 讨论
心血管疾病是导致SLE患者死亡的最常见原因之一,研究显示,SLE患者的动脉硬化程度高于正常水平[7],心肌梗死是高达30%的SLE患者的主要死亡原因[8]。目前SLE患者并发心血管疾病的原因尚未明确,国际上普遍认为SLE患者过早的心血管系统受累是传统心血管风险、免疫紊乱和糖皮质激素治疗副作用共同作用的结果[9-10]。此外,缺少有效的评估系统以及因对SLE疾病活动度的过度关注而忽略的心血管疾病的长期管理亦可增加SLE患者并发心血管疾病的风险。通过对不同模型进行验证比较从而筛选出相对有效的评估体系以及在长期管理中关注除传统危险因素以外的SLE患者独特的心血管疾病危险因素,对于降低SLE患者心血管疾病发生率有重要意义。
目前临床上较为认可的10 a心血管疾病风险评估体系是Framingham评分,但其并未将SLE特异性指标对心血管系统的影响考虑在内,故其对SLE患者心血管疾病风险评估的准确性有待考证。QResearch是一个收集了来自4 500万例匿名患者健康记录的大型数据库,QRISK系统是2007年基于QResearch数据库得到的预测算法,除心血管疾病的传统危险因素外,QRISK3(QRISK系统第2次迭代更新后的算法)还纳入了包括是否摄入糖皮质激素、是否患有SLE等SLE相关指标,有利于更好地识别SLE患者中心血管疾病的高风险人群。在本研究中,Framingham评分所识别出的6例高风险患者均被QRISK3算法识别,此外,有14例被Framingham评分识别为低危的患者被QRISK3算法识别为高风险人群,可以发现,QRISK3算法相较于Framingham评分能够识别出更多的心血管疾病高风险患者,这可能是因为SLE患者本身存在的炎症反应和免疫紊乱以及糖皮质激素治疗导致的血脂异常是除传统心血管疾病危险因素之外的独立危险因素,而QRISK3算法能够将其纳入计算范围。所以,临床上对SLE患者进行心血管疾病风险评估时采用QRISK3算法可能更能准确识别出有潜在风险的患者。
代谢综合征是包括一系列心血管危险因素在内的症候群,包括肥胖、高脂血症和高血糖等,是心血管疾病的独立危险因素。在正常人群中,代谢综合征的发病率为10%~84%,其在SLE患者中更加普遍[11-12],可能与慢性炎症和长期糖皮质激素治疗有关。本研究数据提示,患有代谢综合征的患者C反应蛋白水平较未患代谢综合征的患者高,而二者在糖皮质激素使用剂量上无差异,这可能是因为在患者入组时糖皮质激素的剂量被严格控制。此外,本研究数据提示,患有代谢综合征的个体有更高的全因死亡率和死于心血管疾病的风险,这与Kip等[13]的研究结果一致,这可能与瘦素的产生有关,这种脂肪因子可以通过激活Janus激酶/信号转导与转录激活子(JAK/STAT)信号通路调控自身炎症反应及脂质代谢从而导致心血管系统的负担加重,进一步增加心血管疾病的风险[14]。
目前的研究表明,羟氯喹对风湿性疾病中传统的心脏危险因素起到保护作用,可降低血脂,降低糖尿病风险,抗血栓形成。羟氯喹通过影响胆固醇生物合成途径抑制2,3-环氧角鲨烯羊毛固醇环化酶催化的酶作用,使胆固醇生物合成中的中间体羊毛酯醇的合成停止,从而抑制胆固醇的合成[15]。本研究结果显示,高危组患者羟氯喹日均摄入量较低危组患者少。此外,低危组患者胆固醇和甘油三酯水平低于高危组患者,这可能与羟氯喹对血脂水平的有益影响有关。虽然对于羟氯喹的确切作用机制尚无普遍的共识,但根据一项最近的荟萃分析,羟氯喹对SLE患者血脂水平的影响较为显著[16]。此外,羟氯喹还可以靶向作用于烟酰胺腺嘌呤二核苷酸磷酸氧化酶(该酶参与许多炎症和血栓前信号通路),从而调节炎症水平等,进而对SLE患者心血管起到保护作用[17]。因此,羟氯喹作为SLE治疗过程中的常用药,其对SLE本身的治疗作用和对心血管系统疾病的防治作用都有重要意义。
本研究显示,在病程长病情稳定的SLE患者中,高心血管疾病风险与确诊时的疾病活动度有关,这提示SLE在疾病初始阶段即会对心血管系统造成一定损伤,且该损伤不可逆,即使SLE在经过诱导缓解后达到长期稳定的状态并维持相当长一段时间,心血管系统的损伤依然存在,这可能与SLE患者本身的炎症反应和免疫紊乱对内皮细胞产生的不可逆损伤有关。本研究结果还显示,在病程长病情稳定的SLE患者中,当前SLEDAI-2K评分与心血管疾病患病风险无相关性,即只要病情长时间保持稳定,SLE本身对心血管系统造成的负面影响较小。以上信息提示,在SLE疾病初始阶段就应尽早尽快地控制疾病活动,以达到规避心血管疾病患病风险的目的。
在治疗方面 ,本研究显示,尽管38例患者存在血脂异常的问题,然而仅2例患者接受降脂治疗,提示SLE患者的高脂血症问题易被忽视[18],他汀类药物干预对SLE患者高脂血症的影响常常被低估。实际上,合并高脂血症的SLE患者应用他汀类药物进行降脂治疗是有意义的,因为较高的血脂水平与SLE患者高心血管疾病患病风险有关[19],有证据表明,无论基线风险如何,他汀类药物降脂治疗能降低其20%~25%的心血管疾病风险[18]。他汀类药物不仅可以改善SLE患者的血脂水平和心血管预后,还可以发挥多种免疫调节作用。他汀类药物除了可减少白介素-6和白介素-10的生成,抑制α-干扰素及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的产生,还能降低SLE患者Ⅰ型可溶性TNF-α受体(soluble TNF-α receptor Ⅰ,sTNFR-Ⅰ)水平,因为sTNFR-Ⅰ参与抗凋亡/炎症途径,所以这种受体的减少能潜在减轻SLE患者的内皮功能失调,降低心血管所受损伤[18]。简短来说,无论是他汀类药物的降脂作用还是免疫调节作用都是被低估的,因此欧洲抗风湿病联盟(European League Against Rheumatism,EULAR)建议对于有血脂异常和其他传统心血管疾病危险因素的SLE患者常规使用他汀类药物[20]。
本研究存在以下局限性:本研究为单中心横断面研究,存在一定的选择偏倚;本研究采用的是2种预测算法而不是实际的心血管事件或早期病变来评估心血管疾病风险,准确性有待提高。基于以上两点,本研究描述的结果应谨慎解释,并在未来的研究中加以验证。
综上所述,本研究对比了Framingham评分与QRISK3算法对长病程低疾病活动度SLE患者心血管疾病患病风险的评估效能,并对在SLE患者的长期管理中影响心血管疾病患病风险的SLE相关因素进行了分析。临床医生在诊治SLE的同时,应运用有效的评估体系对患者的心血管疾病患病风险进行评估,尤其是对于年龄较大、血脂水平较高、合并有代谢综合征以及初诊时疾病活动度较高的患者,做到及时发现和干预治疗,降低心血管疾病的发病风险。

