Neuroform EZ支架治疗大脑中动脉重度狭窄的效果
裴中豪,闫磊,李治国,水少锋
(郑州大学第一附属医院 介入科,河南 郑州 450052)
欧美国家缺血性脑卒中发病的主要原因是颅外颈动脉狭窄,而亚洲患者脑卒中发病的重要原因是颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS),其占缺血性脑卒中病因的9%~37%,大脑中动脉是主要的发病部位[1-2]。大脑中动脉重度狭窄造成的脑部血流供应减少,易引起严重神经功能障碍,非常影响患者正常生活,即使经规范的药物治疗,ICAS患者卒中复发风险仍较高。相关研究显示,颅内动脉狭窄>70%的患者经药物治疗1 a后卒中率仍达23%[3]。Wingspan支架植入术曾被认为是治疗ICAS较有效的方式,能有效改善患者脑部血供并减轻神经系统症状[4],但2011年的一项随机试验(SAMMPRIS)的后续数据表明,对比颅内动脉狭窄支架植入与严格的药物治疗,选择性经皮腔内血管成形术和支架植入术的不良结局及围手术期并发症发生率较高,支架组脑卒中率和死亡率远高于药物治疗组,导致支架植入术的预后并不优于严格的药物治疗[5-6],这给颅内血管治疗的前途带来了阴影,但出于该试验选择的支架类型单一、术者经验较少、试验设计局限于当时的支架治疗水平等方面的原因,其结论可靠性受到质疑。随着近年来医疗手段的不断进步及医疗器械的更新换代,国内外逐渐开始尝试将颅内支架应用于ICAS的治疗中,并取得了良好的临床效果。Neuroform支架最初的开发目的是辅助栓塞宽颈颅内动脉瘤,随着支架技术的不断更新,现在Neuroform EZ支架逐渐开始应用于颅内血管狭窄的治疗中。本研究回顾性分析经Neuroform EZ支架治疗的大脑中动脉M1段重度狭窄患者的临床资料,探讨Neuroform EZ支架治疗的安全性和有效性。
1 对象与方法
1.1 研究对象回顾性分析2016年7月至2018年9月于郑州大学第一附属医院介入科接受Neuroform EZ支架治疗的25例大脑中动脉M1段重度狭窄患者的临床资料,患者均签署手术知情同意书。
1.2 纳入及排除标准(1)纳入标准:①大脑中动脉M1段重度粥样硬化性狭窄,数字减影血管造影(digital subtraction angiography,DSA)显示靶血管狭窄程度为70%~99%,术前术后残余狭窄率按WASID法[3]计算;②ICAS药物治疗效果欠佳;③狭窄区域侧支循环不良。(2)排除标准:①非ICAS;②3个月内出现过颅内出血;③血管完全闭塞;④拒绝接受介入手术。
1.3 术前准备术前利用计算机断层扫描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)检查患者脑组织具体情况,利用磁共振血管成像(MR angiography,MRA)或CT血管成像(CT angiography,CTA)评估患者血管情况,采用美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)评价患者术前神经缺损状况。患者术前服用阿司匹林肠溶片(Bayer Vital GmbH,注册证号H20130339)每天100 mg,硫酸氢氯吡格雷片(Sanofi Clir SNC,注册证号J20180029)每天75 mg,至少服用5 d预处理,强化调脂治疗,直到血栓弹力图示血小板抑制率在有效范围内(花生四烯酸途径抑制率>70%,二磷酸腺苷途径抑制率>30%)[7]。术前血压控制在较基础血压低15%的范围内。通过DSA测量患者靶血管处正常管径、狭窄的直径和长度,选择合适的支架进行治疗。
1.4 手术过程在全身麻醉下选用改良Seldinger穿刺法进行股动脉插管,置入6 F(1 F表示周长1 mm,直径约0.33 mm)动脉鞘进行全身肝素化处理(1 mg·kg-1),术中应用肝素使活化的部分凝血酶原时间维持在150~250 s。将6 F Guiding导引导管置入颈内动脉恰当位置,然后进行DSA测量病变处狭窄程度及长度,按照狭窄程度选取合适的Gateway球囊(一般为目标血管正常直径的80%左右)。通过微导管与0.014英寸(0.014英寸=0.355 6 mm)Synchro微导丝(美国Stryker公司)穿过狭窄处到达远端动脉,然后换成Transend 300微导丝(美国Stryker公司),撤出微导管后,Gateway球囊沿微导丝到达狭窄处并预扩张直到球囊达到6 atm(6 atm=6.06×105Pa)压力,持续11 s。球囊释放压力后再次通过DSA观察狭窄程度,若不理想则再次扩张。撤出球囊后,沿微导丝置入XT-27微导管(美国Stryker公司),接着撤出微导丝,将合适型号的Neuroform EZ支架(美国Stryker公司)沿微导管进行释放,选择直径比拟建动脉直径大0.5~1.0 mm、长度比病变长度多≥3 mm的支架。支架放置后即刻进行造影,测量目标血管的狭窄情况,行Dyna CT扫描查看是否有颅内出血。术后严格控制患者血压(比基础血压低20%~30%),给予持续6个月的双联抗血小板药物治疗,后改为长期单药抗血小板治疗,同时控制血脂、血糖。
1.5 术后随访术后30 d进行电话随访,使用改良Rankin量表(modified Rankin scale,mRS)评估患者预后,在术后3~6个月及1 a时通过DSA复查狭窄处血管情况,之后每年进行随访,判断是否出现支架内再狭窄(in-stent restenosis,ISR)等并发症。ISR定义:支架及其两端5 mm范围内狭窄超过50%或管腔绝对狭窄超过20%[8]。
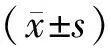
2 结果
2.1 一般资料25例患者中男20例(80%),女5例(20%),年龄(58.72±8.87)岁,5例(20%)患者有吸烟史。术前14例(56%)表现为责任血管供血区脑梗死,8例(32%)为短暂性脑缺血发作,3例(12%)无症状。16例(64%)合并高血压,7例(28%)合并高脂血症,7例(28%)合并糖尿病。
2.2 围手术期情况25例患者共25处病变,植入26枚Neuroform EZ支架,手术成功率为100%,无死亡病例。支架植入术前狭窄率为(84.96±8.27)%,支架植入术后即刻狭窄率为(14.60±3.08)%,差异有统计学意义(t=42.691,P<0.001)。围手术期2例(8%)患者出现新发症状,其中1例(4%)于支架植入术后2 d出现支架内血栓,经过溶栓并再次放置1枚支架后,狭窄处血流恢复通畅,预后良好。另外1例(4%)术后即发生穿支梗死,预后不良。术前20例(80%)患者NIHSS评分≤3分,出院时22例(88%)NIHSS评分≤3分,术后30 d随访时24例(96%)MRS评分≤2分。
2.3 随访情况随访11~15个月,平均随访(13±1)个月,25例患者均按时接受DSA检查。术后6个月复查造影时1例(4%)患者大脑中动脉M1段病变处出现ISR,余患者未出现ISR或其他新发并发症。出现ISR的患者再狭窄率为70%,伴神经功能缺损症状,经球囊扩张后,狭窄率降低至15%,血流恢复通畅,症状改善。术后1 a复查DSA时未发现ISR及伴随新发并发症的患者。1例患者Neuroform EZ支架成形术前后及术后12个月随访造影结果见图1。

A.支架植入前,箭头所指为狭窄处;B.术后即刻;C.术后12个月。
3 讨论
大脑中动脉是亚洲人ICAS最常见的部位,有症状的大脑中动脉粥样硬化性狭窄患者脑卒中再发风险高,残疾、死亡率高,单纯药物治疗效果不佳,血管内支架成形术是一种有效的补充治疗方法[9-12]。Wingspan支架系统用于ICAS的治疗,具有良好的输送系统和径向力,临床应用较广泛,手术成功率及安全性较高,然而其却在SAMMPRIS试验中失败了,这与此试验的设计和Wingspan支架的一些缺点有关[13-18],颅内支架植入术的安全性尚需进一步研究。
在过早停止的SAMMPRIS试验中,不良结果很大程度上归因于穿支动脉闭塞继发缺血性卒中等并发症。穿支动脉卒中的机制主要是放置具有较高径向力的支架后斑块受到挤压移位,虽然较大的径向力可更好地扩大管腔以改善血流,但粥样硬化斑块碎片夹在扩张的支架和动脉壁间时可能会被迫进入穿支动脉,这被称为“雪犁效应”,并可能构成与支架植入相关的穿支动脉闭塞的主要风险[19-21]。Wingspan支架产生的径向支撑力比Neuroform EZ支架大得多,这是Wingspan支架容易导致“雪犁效应”的重要原因。Neuroform EZ支架径向支撑力小于Wingspan支架,强于Enterprise支架[22]。Enterprise支架是闭环设计,在血管转角处易发生扭转,因此适用范围较Neuroform EZ支架窄。从理论上讲,考虑到支架的物理特性,具有适当径向力的支架可能有助于解决“雪犁效应”,Neuroform EZ支架可能是一个更加合适的选择。本研究结果显示,使用Neuroform EZ支架后,围手术期2例(8%)患者出现新发症状,其中1例于支架植入术后2 d出现支架内血栓,另外1例术后即发生穿支梗死,无死亡病例,远低于SAMMPRIS试验中Wingspan支架植入组围手术期卒中率(14.7%)[5],说明Neuroform EZ支架较Wingspan支架具有更好的安全性。该结果背后的基本原因可能是Neuroform EZ支架比Wingspan支架更灵活,施加的径向力更小,且其网眼较大,可以有效降低“雪犁效应”及其他并发症的发生率。治疗ICAS时应结合患者及其自身血管条件选择合适的支架,本研究100%的手术成功率和较低的并发症发生率与对患者的严格筛选和神经介入医生手术经验丰富有一定关系。Wang等[23]的研究结果显示,因为Wingspan支架的径向支撑力比Neuroform EZ支架大,更容易刺激血管内膜增生,从而导致支架内再狭窄的发生率较高。本研究所有患者均严格遵医嘱按时服药,仅1例(4%)患者出现ISR,远低于Feng等[24]研究中7.5%~32.4%的ISR发生率。所有患者经支架植入治疗后症状改善率达84%,治疗效果良好。只有1例责任血管供血区脑梗死患者在支架植入后发生了穿支动脉梗死而预后不良,余脑梗死和TIA患者临床症状均获极大改善或痊愈,无症状患者术后也未出现并发症,24例患者出院时NIHSS评分不同程度降低。术后30 d随访时的MRS评分显示除1例患者出现穿支动脉梗死致其MRS评分达到4分外,余24例患者预后良好,MRS评分均≤2分,提示Neuroform EZ支架对大脑中动脉M1段粥样硬化性重度狭窄疗效较好。
Neuroform EZ支架作为开环、蚀刻支架,释放过程中节段性张开并锚定在目标动脉上,支架移位较少,尤其适用于迂曲、成角的动脉,可适应大脑中动脉分叉处的复杂情况,同时由于Neuroform EZ支架开始是被设计用于辅助栓塞动脉瘤,其易通过微导管被输送至病变部位[25]。相比之下,Wingspan支架输送系统的双锥形尖端设计使得输送、展开和回收均较困难,并增加了由于严重的颅内动脉扭曲而导致患者出现血管损伤等并发症的风险。Neuroform EZ支架也有不足之处,其传送微导管XT-27(0.69 mm,美国Stryker公司)的管径较粗,通过狭窄时可能会导致并发症的发生。据悉,新一代Neuroform Atlas支架能在更小直径的微导管(0.43 mm)中输送,可有效避免该问题[26]。
综上所述,对于大脑中动脉M1段重度狭窄的患者,使用Neuroform EZ支架进行血管内治疗具有较好的疗效和较高的安全性,围手术期并发症发生率低,未来有望更加广泛地应用于大脑中动脉M1段重度狭窄患者中。本研究存在许多不足之处,样本量小,随访时间短,而且是单中心研究,且是回顾性分析,为进一步证实该支架在治疗大脑中动脉粥样硬化性重度狭窄中的疗效及安全性,开展多中心临床随机对照研究势在必行。

