黑龙江省主栽红小豆品种蛋白质功能性质分析
沈鑫婷 许馨予 杨鹄隽 贾 斌,3 张慧敏,3 左 锋
(黑龙江八一农垦大学食品学院1,大庆 163319)(黑龙江八一农垦大学国家杂粮工程技术研究中心2,大庆 163319)(粮食副产物加工与利用教育部工程研究中心3,大庆 163319)
红小豆,又名赤豆,种子暗红色,长圆形,原产于中国,有2 000多年栽培历史[1]。在我国南北都有种植,其中黑龙江种植面积及产量均最大,约占全国的50%[2]。红小豆富含多种活性成分,其中蛋白质质量分数21%~23%[3],并且其氨基酸组成较为丰富,其必需氨基酸含量高于FAO/WHO标准,因此具有较高营养价值,被作为食品加工的优质原料[4,5]。同时,红豆的功能价值也很高[6,7]。
随着人们对健康饮食的需求,对红小豆营养价值及功能特性的研究也日益深入。Liu等[8]利用酶法提取红小豆蛋白,提取率最高可达73.34%,其中球蛋白占红豆总蛋白含量的一半以上,说明红小豆蛋白是一种成本低且功能性质良好的蛋白质。任传英等[9]对红小豆进行成分及抗氧化活性分析,结果表明其总酚、总黄酮含量分别为2.48、4.03 mg/g,DPPH清除率达85%,总抗氧化能力为529.47单位/g,具有明显的抗氧化能力。Meng等[10]对红小豆蛋白进行结构和功能性质分析结果表明:红小豆蛋白富含有一定α-螺旋和β-转角结构,与商业大豆相比,红小豆蛋白的溶解性、乳化性及乳化稳定性更强,并且由于其疏水性较弱,还具有较低的水化能力和较强的脂肪结合能力。张波等[11]将红小豆蛋白质与大豆蛋白做对比,在不同pH条件下红小豆蛋白溶解度明显优于大豆蛋白,且其乳化稳定性、起泡性均高于大豆蛋白,最低凝胶点也更低。
为深入了解黑龙江主栽品种红小豆蛋白质功能特性,本研究以黑龙江主栽红小豆品种状元红、农垦红二号、品鉴红、农安红、宝清红为研究对象,利用荧光及紫外分光光度法对其溶解性、乳化性、起泡性等功能特性进行研究,以期为红小豆等杂粮作物的产品开发和精深加工提供参考。
1 材料与方法
1.1 材料与试剂
红小豆:状元红、农垦红二号、品鉴红、农安红、宝清红;花生油。盐酸、氢氧化钠、Tris-Gly试剂、Ellman试剂、巯基乙醇、8-苯胺基-1-荼磺酸(ANS)、磷酸二氢钠、磷酸氢二钠、十二烷基磺酸钠(SDS)、氯化钠:分析纯。
1.2 仪器与设备
Scientz-10N冷冻干燥机,K9540凯氏定氮仪,UV2450紫外可见分光光度计,LS-55荧光分光光度计。
1.3 试验方法
1.3.1 红小豆蛋白的制备
参考尹秀莲等[12]方法,稍作改动。将5种红小豆洗净烘干,粉碎过筛。磨粉后按照1∶5的比例溶于石油醚搅拌5 h,旋蒸,按照1∶20比例加入去离子水,用1 mol/L NaOH调节pH至9,搅拌时间2 h,3 500 r/min离心25 min,取上清液,再用1 mol/L HCl调节pH至4.0,静置1 h,3 500 r/min离心25 min,取沉淀冷冻干燥。
1.3.2 红小豆蛋白质功能性质测定
1.3.2.1 溶解性测定
参考冯玉超等[13]方法,利用凯氏定氮法测定样品总蛋白含量,记为m2,再配制浓度为10 g/100 mL的蛋白质溶液,用HCl和NaOH分别调pH,室温下搅拌1 h,离心,取上清液,以牛血清蛋白为标准品,用福林-酚法测定蛋白质含量,记为m1,计算NSI。
1.3.2.2 表面游离巯基及总巯基含量测定
配制50 g/L蛋白质溶液,离心后取2 mL上清液,加入5 mL Tris-Gly和0.1 mL Ellman试剂,混匀后室温静置15 min,在412 nm处测其吸光度,记为A,稀释倍数记为D。计算得出表面巯基含量[14]。
取2 mL上清液,加入5 mL tris-Gly-8MUrea-0.5%缓冲液和0.1 mL Ellman试剂,重复1.3.2.2步骤,计算得到总巯基含量。
1.3.2.3 表面疏水性测定
采用ANS为探针,利用磷酸盐缓冲液配制成不同浓度蛋白质溶液,离心,取2 mL上清液,设定激发波长390 nm,发射波长470 nm,夹缝宽度5 nm,测定荧光强度,记为FI0;另取2 mL上清液,加入10 μL 8 mmol/L ANS,室温静置1 h,测定荧光强度,记为FI1。以蛋白质浓度为横坐标,FI0为纵坐标做图,表面疏水性指数为曲线初始阶段的斜率,记为S0[15]。
FI0=FI1-FI2
1.3.2.4 起泡性及起泡稳定性测定
取5 mL红小豆蛋白溶液,高速分散器搅打2 min,总体积记为V1,泡沫体积记为V2,静置,记录泡沫体积,记为V3[16]。
1.3.2.5 乳化性及乳化稳定性测定
配制不同浓度蛋白质溶液,加入15 mL花生油,高速分散器搅打5 min。取100 μL均质后的试液,用质量分数为0.1%的SDS稀释50倍,500 nm处测其吸光值,记为A1,一段时间后重复测定,记为A2[17,18]。
EA=A1×50
1.3.2.6 吸水性及吸油性测定
配制不同浓度蛋白质溶液,每5 min震荡1次,30 min后离心,将带有沉淀的离心管烘干至恒重。样品质量记为m,离心管质量记为m1,烘干后的离心管质量记为m2。
配制不同比例样品和油于离心管中,静置30 min,离心,吸去上层液层,再将离心管倒置,吸除流出的油脂。离心管质量记为m3,总质量记为m4。
1.3.2.7 最低凝胶点测定
取不同质量样品溶于0.1 mol/L NaCl溶液中,磁力搅拌器搅拌30 min,调pH至7.0,90 ℃水浴加热30 min,冷藏24 h,观察凝胶情况。
1.3.3 统计分析
2 结果分析
2.1 蛋白质含量
由表1可知,5个红小豆品种的蛋白质质量分数为18.34%~24.03%。其中品鉴红蛋白质含量较高,为24.36%±0.02%;宝清红蛋白质含量最低,为19.32%±0.05%。

表1 5种红小豆蛋白质质量分数
2.2 溶解性分析
5种红小豆蛋白质在不同pH条件下的溶解性如图1所示。由图1可知,当pH=4.0时,5种红小豆蛋白质溶解性均达到最小值,其中农垦红二号溶解度最小,为19.4%;农安红溶解度最大,为22.79%,说明其等电点在4.0左右。当pH>4时,红小豆蛋白质溶解度逐渐升高,农安红在pH=10条件下溶解度可达58.99%,与大豆蛋白溶解度相似[19]。
2.3 表面游离巯基及总巯基含量分析
蛋白质通过巯基与二硫键相互转化在人体内发挥作用,巯基影响蛋白质构象、活性与功能[20]。状元红、农垦红二号、品鉴红、农安红、宝清红红小豆蛋白质游离巯基及总巯基含量如表2所示。表2可知,5种红小豆蛋白质游离巯基及总巯基含量分别为26.3~33.4 μmol/g、42.3~61.6 μmol/g。其中宝清红游离巯基及总巯基含量最高为(33.4 ±5.6) μmol/g和(61.6±3.2) μmol/g且与其他品种有显著差异(P<0.05),状元红游离巯基及总巯基含量均最低,为(26.3±1.7) μmol/g和(42.3±1.3) μmol/g。游离巯基与总巯基的含量是由是由分子间作用力决定的,当蛋白中可溶性小分子发生聚集,巯基包埋会使游离巯基及总巯基含量较低,这也说明状元红蛋白分子的聚集程度较高[21]。
2.4 表面疏水性分析
状元红、农垦红二号、品鉴红、农安红、宝清红红小豆蛋白质疏水性指数如表3所示。由表3可知,5种红小豆疏水性指数为185.6~425.5,均有显著差异(P<0.05),其中农垦红二号疏水性指数最大为425.5±0.5,农安红疏水性指数最小为185.6±1.4。
一般来说,在一定条件下蛋白质的表面疏水性与亲水性呈负相关,即蛋白质疏水性越强,其溶解度则越小[22],因此可知农垦红二号溶解度最小,农安红溶解度最大,这与2.1中溶解度的测定结果相符。

表3 5种红小豆蛋白质疏水性指数
2.5 起泡性及起泡稳定性分析
状元红、农垦红二号、品鉴红、农安红、宝清红红小豆蛋白质的起泡性及起泡稳定性如图2、表4所示。如图2所示,当溶液浓度小于6 g/100 mL时,5种红小豆蛋白质起泡性随浓度升高大幅度升高,当溶液浓度达到6 g/100 mL时,5种红小豆蛋白质起泡性均达到最大,其中状元红起泡性最强可达27.64%,农垦红二号起泡性最弱为22.41%。当溶液浓度继续升高时,起泡性略有降低,这是因为当蛋白浓度达到一定值时,表面形成较厚的吸附膜,不再产生泡沫。
如表4所示,随蛋白质浓度升高,5种红小豆蛋白质起泡稳定性也升高;随静置时间增长,起泡稳定性减弱。其中状元红最为稳定,当蛋白质质量浓度为10 g/100 mL,静置10 min后,其起泡稳定性为84.4%;静置60 min后,起泡稳定性为54.6%,结果略高于芸豆[23]。
2.6 乳化性及乳化稳定性分析
状元红、农垦红二号、品鉴红、农安红、宝清红红小豆蛋白质乳化性及乳化稳定性如图3、图4所示。
由图3可知,红小豆乳化性随蛋白质浓度增大而增大,温青玉等[24]研究也发现蛋白质溶液浓度增大会使体系界面的膜增厚,同时提升膜的强度,乳化性也随之增大。5种红小豆中,农垦红二号乳化性最强,农安红乳化性相对较弱,农垦红二号的乳化性测定结果与2.3中表面疏水性测定结果呈现出一定的相关性,He等[25]通过研究菜豆蛋白也发现蛋白质疏水性与乳化性呈一定的正相关关系,此外,由图4可知,乳化稳定性同样随蛋白质溶液浓度增大而增大,其中农垦红二号乳化稳定性最强可达到65%。
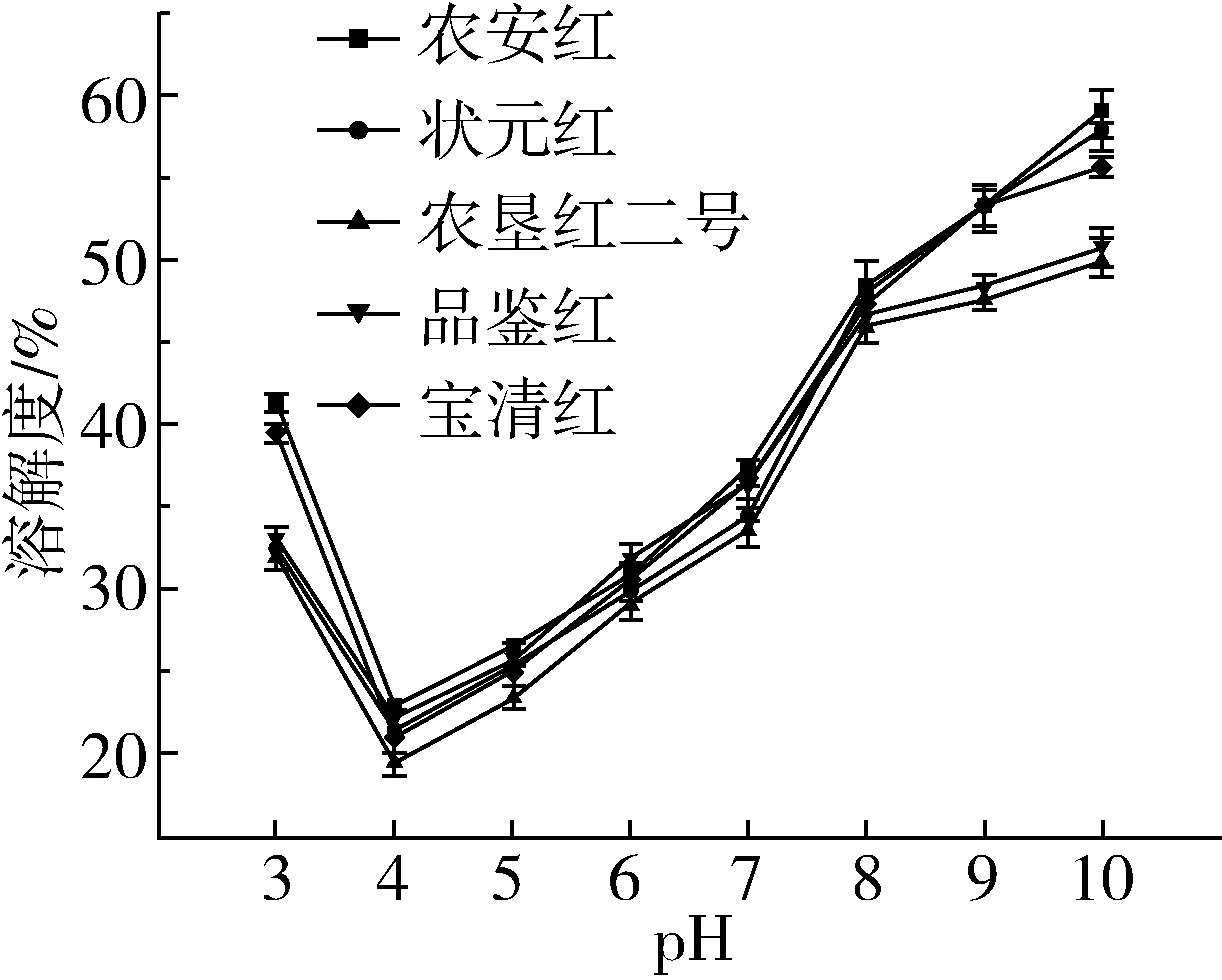
图1 5种红小豆蛋白质溶解性
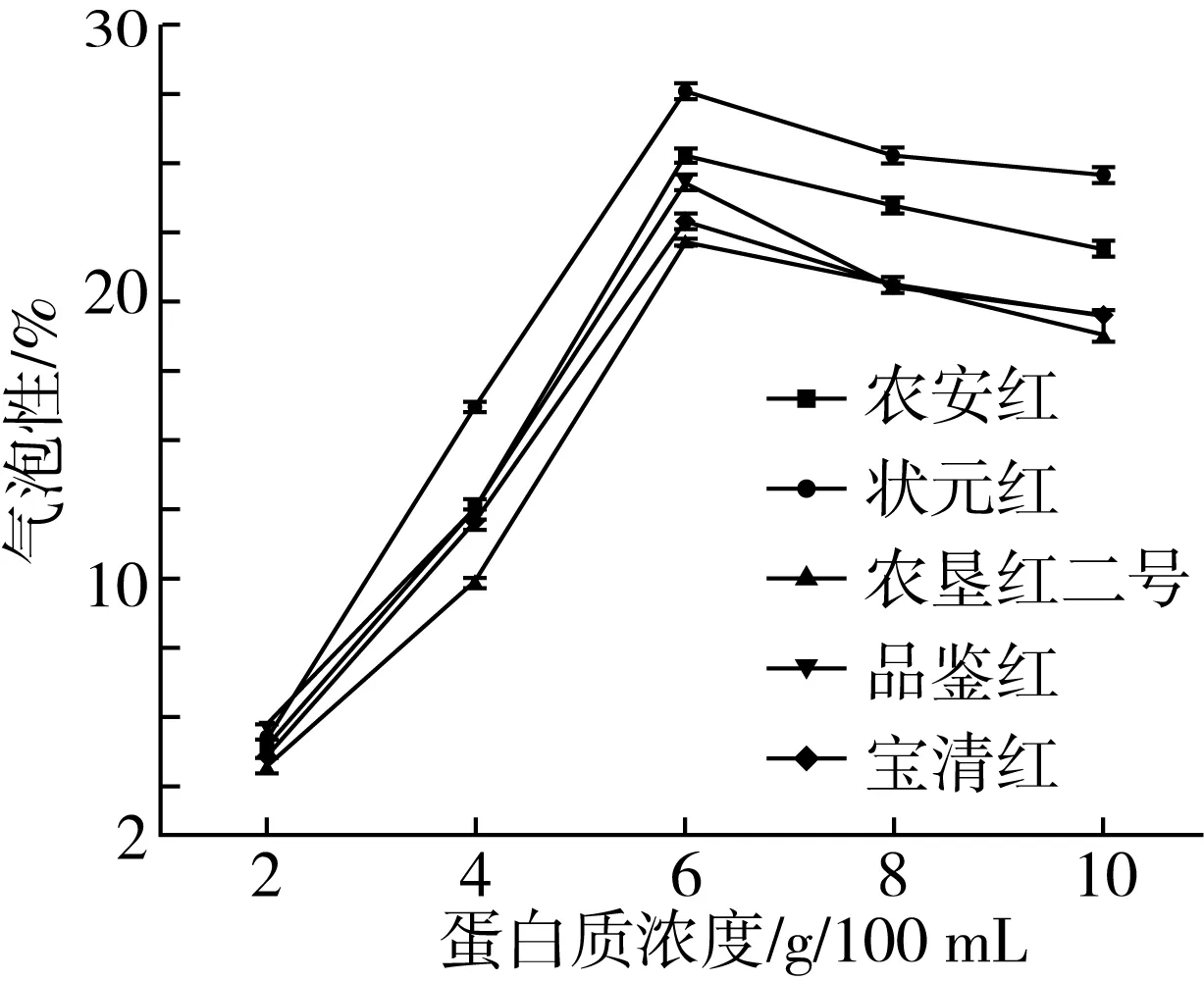
图2 5种红小豆蛋白质起泡性

图3 5种红小豆蛋白质乳化性
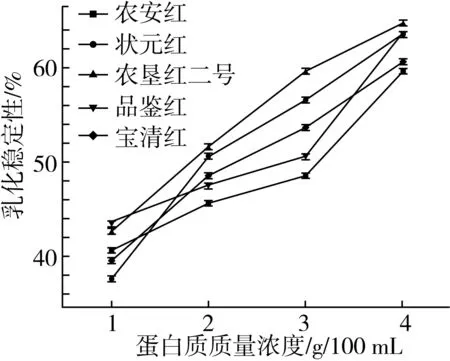
图4 5种红小豆蛋白质乳化稳定性

图5 5种红小豆蛋白质吸水性

图6 5种红小豆蛋白质吸油性

表4 5种红小豆蛋白质起泡稳定性
2.7 吸水性及吸油性分析
状元红、农垦红二号、品鉴红、农安红、宝清红红小豆蛋白质吸水性及吸油性如图5、图6所示。由图5可知,随着蛋白质溶液浓度升高,5种红小豆吸水性均缓慢升高,其中农安红吸水性最强,当溶液质量浓度为10 g/100 mL时,吸水性为2.04%,这是因为溶液浓度增大,蛋白分子中极性基团增多,吸水性也随之增强。由图6可知,随着油的占比增大,5种红小豆的吸油能力也逐渐增强,这是因为增加油的占比后使其与蛋白质疏水基团作用增多,增大其溶解度,同时增强了吸油能力。与2.3中表面疏水性和2.5中乳化性结果比较,农垦红二号表面疏水性、乳化性及吸油性均较强,而吸水性和溶解度较低;农安红表面疏水性、乳化性及吸油性较弱,而吸水性和溶解度较高,变化趋势与江帆等[26]对黑豆蛋白质的表面疏水性、乳化性等性质研究结果一致。
2.8 最低凝胶点分析
状元红、农垦红二号、品鉴红、农安红、宝清红红小豆蛋白质的凝胶形成情况如表5所示。蛋白质溶液浓度升高会使其在水中产生的相互作用力增大,当溶液浓度增大到某一点,使排斥力小于吸引力就可形成有空隙的立体网状结构从而形成凝胶[27]。由表4可知,5种红小豆蛋白质的最低凝胶点为10~13 g/100 mL,其中状元红和品鉴红凝胶点较高,蛋白质质量浓度为13 g/100 mL时形成凝胶;宝清红和农垦红二号凝胶点较低,蛋白质质量浓度为11 g/100 mL就可以形成凝胶。从表2可知:宝清红和农垦红二号的蛋白质游离巯基及总巯基含量也较高,更多的巯基暴露在蛋白质表面,凝胶过程中更容易形成二硫键,这可能使两种红小豆蛋白质的最低凝胶点也较低。

表5 5种红小豆蛋白质最低凝胶点
3 结论
通过对农安红、状元红、农垦红二号、品鉴红、宝清红等5种红小豆蛋白质功能性质进行了研究得出:5种红小豆中品鉴红蛋白质质量分数最高为24.36%±0.02%,并且与其他品质差异显著,在pH 4.0左右时5种红小豆蛋白溶解度达到最低值,其中农垦红二号溶解度最小为19.4%,农安红溶解度最大为22.79%;5种红小豆蛋白质游离巯基、总巯基含量及表面疏水性存在显著差异(P<0.05),宝清红游离巯基及总巯基含量最高为33.4 μmol/g和61.6 μmol/g,农垦红二号疏水性指数最大为425.5;蛋白的表面疏水性、乳化性及乳化稳定性、吸水性和吸油性之间存在一定相关性,其中农垦红二号表面疏水性、乳化性及吸油性均最强,而吸水性和溶解度较低;农安红表面疏水性、乳化性及吸油性最弱,而吸水性和溶解度较高;5种红小豆蛋白质最低凝胶点存在差异,其中宝清红和农垦红二号凝胶点较低,在蛋白质质量浓度为11 g/100 mL就可以形成凝胶。

