乳腺癌内分泌治疗耐药及其逆转的研究进展
孙文婧 ,胡曼婷 ,李 娜 ,葛 菲 ,陈文林 ,刘 洋
(1)昆明医科大学第三附属医院乳腺外一科、云南省肿瘤医院,云南 昆明 650118;2)昆明医科大学第一附属医院乳腺外科,云南 昆明 650032)
内分泌治疗初始阶段的常用药物主要是三类药:选择性雌激素受体调节剂(selective estrogen receptor modulators,SERMs),芳香化酶抑制剂(aromatase inhibitor,AI),卵 巢 功 能 抑 制 剂(ovarian function suppression,OFS),内分泌耐药阶段药物主要有:选择性雌激素受体下调剂(selective estrogen receptor down-regulators,SERDs)。HR阳性是指ER(雌激素受体)和PR(孕激素受体)表达阳性。对于HR表达阳性的乳腺癌,术后一般都需要内分泌治疗。HR+的乳腺癌持续对内分泌治疗敏感的话,预后较好,相反如果出现耐药,无论如何选择不同的内分泌药物其疗效均是有限的,患者无法获得进一步的获益。是否能通过靶向药物实现内分泌药物的逆转,使已经发生耐药的患者重拾内分泌治疗的机会,是临床医生密切关注的问题,现有的内分泌治疗与不同分子靶向药物联合应用在临床试验,很好的诠释了这个科学问题,细胞周期素依赖激酶(cyclin-dependent kinase,CDK)抑制剂,PI3K/AKT/mTOR通路抑制剂,Her2抑制剂与内分泌联合治疗已经用于晚期乳腺癌的治疗,本文系统总结了乳腺癌内分泌联合治疗的临床研究结果和潜在药物,联合应用是未来逆转内分泌治疗耐药的必经之路。
1 联合分子靶向药物
1.1 TKI、抗Her-2、联合内分泌治疗
研究表明[1]吉非替尼(Gefitinib)、EGFR酪氨酸激酶抑制剂或抗HER2抗体曲妥珠单抗联合内分泌药物能够通过阻断EGFR/HER2途径来达到提高内分泌治疗效果的临床效果。一项随机II期试验[2]评估了他莫昔芬加安慰剂或吉非替尼在ER阳性转移性乳腺癌中的作用。该试验评估了两类人群,结果表明吉非替尼联合他莫昔芬能提高内分泌耐药患者的PFS。Ⅲ期随机试验TAnDEM[3]是第一个将内分泌治疗和曲妥珠单抗联合应用于HR(+)/HER2(+)MBC的研究,该试验将绝经后合并HER2/HR阳性MBC的妇女随机分为阿那曲唑(口服1 mg/d)联合曲妥珠单抗(第1天静脉滴注4 mg/kg,然后每周2 mg/kg)和单药阿那曲唑,直至进展。主要终点是治疗组的PFS。结果显示,与单用阿那曲唑相比,曲妥珠单抗加阿那曲唑组患者的PFS有显著改善。靶向药物联合内分泌治疗的效果或许优于单一内分泌治疗,但联合用药的不良事件和严重不良事件可能发生更为频繁。
同样是联合治疗,也有试验研究了不同的治疗组合对同一类患者的疗效对比。最近的一项SOPHIA 3期试验对比了Margetuximab和曲妥珠单抗与化疗联合在对抗Her2治疗耐药的患者中的疗效[4]。Margetuximab具有与曲妥珠单抗相似的HER2结合和抗增殖作用。相比之下,M的Fc区被设计成增加激活Fc受体(FcR)和CD16A两个等位基因的亲和力,并降低对抑制FcR的亲和力。该试验结果显示M延长PFS超过曲妥珠单抗。在含有158F等位基因的CD16A基因型pts中,治疗效果更为明显。表明联合化疗预处理的Her2阳性乳腺癌患者,Margetuximab可改善PFS,安全性与曲妥珠单抗相当。CD16A基因分型提示158F等位基因患者有不同的益处。
1.2 TKI、联合内分泌治疗
而另一个Ⅱ期试验[5]研究了吉非替尼联合阿那曲唑或氟维司群在绝经后激素受体阳性乳腺癌中的抗肿瘤效果和毒性。主要终点是临床受益(完全缓解加部分缓解加上6个月或更长时间的稳定疾病)。在141名符合条件的受试者中72名在阿那曲唑加吉非替尼组,69名在氟维司群加吉非替尼组。阿那曲唑联合吉非替尼的临床受益率为44%(95%CI:33%~57%),氟维司群联合吉非替尼的临床受益率为41%(95%CI,29%~53%)。中位无进展生存期分别为5.3个月(95%CI,3.1~10.4)和5.2个月(95%CI,2.9~8.2)。中位生存期分别为30.3个月(95%CI,21.2~38.9)和23.9个月(95%CI15.4~33.5)。阿那曲唑联合吉非替尼和氟维司群联合吉非替尼治疗雌激素和/或前列腺素受体阳性转移性乳腺癌的临床受益率相似,疗效也不明显优于吉非替尼或单独内分泌治疗,而胃肠道和皮肤毒性却更为显著。故阿那曲唑加吉非替尼的联合治疗可能并不受到推荐,但通过该试验可知,通过预测抗肿瘤活性的生物标记物更为精准筛选受益人群可能是未来分子靶向药物发展的方向。
2 联合CDK4/6抑制剂
细胞周期依赖性激酶CDK4/6是决定细胞从G1期进入S期的关键性调节因子。近年来,CDK抑制剂的研究主要集中在小分子对CDK功能的抑制上,并在临床上得到设计、开发和试用,取得了越来越大的成功。Palbociclib和Ribociclib对CDK4和CDK6的亲和力比其他细胞周期CDKs和CDK9的亲和力高100倍以上[6]。相比之下,Abemacilib的选择性较低,对CDK4/6的亲和力仅为CDK9的6倍,在较高剂量下对CDK1、CDK2和CDK5有一定的活性。
先前的研究已经证实了CDK4/6抑制剂与内分泌治疗的临床疗效。PALOMA-2临床试验验证了帕泊昔布(Palbociclib)加来曲唑组与安慰剂加来曲唑组的中位PFS显著延长。而且在后续的中位随访中也证实了使用帕洛昔布加来曲唑对PFS的改善得以维持,并推迟了化疗的使用(帕洛昔布来曲唑与安慰剂来曲唑的治疗时间分别为40.4个月和29.9个月),达到了维持患者生活质量的作用。这些数据证实,对于ER阳性/HER2阴性的ABC患者,包括那些疾病负担低或无病间隔长的患者,帕泊昔布加来曲唑应当被视为一线治疗的标准。另外,PALOMA-3研究了帕泊昔布加氟维司群与氟维司群加安慰剂的疗效对比,研究结果同样显示,氟维司群与帕泊昔布的联合治疗相比氟维司群单一治疗的无进展生存率显著且持续改善。以上试验可得,对于激素受体阳性、HER2阴性的复发性转移性乳腺癌患者,联合治疗可以被认为是一种治疗选择。
Abemaciclib是另一种CDK4/6抑制剂,MONARCH 3[7]是一项随机、三期、双盲研究,研究对象为Abemacilib/安慰剂(150 mg,每日2次,连续服用)加非甾体类药物(1 mg阿那曲唑或2.5 mg来曲唑,每日服用)。该试验结论得出Abemacilib组的中位PFS明显长于安慰剂组。与安慰剂组(17.46个月)相比,Abemacilib组(27.39个月)的中位反应持续时间更长。与安慰剂组相比最常见的3级不良事件是中性粒细胞减少、腹泻和白细胞减少。由此可见Abemacilib加AIs是一种有效的初始治疗,对HR+,HER2-ABC具有可接受的安全性。
Palbociclib联合内分泌治疗MBC也已获批准。一项Ⅱ期、多中心研究(NCT02549430)检查了在绝经后中度预处理、HR阳性、HER2阴性的晚期乳腺癌患者中,单用帕泊昔单抗和与疾病进展前相同的内分泌治疗(ET)联合应用的帕泊昔单抗的活性。该研究纳入在1次或2次内分泌治疗前进展的晚期疾病患者,随机1∶1接受单用Palbociclib,或Palbociclib联合ET治疗,探索性分析显示,联合治疗的PFS优势出现在接受早期内分泌治疗超过6个月的患者亚组(HR 0.53;95%CI:0.3-0.9,P=0.02),而接受早期内分泌治疗不足6个月的则优势不明显。该研究显示,Palbociclib作为单一药物对中度预处理、雌激素受体阳性、HER2阴性的晚期乳腺癌患者具有临床疗效。Palbociclib可能有逆转既往对内分泌治疗持续反应患者内分泌抵抗的潜力[8]。
第3阶段MalAlESA-2研究显示,在ER+、HER-2阴性晚期乳腺癌患者中,一线药物Ribociclib加来曲唑和安慰剂联合来曲唑可显和著延长PFS。后续的研究中进一步证实了这一点。该研究共有668名绝经后HR+,HER2-复发/转移乳腺癌的妇女被随机(1:1;根据是否存在肝和/或肺转移进行分层)服用Ribociclib(600 mg/d;3周-开/1周-关;28 d治疗周期)加来曲唑(2.5 mg/d;连续)或安慰剂加来曲唑。主要终点是局部评估的PFS。结果显示无论PIK3CA或TP53突变状态、总Rb、Ki67或p16蛋白表达、CDKN2A、CCND1或ESR1 mRNA水平如何,Ribociclib治疗的益处都保持不变。在野生型与受体酪氨酸激酶基因改变的患者中,核糖体的益处更为明显。随访11.1个月后的安全性结果与第1次分析的结果相比较,没有观察到新的或意外的毒性,也没有累积毒性的证据。研究得出,与来曲唑单药治疗相比,用Ribociclib结合来曲唑治疗的疗效和可管理的耐受性得到了长期的随访[9]。
3 联合PI3K/AKT/mTOR抑制剂
如前所述,PI3K/AKT/mTOR信号通路也是目前许多抗耐药治疗研究的热点之一。PI3K/AKT/mTOR抑制剂包括泛PI3K抑制剂(Buparlisib和Pictilisib)、选择性PI3K抑制剂(Alpelisib)和AKT抑制剂(MK2206)、mTOR抑制剂(Everolimus和Temsirolimus)。
BELLE-2试验[10]是一项随机、双盲、安慰剂对照、多中心研究,该研究评估了buparlisib加氟维司群对晚期乳腺癌患者的疗效。该试验纳入了绝经后的HR阳性,Her2阴性的局部晚期或转移性乳腺癌并在先前的芳香化酶抑制剂的治疗中耐药的患者。1 147名患者被随机分配接受Buparlisib(n=576)或安慰剂加氟维司群(n=571)。本研究结果表明,PI3K抑制剂联合内分泌治疗对绝经后内分泌抵抗、激素受体阳性和HER2阴性的晚期乳腺癌有效。使用超选择性的PI3K抑制剂,如α-特异性PI3K抑制剂,有助于进一步提高安全性和临床效益。但这种组合相关的毒性暂时还没有相关研究进行。另一方面,mTOR抑制剂虽然能有效抑制细胞生长和增殖,但同时也通过反馈激活途径诱导AKT磷酸化,可能导致患者对mTOR抑制剂的耐药性。BELLE-3研究了Buparlisib联合氟维司群治疗先前接受过内分泌治疗和mTOR抑制剂治疗后复发的患者,结果显示虽然PFS有所延长,但联合治疗的毒性也随之增加,其安全性和患者的耐受性不一定。Pictilisib是另一种泛PI3K抑制剂,一项随机,双盲,安慰剂对照的2期研究[11]研究了在氟维司群中添加Pictilisib是否能提高雌激素受体阳性、内分泌抵抗乳腺癌的无进展生存率。该试验纳入了≥18岁雌激素受体阳性、HER2阴性的绝经后妇女,她们在辅助治疗或转移治疗中对AIs有抗药性。根据是否有PIK3CA突变将患者分成两部分。结果显示虽然Pictilisib的剂量毒性限制了疗效,但Pictilisib 组的PFS为6.5个月(95%CI,3.7~9.8),安慰剂为5.1个月(2.6~10.4),在氟维司群中加入Pictilisib的有效性得到验证。为了将来评估PI3K抑制是否可以作为克服激素治疗抵抗的方法,可能需要比Pictilisib更具选择性的抑制剂来提高耐受性和潜在的疗效。至于选择性PI3K抑制剂,Alpelisib是其中一种选择性PI3K抑制剂,与内分泌治疗对ER+/PIK3CA突变乳腺癌细胞具有协同抗肿瘤作用。BYL719这项Ib期研究[12]评估了Alpelisib联合来曲唑治疗对内分泌治疗无效的转移性ER+乳腺癌患者的安全性、耐受性和初步活性。该研究显示来曲唑联合曲唑酮是相对安全且具有可逆的作用,其临床活动与PIK3CA突变状态无关,但PIK3CA突变肿瘤患者的临床获益比例却较高。该药与内分泌的联合治疗的研究正在进行。对于mTOR抑制剂依维莫司(Everolimus),先前的BOLERO-2试验已经证明,在HR阳性/Her2阴性的曾接受过AIs治疗的晚期乳腺癌患者中,依西美坦中加入依维莫司可延长无进展生存期两倍以上。且在后续的测序研究中也表明,无论PIK3CA、FGFR1和CCND1的改变状态或它们所组成的途径如何,依维莫司的无进展生存效益均可以得以维持。至于染色体不稳定性和低频遗传改变对依维莫司疗效是否存在潜在影响值得进一步研究[13]。另外,也有1期试验研究了在转移性ER阳性,HER2阴性乳腺癌患者中MK-2206与阿那曲唑、氟维司群联合应用时的疗效。结果显示42%(95%CI,23%~63%)的患者在6个月内获得了无进展的临床疗效。反应与肿瘤PIK3CA突变无关。由此可得,MK-2206加内分泌治疗是可以耐受的。MK-2206与阿那曲唑联合治疗新诊断的ER(+)HER2(-)乳腺癌的II期新辅助试验正在进一步评估中[14]。以上所述联合治疗的临床研究结果和潜在药物见表1。
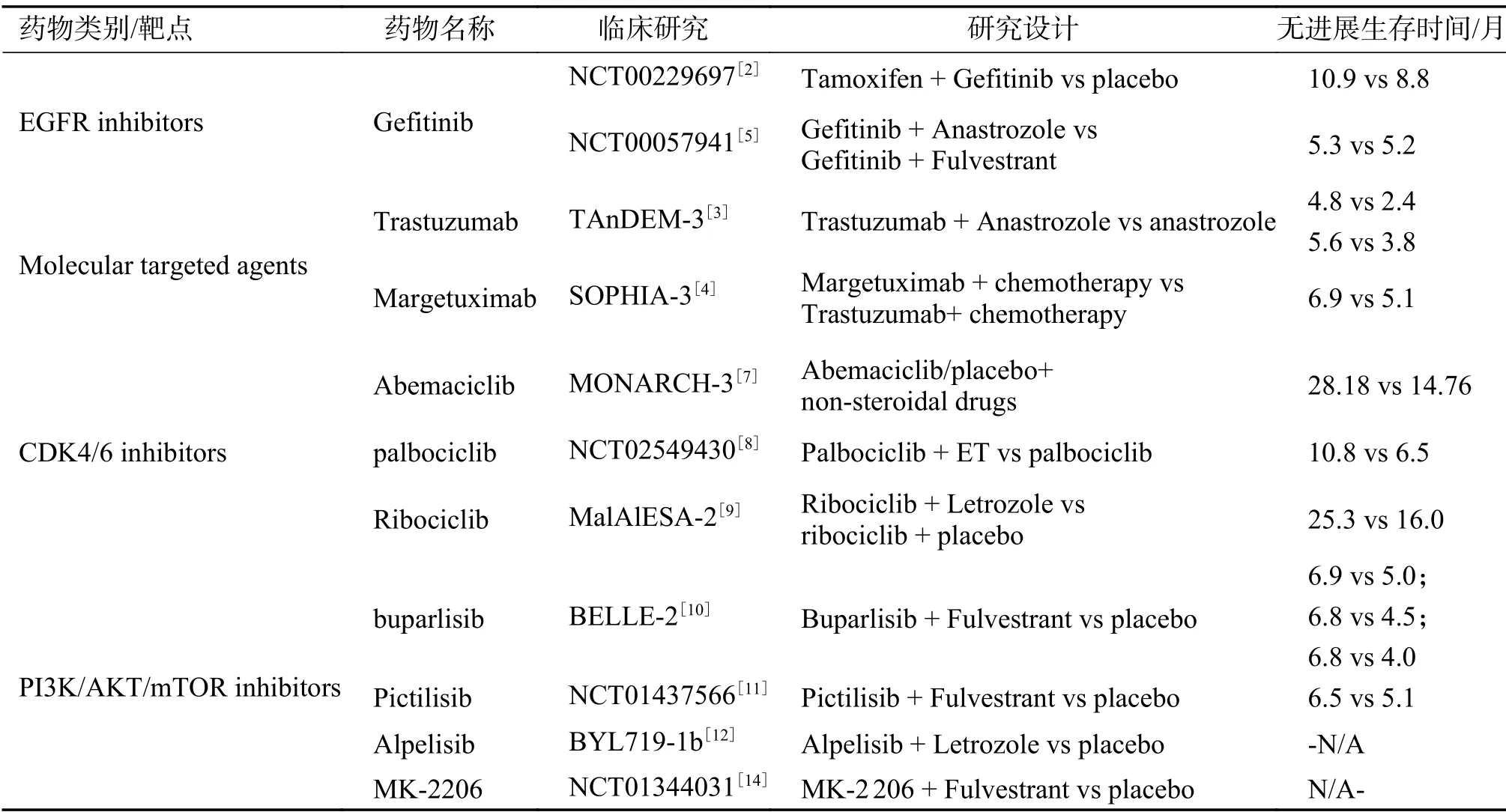
表1 HR+乳腺癌的内分泌联合治疗Tab.1 Endocrine combined therapy for HR+breast cancer
4 其他治疗
既往的队列研究结果已经证实,合并糖尿病的乳腺癌患者预后更差,可能与患者胰岛素抵抗和高胰岛素血症有关。接受二甲双胍治疗的乳腺癌患者在激素受体阳性、HER2阳性的肿瘤中能显示出较好的预后[15]。二甲双胍治疗在糖尿病患者的全身治疗中可以提供生存益处。另一项ALTTO试验[16]将HER2+乳腺癌患者随机分为单用曲妥珠单抗、单用拉帕替尼、序贯或联合用药1 a。在这个亚研究中,评估了研究开始时糖尿病患者接受或不接受二甲双胍治疗是否与糖尿病患者的不同无病生存率(DFS)、远处无病生存率(DDFS)和总生存率(OS)相关。结果显示与接收二甲双胍治疗的患者相比,未接收二甲双胍治疗的患者出现更严重的DFS([HR]=1.40;95%CI=1.01~1.94;P=0.43)、DDFS(多变量HR,1.56;95%CI,1.10~2.22;P=0.13)和OS(多变量HR,1.87;95%CI,1.23~2.85;P=0.04)。该研究是首个发现二甲双胍治疗可以改善HER2阳性乳腺癌合并糖尿病患者预后的前瞻研究分析,同时也进一步证实了在HER2阳性的患者中,糖尿病患者预后更差。与既往的研究结果相同,二甲双胍的逆转效果仅限于HR阳性患者;对于HR阴性患者,无论是否合并糖尿病并不影响患者的生存。提示二甲双胍可能是通过直接或间接的方式影响人体的代谢,降低胰岛素,血糖,瘦素和炎症因子的水平,进而下调肿瘤细胞的JAK2-STAT3和PI3K-AktmTOR通路。细胞实验也显示,二甲双胍可以通过抑制AMPK激活和下游靶点mTOR,抑制JAK2-STAT3通路。在乳腺癌患者中,约5%患者合并有糖尿病,这部分人群值得笔者重点关注。虽然该研究并不能提供高水平的研究证据,但对未来研究提供了很好的基础,后续期望开展前瞻性研究,进一步明确二甲双胍治疗对HER2阳性乳腺癌合并糖尿病的患者生存的影响。
微生物治疗与内分泌治疗的联合或许是新的研究思路。肠道微生物群的多样性和其组成可能通过调节体内雌激素和炎症水平而影响乳腺癌风险。通过确定乳腺癌与炎症标记物、雌激素水平和粪便微生物的关系来验证这一假设,结果显示与对照组相比,乳腺癌患者与IgA阳性和IgA阴性肠道菌群有显著的雌激素相关关系。这表明肠道微生物群可能通过改变新陈代谢、雌激素循环和免疫压力来影响乳腺癌风险[17]。
5 未来的方向
IGF-1R和下游信号通路过度激活与ER阳性乳腺癌的耐药有关,目前关于IGFR抑制剂的研究已经在进行中。有研究使用绝经后雌激素依赖性乳腺癌模型测试了单独的IGF-1R/ISR酪氨酸激酶抑制剂BMS-74807单独使用和联合来曲唑或他莫昔芬的抗肿瘤作用[18]。结果显示BMS-74807在体外表现出抗增殖作用,并与来曲唑或氟维司群有协同增效作用。类似地,BMS-754807与他莫昔芬或来曲唑的联合治疗在体内也引起了肿瘤回归,而这一效果是通过单药治疗未曾达到的。表明该药在一定程度上延迟了内分泌治疗耐药的发生。这些结果为BMS-754807作为抗肿瘤药物与激素敏感乳腺癌的激素疗法的联合使用提供了一个临床前的概念证明。IGFR抑制剂和内分泌治疗的联合治疗或许将是未来研究的方向之一。
新的靶向药物也正在研究中。DESTINY-Breast试验证实了一种新的HER2靶向抗体药物结合物DS-8201对使用过TDM-1预处理的患者的安全性,耐受性和明确的客观疗效[19]。DS-8201与其他药物进行对比的三期试验也正在进行中。笔者期待新的试验结果。
另外,有研究发现 LBD突变型ERα是临床内分泌耐药的主要原因之一,并提示更有效的ER拮抗剂或许具有更实质性的治疗效果[20]。最近有研究[21]鉴定了H3B-5942,它属于ERα拮抗剂的一类,称为选择性雌激素受体共价拮抗剂(SERCA)。它通过靶向Cys530和增强独特的拮抗剂构象,共价灭活野生型和突变型ERα。体外比较H3B-5942与标准护理(SoC)和实验药物,证实ERαWT和ERαMUT细胞系的拮抗活性增强。在体内,H3B-5942在代表ERαWT和ERαY537S乳腺癌的异种移植模型中显示出显著的单药抗肿瘤活性且疗效优于Fulvestrant。最后,在ERα WT和ERαMUT细胞系和/或肿瘤模型中,H3B-5942结合CDK4/6或mTOR抑制剂可进一步提高其效力。综上所述,SERCA H3B-5942与ERαWT和ERαMUT的C530结合,促进独特的拮抗剂构象,并显示出比SoC药物更高的体内外活性。重要的是,与CDK4/6或mTOR抑制剂联合使用可进一步提高单药疗效。
在临床内分泌抵抗的治疗中,仍然迫切需要更具有长期效益的预测性生物标记物以指导更好的治疗。TRAIL是一种与免疫相关的凋亡蛋白,已被证明能在保留正常细胞的同时特异性靶向癌细胞。最近有研究发现,获得性内分泌抵抗的乳腺癌细胞系及其组成的肿瘤干细胞(CSC亚群对TRAIL治疗确实敏感,并且这种敏感性与通过翻译后机制降低c-FLIP水平相关[22]。并证实了一种新的机制,即ER阳性乳腺癌对内分泌治疗的获得性耐药可以通过翻译后c-FLIP的下调赋予TRAIL适应性及敏感性,这一机制具有治疗和预后潜力。并可能未来能为靶向内分泌耐药乳腺癌提供一种新的分层方法。
关于CDK4/6抑制剂的的疗效检测也在研究当中。最近的一项试验[23]研究了在趋势研究(NCT 02549430)队列中不同时间点测得的血浆TKa的作用。先前的研究表明,Palbociclib会导致Rb蛋白磷酸化减少,进而导致E2F活性降低,最终导致细胞周期停滞。胸腺嘧啶核苷激酶1是E2F途径下游的一个著名的肿瘤增殖标记物,其活性可在血浆中作为肿瘤增殖的水平来测量。循环胸腺嘧啶激酶活性(TKa)是接受内分泌治疗治疗的MBC患者(pts)在基线和治疗期间的预后指标。先前研究表明,新辅助剂Palbociclib加内分泌治疗pts 15 d后,TKa降低,这是Palbociclib治疗的药效学改变。该试验将115名接受中度预处理的Luminal MBC的pts患者分为2组,分别接受单药Palbociclib或Palbociclib加上先前接受的相同的ET治疗。数据结果首次表明,TKa可能是Palbociclib治疗时MBC无创监测的一个有用的预后生物标记物,这些结果值得在更大样本集中进一步研究。
也有越来越多的证据表明,运动和体重管理可以在一定程度上改善整体健康,降低了癌症患者的发病率和死亡率[24]。
6 小结
在这篇综述中,笔者大致总结了近年来提出的一些延缓或逆转内分泌耐药的方法,也有一些新的药物和药物组合的临床试验正在研究中(图1)。诸多研究和证据均表明,在传统抗雌激素治疗的基础上联合靶向药物的效果优于单一治疗。或许未来新的耐药机制和联合治疗方案的发现能使乳腺癌的治疗更加精准长久,让HR+患者内分泌耐药患者重新走向治愈之路。
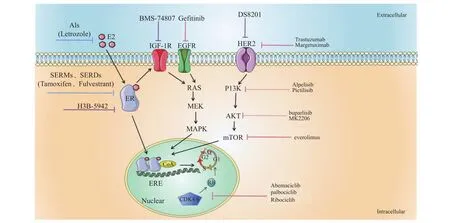
图1 内分泌治疗的经典药物和联合靶向药物的相关通路和作用位点Fig.1 Related pathways and action sites of classical drugs and combined targeted drugs in endocrine therapy

